
Nitrato de chumbo (II)
Sobre este escolas selecção Wikipedia
Esta seleção wikipedia foi escolhido por voluntários que ajudam Crianças SOS da Wikipedia para este Seleção Wikipedia para as escolas. Uma boa maneira de ajudar outras crianças é por patrocinar uma criança
| Nitrato de chumbo (II) | |
|---|---|
 | |
 | |
Nitrato de chumbo (II) | |
Outros nomes Nitrato de chumbo | |
| Identificadores | |
| Número CAS | 10099-74-8 |
| Número RTECS | OG2100000 |
| Propriedades | |
| Fórmula molecular | Pb (NO 3) 2 |
| Massa molar | 331,2 g / mol |
| Aparência | Sólido branco inodoro |
| Densidade | 4,53 g / cm³ |
| Ponto de fusão | Decompõe-se a 290-470 ° C |
| Solubilidade em água | 52 g / 100 ml (20 ° C) |
| Solubilidade em ácido nítrico em etanol em metanol | insolúvel 1 g / 2500 ml 1 g / 75 ml |
| Estrutura | |
| A estrutura de cristal | Cúbica de face centrada |
| Coordenação geometria | cuboctahedral |
| Perigos | |
| MSDS | MSDS External |
| Índice da UE | 082-001-00-6 |
| Classificação da UE | Tóxico (T) Perigoso para o ambiente (N) Repr. 1/3 |
| Frases R | R61, R20 / 22, R33, R62, R50 / 53 |
| Frases-S | S53, S45, S60, S61 |
| NFPA 704 |  0 3 3 OX |
| Ponto de centelha | Não inflamável |
| Os compostos relacionados | |
| Outros aniões | Chumbo (II) cromato Sulfeto de chumbo (ii) |
| Outros cátions | Nitrato de sódio Nitrato de magnésio |
| Os compostos relacionados | Óxido de chumbo (II) Ácido nítrico |
| Página Suplementar dados | |
| Estrutura e Propriedades | N, ε r, etc. |
| Termodinâmica dados | Comportamento de fase Sólido, líquido, gasoso |
| Os dados espectrais | UV, IV, RMN , MS |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
Nitrato de chumbo (II) é um composto inorgânico com a fórmula química de Pb ( NO 3) 2. É comumente ocorre como um gás incolor cristal ou pó branco e, ao contrário da maioria outro de chumbo (II) sais , é solúvel em água .
Conhecido desde a Idade Média pela dulcis nome prumo, a produção de nitrato de chumbo (II) a partir de qualquer metálica de chumbo ou óxido de chumbo em ácido nítrico foi em pequena escala, para uso direto em fazer outro compostos de chumbo. Na liderança do século 19 nitrato (II) começou a ser produzido comercialmente na Europa e nos Estados Unidos. Historicamente, a utilização principal era como matéria-prima na produção de pigmentos para tintas de chumbo, mas essas tintas foram substituídos pelas tintas menos tóxicos baseados em dióxido de titânio. Outros usos industriais incluídos calor estabilização e nylon poliésteres, e em revestimentos de papel fototermográfico. Desde por volta do ano 2000, a liderança nitrato (II) começou a ser utilizado em cianetação de ouro.
Chumbo (II) é nitrato tóxico, uma agente de oxidação, e é classificado como provavelmente cancerígeno para os seres humanos por parte do Agência Internacional para Pesquisa sobre o Câncer. Por conseguinte, deve ser manuseado e guardado as devidas precauções de segurança para evitar a inalação, a ingestão eo contato com a pele. Devido à sua perigosidade, as aplicações limitadas nitrato de chumbo (II) estão sob escrutínio constante.
História
Desde a Idade Média, nitrato de chumbo (II) tem sido produzido como uma matéria-prima para a produção de pigmentos coloridos na tintas de chumbo, tal como amarelo de cromo (lead (II) cromato), laranja cromo (lead (II) cromato de hidróxido) e semelhante compostos de chumbo. Estes pigmentos foram usadas para tingimento e estampagem chita e outros produtos têxteis.
Em 1597, o alemão alquimista Andreas Libavius descreveu pela primeira vez o composto, cunhando os nomes medievais de dulcis prumo e calx prumo dulcis, que significa "doce chumbo", devido ao seu sabor. Embora originalmente não entenderam durante os séculos seguintes, o decrepitação propriedade de chumbo (II), nitrato de levou à sua utilização em especial partidas explosivos, tais como azida de chumbo.
O processo de produção foi e ainda é quimicamente simples, efetivamente dissolvendo chumbo no aqua fortis ( ácido nítrico ) e, posteriormente, a colheita da precipitar. No entanto, a produção manteve-se em pequena escala por muitos séculos, e a produção comercial de chumbo (II) de nitrato como matéria-prima para o fabrico de outros compostos de chumbo não foi relatada até 1835. Em 1974, o US consumo de compostos de chumbo, exceto os pigmentos e aditivos de gasolina, foi de 642 toneladas.
Química
Química aquosa
Chumbo nitrato (II) prontamente dissolve-se em água para dar uma solução clara, incolor. Como substância iónica, a dissolução de chumbo (II), nitrato de envolve dissociação nos seus iões constituintes.
- Pb (NO 3) 2 ( s ) → Pb 2+ ( aq) + 2 NO 3 - (aq)
Qualquer solução contendo o chumbo (II) vai reagir com o catião de uma solução contendo o anião iodeto para produzir um precipitado do brilhante amarelo-alaranjado iodeto de chumbo (II). Esta reacção é frequentemente utilizado para demonstrar a precipitação, devido à mudança de cor marcante observado, sob o nome de vaso-o-ouro ou chuva de ouro:
- Pb 2+ (aq) + 2 I - (aq) → PBI 2 (s)
Semelhante reacções de metátese ter lugar na fase sólida quando sólidos adequados, tais como iodeto de potássio e de chumbo (II) nitrato, são misturados e moídos finamente usando um almofariz e pilão.
- Pb (NO 3) 2 (s) + 2 Kl (s) → PBI 2 (s) + 2 KNO 3 (s)
A cor da mistura resultante irá depender da quantidade relativa do reagentes utilizados e do grau de moagem; em todo o caso, a cor será mais pálida do que o de chumbo (II), iodeto puro, devido à presença de sólidos brancos dentro da mistura.
Além de nitrato de chumbo (II), chumbo (II) acetato é o único outro composto de chumbo solúvel comum. Quase todos os outros compostos de chumbo são insolúveis em água, mesmo quando combinada com aniões habitualmente muito solúveis. Por exemplo, de chumbo (II), cloreto de de chumbo (II) e brometo chumbo (II) iodeto, conhecidos coletivamente como chumbo halogenetos, são apenas fracamente solúveis em água (menos do que 0,01 mol / l) à temperatura ambiente, e apenas ligeiramente mais perto do ponto de ebulição. Isto significa que o chumbo (II), nitrato tem particular importância como um ponto de partida para a produção de compostos de chumbo insolúveis através decomposição dupla.
As soluções quentes de halogenetos de chumbo pode ser levado à precipitação por arrefecimento para criar penas, cristais iridescentes suspenso em água, a cor de cristal que depende do halogeneto particular (cloreto = branco, brometo = lustre, iodeto = amarelo). Estes cristais aparecem de repente, exigindo apenas um local de nucleação assim que a temperatura da solução caiu suficientemente para que a solução seja supersaturada. Este efeito é usado para demonstração de solubilidade em salas de aula.
Quando concentrada de hidróxido de sódio a solução é adicionada a solução de nitrato de chumbo (II), nitratos básicos são formados, mesmo bem passado, a ponto de equivalência. Para cima através do ponto de equivalência metade, Pb (NO 3) 2 · Pb (OH) 2 predomina, em seguida, a partir deste ponto de Pb (NO 3) 2 · 5PB (OH) 2 é formado. Nenhuma simples Pb (OH) 2 é formado até pelo menos pH 12.
A estrutura de cristal
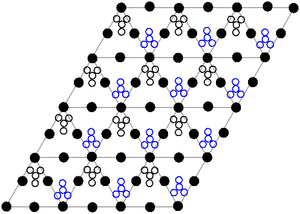
O estrutura de cristal de chumbo sólido nitrato de (II) foi determinado pela difração de nêutrons. O composto cristaliza no sistema cúbico com os átomos de chumbo em um de face centrada sistema cúbico. Sua grupo espacial é Pa3 Z = 4 ( Bravais notação rede), com cada um dos lados do cubo com um comprimento de 784 picômetros.
Os pontos pretos representam os átomos de chumbo, os pontos brancos os grupos nitrato picômetros 27 acima do plano dos átomos de chumbo, e os pontos azuis os grupos nitrato da mesma distância abaixo deste plano. Nesta configuração, cada átomo de chumbo é colado a doze átomos de oxigénio ( comprimento de ligação: 281 horas). Todos os comprimentos N-O obrigacionistas são idênticos, em 127 picômetros.
Investigação interesse na estrutura de cristal de nitrato de chumbo (II) foi, em parte, baseado na possibilidade de rotação interna livre dos grupos nitrato dentro da rede do cristal, a temperaturas elevadas, mas isto não aconteceu.
Complexação
Nitrato de chumbo (II) está associado com interessante química supramolecular por causa da sua coordenação de nitrogênio e de oxigênio compostos dadores de electrões. O interesse é em grande parte acadêmica, mas com várias aplicações potenciais. Por exemplo, nitrato de chumbo e combinando pentaetileno-glicol (EO 5) em uma solução de acetonitrilo e metanol seguido por lento evaporação produz um novo material cristalino [Pb (NO 3) 2 (5 OE)]. Na estrutura de cristal para este composto, a cadeia de óxido de etileno 5 é enrolada em torno do ião chumbo numa plano equatorial semelhante à de um éter coroa. O nitrato de dois bidentado ligandos estão em configuração trans. O total número de coordenação é de 10, com o íon de chumbo em um bicapped antiprisma quadrado geometria molecular.
O complexo formado por nitrato de chumbo (II), de chumbo (II) e um perclorato bidentado bithiazole N-doador de ligando é binuclear, com um grupo nitrato de ponte entre os átomos de chumbo com número de coordenação de 5 e 6. Um aspecto interessante deste tipo de complexos, é a presença de uma abertura física no esfera de coordenação; isto é, os ligandos não são colocados simetricamente em torno do ião metálico. Isto é potencialmente devido a um chumbo par de electrões, também encontrado em complexos de chumbo com um ligando imidazol.
Este tipo de química não é exclusivo para o sal de nitrato; de chumbo (II) de outros compostos tais como chumbo (II) brometo também formar complexos, mas o nitrato é usado freqüentemente por causa de suas propriedades de solubilidade e sua natureza bidentada.
Oxidação e decrepitação
Chumbo (II) de nitrato é um agente oxidante. Dependendo da reacção, isto pode ser devido ao Pb 2+ (aq) de iões, o que tem um padrão potencial de redução (P 0) de -0,125 V, ou o ião de nitrato, que em condições ácidas tem um E 0 de 0,956 V.
Quando aquecidas, chumbo (II) cristais de nitrato de decompor a de chumbo (II), óxido de dioxigénio e o dióxido de azoto, acompanhada por um ruído de crepitação. Este efeito é referido como decrepitação.
Devido a esta propriedade, nitrato de chumbo é usado às vezes em pirotecnia, tais como fogos de artifício.
Elaboração e produção
Chumbo nitrato (II) não ocorre naturalmente. O composto pode ser obtido por dissolução de metal de chumbo numa solução aquosa de ácido nítrico :
- 3 Pb (s) + 8 H + (aq) + 2 NO 3 - (aq) → 3 Pb2 + (aq) + 2 NO (g) + 4H 2 O (l)
Mais comumente, nitrato de chumbo (II) é obtido por dissolução de chumbo (II) de óxido, que é prontamente disponível como um mineral , em ácido nítrico em solução aquosa:
- PbO (s) + 2H + (aq) → Pb 2+ (aq) + H2O (l)
Em ambos os casos, uma vez que o solvente é ácido nítrico concentrado (em que o chumbo (II), nitrato tem uma solubilidade muito baixa) e a solução resultante contém nitrato , iões de cristais anidros de nitrato de chumbo (II) formam-se espontaneamente:
- Pb 2+ + 2 NO 3 - → Pb (NO 3) 2 (s)
A maioria comercialmente disponível de chumbo (II), nitrato, bem como material de laboratório escala, é produzido em conformidade. A oferta é em sacos de 25 kg até 1.000 kg sacos grandes, e em recipientes de laboratório, tanto por parte dos produtores gerais de produtos químicos de laboratório e por produtores de chumbo e compostos de chumbo. Não foram observados produção em larga escala.
No tratamento com ácido nítrico de resíduos contendo chumbo, por exemplo, no processamento de chumbo bismuto resíduos de refinarias de chumbo, soluções impuros nitrato de chumbo (II) são formados como subproduto. Estas soluções são relatados para ser utilizado no processo de cianetação de ouro.
Aplicações
Devido à natureza perigosa de chumbo nitrato (II), há uma preferência pela utilização de alternativas em aplicações industriais. No antigo major aplicação de tintas de chumbo, que tem sido largamente substituídos por dióxido de titânio. Outras aplicações históricas de chumbo nitrato (II), como em jogos e fogos de artifício, diminuíram ou cessaram também. As aplicações correntes de nitrato de chumbo (II) incluem o uso como um estabilizador de calor em nylon e poliésteres, como um revestimento para fototermográfico papel, e em rodenticidas.
Numa escala de laboratório, nitrato de chumbo (II) fornece uma das duas fontes convenientes e seguros de tetróxido de diazoto. Por secagem cuidadosamente nitrato de chumbo (II) e, em seguida, aquecendo-a num recipiente de aço, dióxido de azoto é produzido junto com o dioxigénio para o seguinte equação decripitation mostrado acima. Alternativamente, o dióxido de azoto é formada quando o ácido nítrico concentrado é adicionado a limalha de cobre ; neste caso, o monóxido de azoto substancial também pode ser produzido. Em qualquer caso, o dióxido de azoto resultante existe em equilíbrio com o seu dímero:
- 2 NO 2 ⇌ N 2 O 4
A fim de remover qualquer impureza, a mistura de gás é condensado e destilado fraccionadamente para dar uma mistura de NO 2 e N 2 O 4. À medida que a dimerização é exotérmica, baixas temperaturas favorecem N 2 O 4 como as espécies dominantes.
Para melhorar a processo de lixiviação na cianetação ouro, é adicionado de chumbo (II) uma solução de nitrato. Embora um processo em massa, apenas quantidades limitadas (10 a 100 miligramas de chumbo (II) por quilograma de nitrato de ouro) é necessária. Tanto o próprio cianetação, bem como o uso de compostos de chumbo no processo, são consideradas controversa devido à natureza tóxica dos compostos.
Segurança
Nitrato de chumbo (II) é tóxico, e ingestão podem levar a intoxicação aguda do chumbo, como é o caso para todos os compostos de chumbo solúvel. Tudo compostos inorgânicos de chumbo são classificados pela Agência Internacional para a Investigação do Cancro (IARC) como provavelmente cancerígeno para os seres humanos (Categoria 2A). Eles têm sido associados a cancro renal e glioma em animais experimentais e ao câncer renal, cancro cerebral e câncer de pulmão em seres humanos, embora estudos de trabalhadores expostos ao chumbo são muitas vezes complicada por exposição concomitante ao arsênico . O chumbo é conhecido para substituir o zinco em um número de enzimas, incluindo δ-aminolevulínico desidratase do ácido (sintase porfobilinogénio) no heme via biossintética e pirimidina-5'-nucleotidase, importante para o metabolismo correcto de ADN .
Para evitar a inalação, ingestão e exposição da pele, o chumbo nitrato (II) devem ser tratados de uma câmara de exaustão, com o rosto, corpo e proteção das mãos. Instruções especiais para manuseamento estão incluídas em todos Fichas de dados de segurança de materiais (MSDS). Após o uso, todo o material e os seus recipientes deverão ser eliminados como resíduos perigosos. Derramamentos e liberação para o meio ambiente deve ser evitada.

