
Chumbo
Fundo para as escolas Wikipédia
Crianças SOS voluntários ajudaram a escolher artigos e fez outro material currículo Patrocinar filhos ajuda as crianças no mundo em desenvolvimento para aprender também.
| Chumbo | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
82 Pb | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||||||||||||||
cinza metálico  | ||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | chumbo, Pb, 82 | |||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / l ɛ d / LED | |||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | metais de transição pós- | |||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 14, 6, p | |||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 207.2 | |||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 4f 14 5d 10 6s 2 6p 2 2, 8, 18, 32, 18, 4 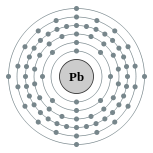 | |||||||||||||||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Médio Easterns ( 7000 aC) | |||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 11,34 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 10,66 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 600,61 K , 327,46 ° C, 621,43 ° F | |||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 2022 K, 1749 ° C, 3180 ° F | |||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 4,77 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 179,5 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 26,650 J · · mol -1 K -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 4, 3, 2, 1 ( Anfotérico óxido) | |||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 2,33 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 715,6 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||
| 2: 1450,5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||
| 3: 3081,5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 175 pm | |||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 146 ± 17:00 | |||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 202 pm | |||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | cúbica de face centrada  | |||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | |||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 208 Nco · m | |||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 35,3 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) 28,9 uM · · K -1 m -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | ( RT) (recozido) 1190 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | 16 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 5.6 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | 46 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0.44 | |||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 1,5 | |||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 38,3 MPa | |||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7439-92-1 | |||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de chumbo | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
O chumbo é um elemento químico no grupo de carbono com o símbolo Pb (do latim : Plumbum) e número atômico 82. O chumbo é um suave e maleável de metal , que é considerado como um heavy metal e pobre metal. Chumbo metálico tem uma cor branco-azulado após a recém-cortada, mas logo mancha de uma cor acinzentada maçante quando exposto ao ar. O chumbo tem um brilhante brilho cromo-prata quando é derretido em um líquido.
O chumbo é utilizado na construção civil, baterias de chumbo-ácido, balas e tiro, pesos, como parte de soldas, pewters, ligas fusíveis, e como um escudo de radiação. O chumbo tem o maior número atômico de todo o elementos estáveis, embora o elemento seguinte mais elevado, de bismuto , possui uma semi-vida que é tão longo (por muito mais tempo do que a idade do universo) que pode ser considerada estável. Seus quatro estáveis isótopos tem 82 prótons , um número mágico na modelo de escudo nuclear de núcleos atômicos .
O chumbo, em certos graus de contacto, é uma substância tóxica para os animais, incluindo os seres humanos. Danifica os sistema nervoso e provoca cerebrais distúrbios. Chumbo excessiva também causa doenças do sangue em mamíferos. Como o elemento mercúrio , outro metal pesado, o chumbo é um neurotoxina que se acumula tanto nos tecidos moles e dos ossos. Intoxicação por chumbo tem sido documentada a partir de Roma antiga , Grécia antiga , e China antiga .
Características

O chumbo é um metal brilhante e prateado com um muito ligeiro tom de azul em uma atmosfera seca. Ao entrar em contacto com o ar, ele começa a manchar através da formação de uma mistura complexa de compostos, dependendo das condições. A cor dos compostos pode variar. A camada de manchas pode conter quantidades significativas de carbonatos e hydroxycarbonates. Ele tem algumas propriedades características: alta densidade , suavidade, ductilidade e maleabilidade, pobre condutividade eléctrica em comparação com outros metais, elevada resistência à corrosão e capacidade de reagir com os produtos químicos orgânicos.
Vários vestígios de outros metais alterar significativamente as suas propriedades: a adição de pequenas quantidades de antimónio ou de cobre a vantagem aumenta a dureza da liga e melhora a resistência à corrosão de ácido sulfúrico . Alguns outros metais também melhorar única dureza e luta fadiga do metal, tais como cádmio , estanho , ou telúrio ; metais como sódio ou de cálcio também têm essa capacidade, mas eles enfraquecer a estabilidade química. Finalmente, zinco e bismuto simplesmente prejudicar a resistência à corrosão (0,1% de teor de bismuto é o limite de uso industrial). Em contrapartida, na sua maioria impurezas de chumbo piorar a qualidade dos materiais industriais, embora haja excepções: por exemplo, pequenas quantidades de chumbo melhorar a ductilidade do aço.
O chumbo tem apenas um allotrope comum, que é cúbico, com a distância de chumbo-chumbo sendo 349 de face centrada pm. No 327,5 ° C (621,5 ° F), de chumbo funde; o ponto de fusão é superior ao da lata (232 ° C, 449,5 ° F), mas significativamente inferior ao de germânio (938 ° C, 1721 ° F). O ponto de ebulição de chumbo é de 1749 ° C (3180 ° F), o que é abaixo de ambos os estanho (2602 ° C, 4716 ° F) e germânio (2833 ° C, 5131 ° F). Densidades aumentar para baixo o grupo: o Ge e valores Sn (5,23 e 7,29 g · cm -3, respectivamente) são significativamente inferior ao de chumbo: 11,32 g · cm -3.
Um átomo de chumbo tem 82 elétrons, que tem uma configuração eletrônica do [ Xe ] 4f 14 5d 10 6s 2 6p 2. Nos seus compostos, chumbo (ao contrário da outra grupo 14 elementos) mais comumente perde seus dois e não quatro elétrons mais externos, tornando-se íons de chumbo (II), Pb 2+. Tal comportamento incomum é racionalizado, considerando a efeito par inerte, o que ocorre devido à estabilização dos 6s-orbital devido a efeitos relativistas, que são mais fortes mais perto da parte inferior da tabela periódica. Tin mostra um tal efeito mais fraco: estanho (II) ainda é um redutor.
Os números para eletrodo mostra potencial que levam é apenas um pouco mais fácil para oxidar do que hidrogénio . Chumbo, portanto, pode dissolver-se em ácidos, mas isto é muitas vezes impossível devido a problemas específicos (tais como a formação de sais insolúveis). Chumbo em pó queima com uma chama branco-azulada. Tal como acontece com muitos metais, finamente dividido exposições de chumbo em pó piroforicidade. Emanações tóxicas são liberadas quando o chumbo é queimado.
Isótopos
Chumbo ocorre naturalmente na Terra exclusivamente sob a forma de quatro isótopos: chumbo-204, -206, -207, e -208. Todos os quatro pode ser radioativo como o decaimento alfa hipotética de qualquer seria exotérmica, mas o limite de meia-vida inferior foi colocada apenas para o chumbo-204: mais de 1,4 × 10 17 anos. Este efeito é, no entanto, tão fraco que o chumbo natural, não constitui um perigo de radiação. Três isótopos também são encontrados em três dos quatro principais cadeias de desintegração: chumbo-206, -207 e -208 são produtos de decaimento finais de urânio-238, o urânio-235, e tório-232, respectivamente. Uma vez que as quantidades dos mesmos na natureza dependerá também em presença de outros elementos, a composição isotópica de chumbo natural varia por exemplo: em particular, a quantidade relativa de chumbo-206 varia entre 20,84% e 27,78%.
Afora os estáveis, trinta e quatro radioisótopos foram sintetizados: eles têm números de massa de 178-215. Chumbo-205 é o radioisótopo mais estável de chumbo, com uma semi-vida de mais de 10 7 anos. 47 isômeros nucleares (longa vida estados excitados nucleares), o que corresponde a 24 isótopos de chumbo, foram caracterizadas. O isômero mais longa vida é lead-204m2 (meia-vida de cerca de 1,1 horas).
Reatividade química
O chumbo é classificado como um de metal de pós-transição e é também um membro da grupo de carbono. Chumbo única forma uma camada protetora de óxido de chumbo em pó fino, embora altamente purificada pode inflamar no ar. Chumbo derretido é oxidado no ar para monóxido de chumbo. Tudo Calcogênios oxidar chumbo após aquecimento.
Flúor não oxida chumbo frio. Chumbo quente pode ser oxidado, mas a formação de um protector camada halogeneto reduz a intensidade da reacção acima de 100 ° C (210 ° F). A reacção com o cloro é semelhante: graças à camada de cloreto, persistência chumbo contra cloro supera os de cobre ou de aço de até 300 ° C (570 ° F).
A água na presença de ataques de oxigénio levar a iniciar uma reacção de aceleração. A presença de carbonatos ou sulfatos resulta na formação de sais insolúveis de chumbo, que protegem o metal da corrosão. O mesmo acontece com dióxido de carbono , como o insolúvel carbonato de chumbo é formado; No entanto, um excesso do gás leva à formação de bicarbonato solúvel; isto faz com que a utilização de canos de chumbo perigosos. Chumbo dissolve-se em ácidos orgânicos (na presença de oxigénio) e concentrado (≥80%) de ácido sulfúrico graças a complexação; no entanto, é apenas fracamente afectada pelo ácido clorídrico e é estável contra o ácido fluorídrico, como os haletos correspondentes são fracamente solúveis. O chumbo também se dissolve completamente em concentrados álcalis (≥10%) devido à caráter anfotérico e solubilidade plumbites.
Compostos
Compostos de chumbo existem principalmente em dois principais estados de oxidação, 2 e 4. O primeiro é mais comum. Chumbo inorgânico (IV) os compostos são tipicamente oxidantes fortes ou existem apenas em soluções altamente ácidas.
Óxidos e sulfuretos
Três óxidos são conhecidos: de chumbo (II) ou de óxido de monóxido de chumbo (PbO), tetróxido de chumbo (Pb 3 O 4) (às vezes chamado de "minium"), e dióxido de chumbo (PbO 2). O monóxido existe como duas formas alotrópicas: α-PbO e β-PbO, ambos com estrutura de camadas e chumbo tetracoordinated. O alfa polimorfo é de cor vermelha e tem a distância Pb-O de 230 horas; o polimorfo beta é de cor amarela e tem a distância Pb-S de 221 e 249 horas (devido à assimetria). Ambos os polimorfos podem existir sob condições padrão (beta com pequenas (10) -5 relativas de impurezas, tais como átomos de Si, Ge, Mo, etc.). PbO reage com ácidos para formar sais, e com substâncias alcalinas para dar plumbites, [Pb (OH) 3] - ou [Pb (OH) 4] 2 ~. O monóxido de oxida em ar a tetróxido trilead, que a 550 ° C (1020 ° F) em volta degrada PbO.
O dióxido podem ser preparados, por exemplo, halogenization de sais de chumbo (II). Independentemente do polimorfo, que tem uma cor castanha-preta. O alfa é allotrope romboédrica, e a beta é alótropo tetragonal. Ambas as formas alotrópicas são negros-de cor castanha e contêm sempre um pouco de água, que não pode ser removido, como também faz com que a decomposição de aquecimento (a PbO e Pb 3 O 4). O dióxido é um poderoso oxidante: pode oxidar os ácidos clorídrico e sulfúrico. Ele não reage com a solução alcalina, mas reage com alcalinos sólidos para dar hydroxyplumbates, ou com óxidos de base para dar plumbates.
A reacção de sais de chumbo com rendimentos de sulfureto de hidrogénio monosulfide chumbo. O sólido tem o rocksalt semelhante estrutura cúbica simples, a qual mantém-se ao ponto de fusão, 1114 ° C (2037 ° F). Quando aquecida em ar, oxida-se para o sulfato e, em seguida, o monóxido de carbono. Monossulfureto de chumbo é quase insolúvel em água, ácidos fracos, e (NH 4) 2 S / (NH 4) 2 S 2 solução é a chave para a separação de chumbo a partir de grupos de análise I, II e III iões, estanho , arsénico e de antimónio . No entanto, ela se dissolve em nítrico e ácido clorídrico , para dar elementar de enxofre e de sulfureto de hidrogénio, respectivamente. Após aquecimento sob altas pressões com enxofre, dá a dissulfureto. No composto, os átomos de chumbo estão ligados octaedricamente com os átomos de enxofre. Também é um semicondutor. Uma mistura do monóxido de carbono e o monossulfureto quando aquecidos a formas de metal.
- 2 + PbO PbS → 3 Pb + SO 2
Haletos e outros sais

Carbonato de chumbo Aquecimento com fluoreto de hidrogénio produz o fluoridrato, que se decompõe com o difluoride quando derrete. Este pó branco cristalino é mais solúvel do que o diiodeto, mas menos do que o dibrometo eo dichloride. O tetrafluoreto, um pó cristalino amarelo, é instável.
Outros dialogenetos são obtidos após aquecimento chumbo sais (II) com os halogenetos de outros metais; dialogenetos chumbo precipitar para dar branco cristais ortorrômbica (formas diiodeto cristais hexagonais amarelo). Eles também podem ser obtidos por reacção directa dos seus elementos constituintes, à temperatura superiores a pontos de di-halogenetos de fusão. A sua solubilidade aumenta com a temperatura; adicionando mais halogenetos diminui primeiro a solubilidade, mas, em seguida, aumenta devido à complexação, com o máximo número de coordenação 6. A complexação ser depende dos números de iões de halogeneto, número atómico do metal alcalino , o halogeneto de que é adicionado, a temperatura e força iónica da solução. O tetracloreto é obtida mediante dissolução do dióxido de ácido clorídrico; para evitar a decomposição exotérmica, que é mantida sob ácido sulfúrico concentrado. O tetrabrometo não pode, eo tetraiodeto definitivamente não existe. O diastatide também foi preparado.
O metal não é atacado por sulfúrico ou clorídrico ácidos. Dissolve-se em ácido nítrico , com a evolução de gás de óxido nítrico a forma dissolvida de Pb (NO 3) 2 . É um sólido bem solúvel em água; é, portanto, a chave para receber os precipitados de halogenetos, sulfato, cromato, carbonato, carbonato básico e Pb 3 (OH) 2 (CO 3) 2 sais de chumbo. |
Organochumbo
Os compostos mais conhecidos são os dois mais simples derivados plumbane: tetramethyllead (TML) e tetraetilchumbo (TEL). O homólogos dos mesmos, bem como hexaethyldilead (HEDL), são de menor estabilidade. Os derivados tetralkyl contêm chumbo (IV), em que as ligações de Pb-C são covalente. Eles, portanto, assemelham-se compostos orgânicos típicos.
Chumbo prontamente forma uma liga de equimolar com sódio metálico que reage com halogenetos de alquilo para formar compostos organometálicos de chumbo, tais como tetraetilchumbo. As energias de ligação Pb-C em TML e TEL são apenas 167 e 145 kJ / mol; Os compostos assim decompor por aquecimento, com primeiros sinais de composição TEL visto a 100 ° C (210 ° F). O rendimentos de pirólise de chumbo e radicais alquilo elementares; sua interreaction faz com que a síntese de HEDL. TML e TEL também se decompor em cima luz solar ou luz UV. Na presença de cloro, e os alquilos começar a ser substituído com cloretos; o símbolo R2 PbCl 2 na presença de HCl (um subproduto da reacção anterior) leva à completa mineralização para dar PbCl 2. A reacção com bromo segue o mesmo princípio.
História


O chumbo tem sido comumente usado por milhares de anos, porque é generalizada, fácil de extrair e fácil de trabalhar. É altamente maleável, bem como de fácil cheirado. Grânulos chumbo metálico que datam de 6400 aC foram encontrados em Çatalhöyük na atual Turquia. No início da Idade do Bronze , o chumbo foi usada com antimônio e arsênico .
A maior pré-industrial produtor de chumbo era o Economia romana, com uma produção anual estimada de 80.000 toneladas, o qual era tipicamente ganhou como um subproduto de grande fundição de prata. Atividades de mineração romana ocorreu na Europa Central , Roman Grã-Bretanha , a Balcãs, Grécia , Ásia Menor e Hispania que sozinho foi responsável por 40% da produção mundial.
Romano canos de chumbo muitas vezes trazia a insígnia de imperadores romanos (veja Chumbo romano inscrições tubos). Canalizações de chumbo no Ocidente latino pode ter sido continuado além da idade de Teodorico, o Grande no período medieval. Muitos "porcos" romanos (lingotes) da figura chumbo no Derbyshire história da mineração de chumbo e na história da indústria em outros centros ingleses. Os romanos também usavam chumbo na forma fundida para garantir pinos de ferro que mantidas juntas grande blocos de calcário em certos edifícios monumentais. Na alquimia , o chumbo foi pensado para ser o metal mais antigo e foi associado com o planeta Saturno . Alquimistas conformidade utilizado símbolo de Saturno (a foice, ♄) para se referir a liderar.
Até o século 17, estanho, muitas vezes não se distinguia de chumbo: chumbo foi chamado plumbum nigrum (literalmente, "chumbo preto"), enquanto estanho foi chamado plumbum candidum (literalmente, "chumbo brilhante"). Sua inerência através da história também pode ser visto em outros idiomas: a palavra "olovo" significa levar em Checa, mas em russo -lo ("олово") significa estanho. Símbolo de chumbo Pb é uma abreviatura de seu Latina plumbum nome para metais macios; as palavras em inglês " encanamento "," canalizador "," prumo ", e" Fio de prumo "também derivar dessa raiz latina.
Produção de chumbo em os EUA começaram tão cedo quanto o final de 1600 por índios no A Southeast Missouri Chumbo District, comumente chamado de Levar Belt, é um distrito de mineração de chumbo na parte sudeste da Missouri. Significativa entre as preocupações de mineração de chumbo do Missouri no distrito foi o Desloge Família e Desloge Consolidado Chumbo em Desloge, Missouri e Bonne Terre - tendo sido ativo na negociação de chumbo, mineração e levar fundição de 1823 em Potosi a 1929.
Ocorrência
Chumbo metálico não ocorrem na natureza, mas é raro. O chumbo é geralmente encontrada em minério com zinco , prata e (mais abundante) de cobre , e é extraído em conjunto com estes metais. A principal vantagem mineral é galena (PbS), que contém 86,6% em peso de chumbo. Outras variedades comuns são cerussite (PbCO 3) e anglesite (PBSO 4).
Processamento de minério

A maioria dos minérios contêm menos de 10% de chumbo, e os minérios que contêm tão pouco como 3% de chumbo pode ser explorado economicamente. Minerais são esmagados e concentrada por flotação de espumas tipicamente a 70% ou mais. Minérios de sulfureto são , a produção de óxido de chumbo, principalmente torrado e uma mistura de sulfatos e silicatos de chumbo e outros metais contidos no minério. Óxido de chumbo a partir do processo de torrefação é reduzida em um coque disparou- alto-forno para o metal. Camadas adicionais no processo de separar e flutuar para o topo do chumbo metálico. Estes são silicatos de escória (contendo 1,5% de chumbo), fosco (sulfetos contendo 15% de chumbo), e Speiss (arsenieto de ferro e cobre). Estes resíduos contêm concentrações de cobre, zinco, cádmio, bismuto e que podem ser recuperados economicamente, como pode o seu teor de chumbo não reduzido.
Chumbo metálico que resulta dos processos de torrefacção e de alto-forno contém ainda contaminantes significativos de arsénio, antimónio, bismuto, zinco, cobre, prata e ouro. O fundido é tratado numa forno de revérbero com ar, vapor, e enxofre, que oxida os contaminantes excepto prata, ouro, e bismuto. Os contaminantes são removidos por oxidados escorificação, onde eles flutuam para o topo e são desnatado. Desde minérios de chumbo conter concentrações significativas de prata , o metal fundido é também comumente contaminados com prata. Prata metálica, bem como de ouro é removida e recuperada economicamente por meio do Processo de Parkes. Desprateada chumbo é libertado de bismuto de acordo com a Processo betterton-Kroll por tratamento com cálcio e magnésio metálico, que forma uma escória de bismuto que pode ser retirado da superfície. Muito chumbo puro pode ser obtido por transformação de chumbo fundido electroliticamente por meio do Processo Betts. O processo utiliza ânodos de chumbo impuro e cátodos de chumbo puros de um electrólito de fluoreto de sílica.
Produção e reciclagem
Produção e consumo de chumbo está a aumentar em todo o mundo. Produção anual total é de cerca de 8 milhões de toneladas; cerca de metade é produzido a partir de sucata reciclada. Os países produtores de chumbo superiores, a partir de 2008, são a Austrália, China, EUA, Peru, Canadá, México, Suécia, Marrocos, África do Sul e Coréia do Norte. Austrália, China e Estados Unidos são responsáveis por mais da metade da produção primária. Em 2010, 9,6 milhões de toneladas de chumbo foram produzidos, dos quais 4,1 milhões de toneladas vieram da indústria.
Em taxas atuais de uso, o fornecimento de chumbo é estimado para esgotar em 42 anos. Analista ambiental Lester Brown sugeriu liderança poderia correr para fora dentro de 18 anos, com base numa extrapolação de crescimento de 2% ao ano. Isso pode ter de ser revista para ter em conta o interesse renovado na reciclagem , e um rápido progresso na tecnologia de célula de combustível. De acordo com Painel Internacional de Recursos do Stocks Metal em relatório Society, o estoque mundial per capita de chumbo em uso na sociedade é de 8 kg. Muito disso é nos países mais desenvolvidos (20-150 kg per capita) em vez de países menos desenvolvidos (1-4 kg per capita).
Aplicações
Forma elementar

Ao contrário da crença popular, leva lápis de lápis de madeira nunca foram feitas de chumbo. O termo vem da caneta Roman, chamado de penicillus, um pequeno pincel usado para a pintura. Quando o lápis originou-se como uma ferramenta de escrita grafite envolvido, do tipo particular de grafite a ser utilizado foi nomeado plumbago (lit. ato de chumbo, ou maquete de chumbo).
O chumbo é utilizado em aplicações em que o seu baixo ponto de fusão, de ductilidade e de alta densidade são vantajosos. O ponto de fusão baixo faz fundição de chumbo fácil, e, portanto, pequenos braços e munição de espingarda pelotas pode ser lançado com equipamento técnico mínimo. É também barata e mais denso do que outros metais comuns.
Devido à sua alta densidade e a resistência contra a corrosão, o chumbo é utilizado para o lastro quilha de veleiros. A sua elevada densidade permite que contrabalançar o efeito de inclinação do vento sobre as velas enquanto, ao mesmo tempo que ocupam um volume pequeno e, assim, a resistência que oferecem menos subaquático. Pela mesma razão, é utilizado em mergulho cintos de lastro para contrariar a flutuabilidade natural do mergulhador e de seu equipamento. Ele não tem a proporção de peso-para-volume de muitos metais pesados, mas o seu baixo custo aumenta a sua utilização em estas e outras aplicações.



Mais da metade da produção de chumbo dos EUA (pelo menos 1,15 milhões de toneladas em 2000) é usado para automóveis, principalmente como eletrodos na chumbo-ácido de bateria, amplamente utilizado como um bateria de carro.
Cátodo ( redução)
- PbO 2 + 4 + H + SO 2-
4 + 2e - → PBSO 4 + 2 H2O
Ânodo ( oxidação)
- Pb + SO 2-
4 → PBSO 4 + 2e -
O chumbo é utilizado como eléctrodos no processo de electrólise . É utilizado em solda para a eletrônica, embora este uso está a ser eliminado por alguns países para reduzir a quantidade de ambientalmente resíduos perigosos, e em cabos de energia de alta tensão como material de revestimento para evitar a difusão de água no isolamento. O chumbo é um dos três metais utilizados na Oddy teste para materiais de museu, ajudando detectar ácidos orgânicos, aldeídos e gases ácidos. É também usado como blindagem de radiação (por exemplo, em Salas de raios-X). O metal derretido é usado como um do líquido de arrefecimento (por exemplo, para chumbo arrefecido reatores rápidos).
O chumbo é adicionado ao bronze para reduzir desgaste de máquinas-ferramenta. Sob a forma de tiras ou fita, o chumbo é utilizado para a personalização de raquetes de ténis. Raquetes de tênis do passado, por vezes, tinham chumbo adicionado a eles pelo fabricante para aumentar o peso. Ele também é usado para formar barras de envidraçamento para vitrais ou outras janelas de multi-lit. A prática tem se tornado menos comum, não para o perigo, mas por razões estilísticas. Lead, ou folha de chumbo, é usado como uma camada de amortecimento de som em algumas áreas na parede, piso e teto projeto em estúdios de som onde os níveis de ruído aéreo e produzido mecanicamente são direcionados para a redução ou eliminação virtual. É o metal de base tradicional tubos de órgão, misturado com quantidades variáveis de estanho para controlar a tonalidade do tubo.
O chumbo tem muitos usos na indústria da construção (por exemplo, folhas de chumbo são usados como metais arquitetônicos em material de cobertura, revestimento, piscando, sarjetas e articulações da calha, e no parapeito do telhado). Molduras de chumbo detalhadas são usadas como motivos decorativos utilizados para fixar folha de chumbo. Chumbo ainda é amplamente utilizado em estátuas e esculturas. O chumbo é muitas vezes usado para equilibrar as rodas de um carro; esta utilização está a ser eliminado em favor de outros materiais por razões ambientais. Devido à sua semi-vida de 22,20 anos, o isótopo radioactivo 210 Pb é usado para o material que data de marinhas de sedimentos núcleos por métodos radiométricos.
Compostos
Compostos de chumbo, são utilizados como um elemento de coloração em esmaltes cerâmicos, nomeadamente nas cores vermelho e amarelo. O chumbo é freqüentemente usada em cloreto de polivinila (PVC) de plástico, que reveste os cabos elétricos.
O chumbo é utilizado em algumas velas para tratar o pavio para assegurar uma mais longa, mais ainda queimar. Por causa dos perigos, os fabricantes europeus e norte-americanos usam alternativas mais caras, como o zinco. Vidro de chumbo é composto por 12-28% óxido de chumbo. Ele altera as características ópticas do vidro e reduz a transmissão de radiação.
Alguns artistas usando tintas à base de óleo continuar a usar carbonato de chumbo branco, citando suas propriedades em comparação com as alternativas. Chumbo tetra-etílico é utilizado como um aditivo anti-detonante para combustível de aviação em aeronaves movidas a pistão. À base de chumbo semicondutores , tais como telureto de chumbo, seleneto de chumbo e antimonide chumbo estão encontrando aplicações em fotovoltaicos células (energia solar) e Os detectores de infravermelhos.
Conduzir, em qualquer estado puro ou misturado com estanho, antimónio ou é o material tradicional para balas e tiro em armas de fogo utilização.
Aplicações Ex-
Pigmentos de chumbo foram usadas em pintura de ligação para branco, bem como amarelo, laranja, e vermelho. A maioria dos usos têm sido interrompido devido aos perigos de envenenamento por chumbo. Partir de 22 de abril de 2010, lei federal dos EUA exige que os empreiteiros que executam projetos de renovação, reparação e pintura que perturbam mais de seis pés quadrados de pintura em casas, creches e escolas construídas antes de 1978 devem ser certificados e treinados para acompanhar o trabalho específico práticas para prevenir a contaminação por chumbo. Cromato de chumbo ainda está em uso industrial. Carbonato de chumbo (branco) é o pigmento para o meio tradicional priming para pintura a óleo, mas que tenha sido em grande parte deslocadas pelas zinco e pigmentos de óxido de titânio. Foi também substituído rapidamente em meios de pintura à base de água. Branco carbonato de chumbo foi usada pelos japoneses gueixa e no Ocidente por-branqueamento rosto make-up, o que era prejudicial à saúde.
O chumbo é o metal quente que foi usado em typesetting metal quente. Foi utilizado para encanamento (daí o nome), bem como um conservante para alimentos e bebidas em Roma Antiga . Até o início dos anos 1970, o chumbo foi usada para juntar água tubos de ferro fundido e utilizado como um material para tubulações de água de pequeno diâmetro.
Tetraetilchumbo foi utilizado em combustíveis com chumbo para reduzir motor batendo, mas esta prática foi descontinuada em muitos países do mundo nos esforços para reduzir a poluição tóxica que afetaram os seres humanos eo meio ambiente.
O chumbo foi usada para fazer balas para estilingues. O chumbo foi usada para chumbo de espingarda em os EUA até cerca de 1992, quando ele foi proibido (por única caça às aves aquáticas) e substituído por tiro não-tóxico, principalmente pelotas de aço. Nos Países Baixos , o uso de chumbo para caça e tiro desportivo foi proibida em 1993, o que causou uma grande queda em emissão de chumbo, de 230 toneladas em 1990-47,5 toneladas em 1995, dois anos após a proibição.
O chumbo foi um componente da tinta utilizada em brinquedos para crianças - agora restrita nos Estados Unidos e na Europa ( Directiva RoHS). O chumbo foi utilizado no material de enchimento do veículo, o qual foi utilizado em muitos carros personalizados nos 1940s-60s. Por isso, o termo Leadsled. O chumbo é um supercondutor com uma temperatura de transição de 7,2 K, e, portanto, da IBM tentou fazer um Computador efeito Josephson fora de uma liga de chumbo.
O chumbo também foi usada em pesticidas antes de 1950, quando os pomares de fruta foram tratados especialmente contra a lagartas. Um cilindro de chumbo ligado a uma longa linha foi usada pelos marinheiros para a tarefa vital de navegação para determinar a profundidade da água por levantando a liderança em intervalos regulares. Uma inserção de sebo macio na sua base permitida a natureza do fundo do mar para ser determinada, auxiliando ainda descoberta posição.
Os efeitos na saúde
O chumbo é um metal altamente tóxico (independentemente se inalado ou ingerido), afetando quase todos os órgãos e sistemas do corpo. O principal alvo para a toxicidade do chumbo é o sistema nervoso, tanto em adultos e crianças. A exposição a longo prazo dos adultos pode resultar em diminuição do desempenho em alguns testes que medem as funções do sistema nervoso. A exposição a longo prazo ao chumbo ou seus sais (especialmente sais solúveis ou a forte oxidante PbO2) pode causar nefropatia, e dores abdominais cólica-like. Ele também pode causar fraqueza nos dedos, pulsos ou tornozelos. A exposição ao chumbo também faz com que pequenos aumentos na pressão arterial, particularmente em pessoas de meia-idade e mais velhos e pode causar anemia. A exposição a altos níveis de chumbo pode danificar gravemente o cérebro e os rins em adultos ou crianças e, finalmente, causar a morte. Em mulheres grávidas, altos níveis de exposição ao chumbo pode causar aborto espontâneo. , A exposição de alto nível crônica têm mostrado para reduzir a fertilidade em homens. Chumbo também danos conexões nervosas (especialmente em crianças pequenas) e causar doenças do sangue e do cérebro. Intoxicação por chumbo normalmente resulta da ingestão de alimentos ou água contaminados com chumbo; mas também pode ocorrer após ingestão acidental de solo contaminado, poeira ou tinta à base de chumbo. É rapidamente absorvido pela corrente sanguínea e acredita-se que tem efeitos adversos sobre o sistema nervoso central, o sistema cardiovascular, rins, e o sistema imunológico. O limite de componente de chumbo (1,0 ug / g) é um benchmark de teste para produtos farmacêuticos, representando a ingestão diária máxima de um indivíduo deve ter. No entanto, mesmo neste nível baixo, uma ingestão prolongada podem ser perigosos para os seres humanos. O tratamento para o envenenamento por chumbo é composto por Dimercaprol e succimer.
| NFPA 704 |
|---|
 1 3 0 |
| "Diamante Fire" para o chumbo granulado |
A preocupação sobre o papel de liderança na déficits cognitivos em crianças provocou redução generalizada da sua utilização (exposição ao chumbo tem sido associada a dificuldades de aprendizagem). A maioria dos casos de níveis elevados de chumbo no sangue de adultos são relacionadas com o local de trabalho. Níveis sanguíneos elevados estão associados com puberdade atrasada nas meninas. O chumbo foi mostrado muitas vezes para reduzir permanentemente a capacidade cognitiva das crianças em níveis extremamente baixos de exposição.
Durante o século 20, o uso de chumbo em tintas de pigmentos foi drasticamente reduzida por causa do perigo de intoxicação por chumbo, especialmente para as crianças. Em meados da década de 1980, uma mudança significativa nos padrões de utilização final de chumbo tinha ocorrido. Grande parte dessa mudança foi resultado do cumprimento dos nos levar dos consumidores com os regulamentos ambientais que significativamente reduzidos ou eliminados a utilização de chumbo nos produtos não-bateria, incluindo gasolina, tintas, soldas e sistemas de água. Uso de chumbo está a ser ainda mais reduzida pela União Europeia de Diretiva RoHS. O chumbo pode ainda ser encontrado em quantidades nocivas em faiança, de vinilo (como o que usado para a tubagem e o isolamento de cabos eléctricos) e bronze chinês. Casas mais antigas ainda podem conter quantidades substanciais de tinta de chumbo. Tinta de chumbo branco foi retirado de venda nos países industrializados, mas o amarelo cromato de chumbo, ainda está em uso. Tinta velha não deve ser despojado lixando, pois isso produz poeira inalável.
Sais de chumbo usados em esmaltes de cerâmica têm na ocasião causou intoxicação, quando bebidas ácidas, como sucos de frutas, ter íons de chumbo lixiviado para fora do esmalte. Tem sido sugerido que o que era conhecido como " Cólica Devon "surgiu a partir da utilização de prensas revestidos de chumbo para extrair o suco de maçã no fabrico de sidra . O chumbo é considerado particularmente prejudicial para a capacidade das mulheres de se reproduzir. De acetato de chumbo (II) (também conhecido como açúcar de chumbo) foi usado no Império Romano como um edulcorante para o vinho, e alguns consideram isso uma explicação plausível para a demência de muitos imperadores romanos, e, que o envenenamento por chumbo crônica contribuíram para o declínio gradual do império. (Veja Declínio do Império Romano envenenamento por chumbo #)
Bioquímica de envenenamento
No corpo humano, inibe levar porfobilinogénio sintase e ferroquelatase, impedindo tanto formação porfobilinogénio ea incorporação de ferro em protoporfirina IX, o passo final na síntese do heme. Isto faz com que a síntese de heme ineficaz e subsequente anemia microcítica. Em níveis baixos, que actua como um análogo de cálcio, o que interfere com os canais iónicos durante a condução do nervo. Este é um dos mecanismos pelo qual ela interfere com a cognição. Envenenamento por chumbo aguda é tratada com edetato dissódico de cálcio: o cálcio quelato do sal dissódico do ácido etileno-diamina-tetracético ( EDTA). Este agente quelante tem uma maior afinidade para a ligação do que para o cálcio e de modo que o quelato de chumbo é formado por permuta. Este é então excretada na urina deixando para trás cálcio inofensivo. De acordo com a Agência de Substâncias Tóxicas e Registro de Doenças, uma pequena quantidade de chumbo ingerido (1%) irá armazenar-se em ossos, eo resto vai ser excretado por um adulto através da urina e fezes dentro de algumas semanas de exposição. No entanto, apenas cerca de 32% do chumbo será excretada por uma criança.
A exposição ao chumbo e os produtos químicos de chumbo pode ocorrer através da inalação, ingestão e contato dérmico. Maior exposição ocorre através da ingestão ou inalação; em os EUA é improvável a exposição da pele como aditivos de gasolina com chumbo não são mais usados. A exposição ao chumbo é uma questão global como mineração de chumbo e fundição de chumbo são comuns em muitos países. A maioria dos países pararam de usar gasolina com chumbo até 2007. A exposição ao chumbo ocorre principalmente através da ingestão. Pintura de ligação é a principal fonte de exposição ao chumbo para crianças. Como a pintura de ligação deteriora, descasca, é pulverizada em pó e, em seguida, entra no corpo através do contato corpo-a-boca ou através de alimentos contaminados, água ou álcool. A ingestão de certos medicamentos home do remédio também pode expor as pessoas a conduzir ou compostos de chumbo. O chumbo pode ser ingerida através de frutas e vegetais contaminados por altos níveis de chumbo nos solos foram cultivadas em. O solo é contaminado por meio da acumulação de partículas de chumbo em tubos de tinta com chumbo e as emissões residuais de gasolina com chumbo que foi utilizado antes da emissão Environment Protection Agency a regulação por volta de 1980. O uso de chumbo para tubulações de água é problemática em áreas com suave ou (e) água ácida. A água dura forma camadas insolúveis nos tubos enquanto água mole e ácida dissolve os canos de chumbo. A inalação é a segunda principal via de exposição, especialmente para os trabalhadores em ocupações relacionadas com chumbo. Quase todo o chumbo inalado é absorvido para dentro do corpo, a taxa é de 20-70% para o chumbo ingerido; as crianças absorvem mais do que os adultos. Exposição cutânea pode ser significativo para uma categoria restrita de pessoas que trabalham com compostos de chumbo orgânicos, mas é de pouco interesse para a população em geral. A taxa de absorção da pele também é baixo para o chumbo inorgânico.

