
Malária
Sobre este escolas selecção Wikipedia
SOS acredita que a educação dá uma chance melhor na vida de crianças no mundo em desenvolvimento também. Clique aqui para mais informações sobre Crianças SOS.
| Malária | |
|---|---|
| Classificação e recursos externos | |
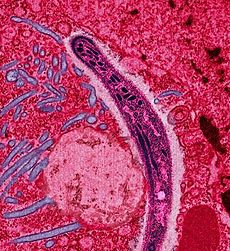 Um Plasmodium na forma que entra seres humanos e outros vertebrados a partir da saliva de mosquitos fêmeas (um esporozoíto) atravessa o citoplasma de uma célula epitelial do intestino médio do mosquito. | |
| CID- 10 | B 50- B 54 |
| CID- 9 | 084 |
| OMIM | 248310 |
| DiseasesDB | 7728 |
| MedlinePlus | 000621 |
| Medcenter | med / 1385 emerg / 305 ped / 1357 |
| MeSH | C03.752.250.552 |
A malária é uma doença infecciosa transmitida por mosquitos de seres humanos e outros animais causadas por protistas (um tipo de microorganismo do género) Plasmodium. Ela começa com uma picada de uma fêmea infectada Mosquito Anopheles, que introduz os protistas através da saliva para o sistema circulatório. No sangue, as protistas viajar para o fígado para amadurecer e reproduzir-se. A malária causa sintomas que incluem tipicamente febre e dor de cabeça , que, em casos graves, pode progredir para coma ou morte . A doença é comum em tropicais e subtropicais regiões em uma ampla faixa ao redor do equador, incluindo grande parte da África Subsaariana , Ásia , ea Américas.
Cinco espécies de Plasmodium e pode infectar ser transmitida por seres humanos. A grande maioria das mortes são causadas por P. falciparum e P. vivax, enquanto P. ovale, e P. malariae causar uma forma geral, mais branda da malária, que raramente é fatal. O espécies zoonóticas P. knowlesi, prevalente no sudeste da Ásia, causa a malária em macacos, mas também pode causar infecções graves em seres humanos. A malária é prevalente em regiões tropicais e subtropicais, porque de chuva, temperaturas quentes e águas estagnadas fornecer habitats ideais para larvas do mosquito. A transmissão da doença pode ser reduzida, impedindo picadas de mosquito por distribuição de mosquiteiros e repelentes de insetos, ou com medidas de controle do mosquito, como a pulverização inseticidas e drenar a água parada.
A malária é normalmente diagnosticada por exame microscópico do sangue usando esfregaços de sangue, ou com base de antigene- testes de diagnóstico rápido. As modernas técnicas que utilizam a reacção em cadeia da polimerase para detectar o parasita ADN também têm sido desenvolvidos, mas estes não são amplamente utilizados em malária áreas endémicas, devido ao seu custo e complexidade. A Organização Mundial de Saúde estimou que, em 2010, havia 219 milhões de casos documentados de malária. Naquele ano, entre 660.000 e 1,2 milhão de pessoas morreram da doença (cerca de 2000-3000 por dia), muitos dos quais eram crianças na África. O número real de mortes não se sabe com certeza, como dados precisos não está disponível em muitas áreas rurais, e muitos casos estão em situação irregular. A malária é comumente associado com a pobreza e também pode ser um grande obstáculo ao desenvolvimento econômico.
Apesar de uma necessidade, não eficaz vacina existe atualmente, embora os esforços para desenvolver uma estão em andamento. Vários medicamentos estão disponíveis para prevenir a malária em viajantes para países onde a malária é endêmica ( profilaxia). Uma variedade de medicamentos antipalúdicos estão disponíveis. A malária grave é tratada com ou intravenosa intramuscular quinino ou, desde meados da década de 2000, o derivado de artemisinina artesunato, o que é superior ao quinino em crianças e adultos e é administrado em combinação com um segundo agente anti-malária, tais como mefloquina. A resistência tem desenvolvido a vários medicamentos antipalúdicos; por exemplo, resistentes à cloroquina P. falciparum se espalhou para a maioria das áreas da malária, e emergente resistência à artemisina tornou-se um problema em algumas partes do sudeste da Ásia.
Os sinais e sintomas
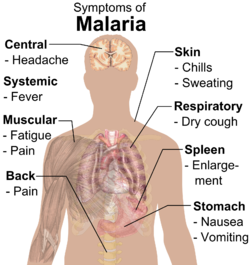
Os sinais e sintomas da malária geralmente começam 8-25 dias após a infecção; no entanto, os sintomas podem ocorrer mais tarde na aqueles que tomaram medicamentos antimaláricos como prevenção. As manifestações iniciais da doença comuns a todas as espécies de malária-são semelhantes aos da gripe -like sintomas, e pode assemelhar-se a outras condições, tais como septicemia, gastroenterite , e doenças virais. A apresentação pode incluir dor de cabeça , febre , tremores, artralgia (dor nas articulações), vômitos, anemia hemolítica, icterícia, hemoglobinúria, danos na retina, e convulsões. Aproximadamente 30% das pessoas, porém, já não terá uma febre ao apresentar a uma unidade de saúde. Devido à natureza não específica de apresentação da doença, o diagnóstico da malária em países não endêmicos requer um alto grau de suspeita, que pode ser provocada por qualquer dos seguintes procedimentos: história de viagem recente, esplenomegalia (baço dilatado), febre sem sinais localizar, trombocitopenia e hiperbilirrubinemia combinado com um periférico normais contagem de leucócitos no sangue.
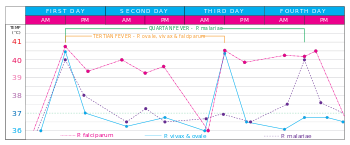
O sintoma clássico da malária é paroxismo-a ocorrência cíclica de frio súbito seguido por rigor e, em seguida, febre e sudorese, que ocorre a cada dois dias (febre terçã) em P. vivax e P. ovale infecções, e de três em três dias (febre quartã) para P. malariae. P. falciparum infecção pode causar febre recorrente a cada 36-48 horas ou febre menos pronunciada e quase contínua.
A malária grave é geralmente causada por P. falciparum (muitas vezes referida como a malária falciparum). Os sintomas de malária falciparium surgir 9-30 dias após a infecção. Os indivíduos com malária cerebral freqüentemente exibem sintomas neurológicos, incluindo postura anormal, nistagmo, conjugado olhar paralisia (falha dos olhos para ligar em conjunto na mesma direcção), opisthotonus, convulsões, ou coma.
Complicações
Existem vários sério complicações da malária. Entre estes é o desenvolvimento de angústia respiratória, que ocorre em até 25% dos adultos e 40% das crianças com grave P. malária falciparum. As causas possíveis incluem compensação respiratória de acidose metabólica, não cardiogênico edema pulmonar, concomitante pneumonia , e grave anemia . Síndrome do desconforto respiratório agudo (SDRA) pode se desenvolver em 5-25% em adultos e até 29% das mulheres grávidas mas é raro em crianças pequenas. A co-infecção de HIV com malária aumenta a mortalidade. A insuficiência renal é uma característica da febre Blackwater, onde a hemoglobina a partir de células vermelhas do sangue lisadas vaza para a urina.
A infecção com P. falciparum pode resultar em malária cerebral , uma forma de malária grave que envolve encefalopatia. Ela está associada com o branqueamento da retina, o que pode ser um sinal clínico útil na distinção da malária a partir de outras causas de febre. Esplenomegalia, dor de cabeça severa, hepatomegalia (aumento do fígado), hipoglicemia, e hemoglobinúria com insuficiência renal pode ocorrer.
A malária em mulheres grávidas é uma importante causa de natimortos, mortalidade infantil e baixo peso ao nascer, particularmente em P. infecção falciparum, mas também com P. vivax.
Causa
Malária parasitas pertencem ao gênero Plasmodium (filo Apicomplexa). Nos seres humanos, a malária é causada pela P. falciparum, P. malariae, P. ovale, P. vivax e P. knowlesi. Entre os infectados, P. falciparum é a espécie mais comuns identificados (~ 75%), seguido por P. vivax (~ 20%). Embora P. falciparum tradicionalmente responsável pela maioria das mortes, evidência recente sugere que P. vivax malária está associada a condições potencialmente fatais sobre as vezes que com o diagnóstico de P. falciparum infecção. P. vivax proporcionalmente é mais comum fora da África. Tem sido documentado infecções humanas com várias espécies de Plasmodium de macacos superiores; no entanto, com a excepção de P. knowlesi -a espécies zoonóticas que causa a malária em macacos-estes são principalmente de limitada importância para a saúde pública.
Vida útil
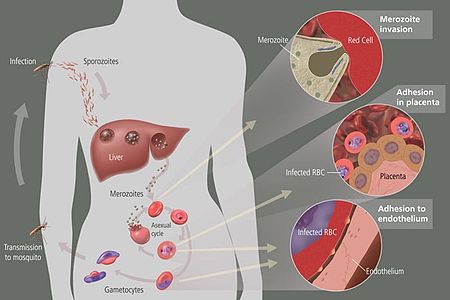
No ciclo de vida do Plasmodium, uma fêmea Anopheles mosquito (a hospedeiro definitivo) transmite uma forma infecciosa móveis (o chamado esporozoíto) para um hospedeiro vertebrado, tal como um ser humano (o hospedeiro secundário), actuando assim como uma transmissão vetor. A sporozoite viaja através dos vasos sanguíneos para as células do fígado ( hepatócitos), onde se reproduz assexuadamente (tecido esquizogonia), produzindo milhares de merozoítos. Estes infectar novas células vermelhas do sangue e iniciar uma série de ciclos de multiplicação assexuada (esquizogonia sangue) que produzam 8-24 novos merozoítos infecciosos, altura em que as células se rompem e o ciclo infeccioso começa de novo. Outros merozoites desenvolver em imaturo gametas, ou gametócitos. Quando um mosquito fertilizado pica uma pessoa infectada, gametócitos são absorvidos pelo sangue e madura no intestino do mosquito. O fusível e forma gametócitos masculinos e femininos zigotos ( ookinetes), que se desenvolvem em novos esporozoítos. Os esporozoítos migram para os insectos de glândulas salivares, pronto para infectar um novo hospedeiro vertebrado. Os esporozoitos são injectados na pele, juntamente com a saliva, quando o mosquito se alimenta de sangue posterior.
Somente mosquitos fêmeas se alimentam de sangue; mosquitos machos alimentam de néctar planta, e, portanto, não transmitem a doença. As fêmeas do gênero Anopheles do mosquito preferem se alimentar à noite. Eles costumam começar a procurar uma refeição ao anoitecer, e continuará durante toda a noite até de tomar uma refeição. Os parasitas da malária também pode ser transmitido por transfusões de sangue, embora isto seja raro.
Malária recorrente
Os sintomas da malária pode reaparecer (reincidência), após vários períodos livres de sintomas. Dependendo da causa, a recorrência pode ser classificada como recrudescência, recidiva, ou reinfecção. Recrudescência é quando os sintomas retornam após um período livre de sintomas. Ela é causada por parasitas sobrevivem no sangue como um resultado de tratamento insuficiente ou ineficaz. Relapse é quando os sintomas reaparecem após os parasitas foram eliminados do sangue, mas persistem hipnozoítos em período latente em células do fígado. Relapse comumente ocorre entre 8-24 semanas e é comumente visto com P. vivax e P. ovale infecções. P. casos de malária vivax em áreas temperadas muitas vezes envolvem hibernação por hipnozoítos, com recaídas começando o ano após a picada do mosquito. A reinfecção significa que o parasita que provocou a infecção passada foi eliminado do corpo, mas um novo parasita foi introduzido. A reinfecção não pode ser facilmente distinguida da recrudescência, embora recorrência da infecção dentro de duas semanas de tratamento para a infecção inicial é tipicamente atribuída ao fracasso do tratamento.
Patogênese
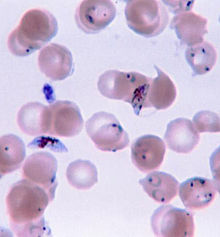
Infecção da malária se desenvolve através de duas fases: uma que envolve a fígado (fase exoeritrocítico), e uma que envolve as células vermelhas do sangue, ou eritrócitos (fase eritrocítica). Quando um mosquito infectado penetra a pele de uma pessoa para tomar uma refeição de sangue, esporozoítos na saliva do mosquito entrar na corrente sanguínea e migram para o fígado, onde eles infectam os hepatócitos, multiplicando-se assexuadamente e assintomática por um período de 8-30 dias.
Depois de um período de dormência potencial no fígado, estes organismos diferenciar para produzir milhares de merozoitos, que, após a ruptura das células do hospedeiro, escapar para o sangue e infectar as células vermelhas do sangue a começar a fase eritrocítica do ciclo de vida. O parasita escapa do fígado sem ser detectado por envolvê-se no membrana celular da célula hospedeira infectada fígado.
Dentro das células vermelhas do sangue, os parasitas multiplicam-se ainda mais, novamente assexuadamente, quebrando periodicamente para fora das suas células hospedeiras de invadir células de sangue vermelhas frescas. Vários desses ciclos de amplificação ocorra. Deste modo, as descrições clássicas de ondas de febre surgir a partir de ondas simultâneas de merozoitos que escapam e infectando células vermelhas do sangue.
Alguns P. esporozoítos vivax não desenvolvem imediatamente em merozoites exoerythrocytic de fase, mas sim produzir hipnozoítos que permanecer dormentes por períodos que variam de vários meses (7-10 meses é típico) a vários anos. Depois de um período de dormência, eles reativar e produzir merozoítos. Hipnozoítos são responsáveis por muito tempo de incubação e recaídas final em P. infecções vivax, embora a sua existência em P. ovale é incerto.
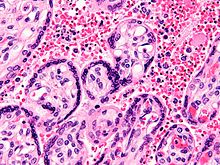
O parasita é relativamente protegido de ataques de o corpo do sistema imunológico , porque para a maioria de seu ciclo de vida humano que reside no interior das células do fígado e do sangue e é relativamente invisível a vigilância imunológica. No entanto, circulam células do sangue infectadas são destruídas no baço. Para evitar este destino, o P. falciparum exibe parasita adesivas proteínas na superfície das células do sangue infectadas, fazendo com que as células do sangue para aderir às paredes dos pequenos vasos sanguíneos, sequestrando assim o parasita da passagem pela circulação geral e do baço. O bloqueio da microvasculatura provoca sintomas tais como na malária placentária. Glóbulos vermelhos sequestrados pode violar o barreira sangue-cérebro e causam malária cerebral.
Embora as proteínas adesivas da superfície de células vermelhas do sangue (chamados PfEMP1, para P. proteína de membrana do eritrócito falciparum 1) são expostos ao sistema imunitário, que não servem como bons alvos imunitários devido à sua extrema diversidade; existem, pelo menos, 60 variantes da proteína dentro de um único parasita e ainda mais variantes dentro populações de parasitas inteiros. O parasita muda através de um amplo repertório de proteínas de superfície PfEMP1, evitando assim a detecção por proteção anticorpos .
A resistência genética
Devido aos altos níveis de mortalidade e morbidade causadas pela malária, especialmente o P. espécies-lo falciparum tem colocado o maior pressão selectiva sobre o genoma humano na história recente. Vários fatores genéticos fornecer alguma resistência a ela, incluindo traço falciforme, traços de talassemia, glucose-6-fosfato desidrogenase, e a ausência de Duffy antigénios nas células vermelhas do sangue.
O impacto do traço falciforme em imunidade a malária é de particular interesse. O traço falciforme provoca um defeito na molécula de hemoglobina no sangue. Em vez de reter a forma bicôncava de um glóbulo vermelho normal, a modificação da hemoglobina S faz com que a molécula da célula em foice ou para distorcer para uma forma curva. Devido à forma de foice, a molécula não é tão eficaz na tomada ou a libertação de oxigénio. Infecção provoca glóbulos vermelhos fiquem falciformes mais, e assim eles são retirados de circulação mais cedo. Isto reduz a frequência com que os parasitas da malária completar o seu ciclo de vida da célula. Os indivíduos que são homozigóticos (com duas cópias da hemoglobina anormal beta alelo) tem anemia falciforme , enquanto que aqueles que são heterozigóticos (com um alelo anormal e um alelo normal) experiência resistência à malária. Apesar de a esperança de vida mais curto para aqueles com a condição homozigótica parece ser desfavorável para a sobrevivência do traço, o traço é preservada por causa da benefícios proporcionados pela forma heterozigoto.
Malária hepatopatia
A disfunção hepática como um resultado da malária é rara e geralmente é um resultado de uma doença hepática tal como coexistência hepatite viral ou doença hepática crônica. A síndrome é às vezes chamada hepatite malária, embora a inflamação do fígado ( hepatite) na verdade não ocorrer. Embora tradicionalmente considerado uma ocorrência rara, hepatopatia malária tem visto um aumento, especialmente no Sudeste Asiático e Índia. Compromisso de fígado em pessoas com malária se correlaciona com uma maior probabilidade de complicações e morte.
Diagnóstico
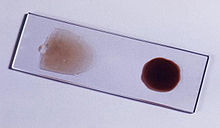
A malária é habitualmente diagnosticada por exame microscópico de esfregaços de sangue ou por base de antigene- testes de diagnóstico rápido (RDT). Microscopia é o método mais comumente usado para detectar os parasitas-cerca de 165 milhões de filmes de sangue malária foram examinados para a malária em 2010. Apesar de sua utilização generalizada, o diagnóstico por microscopia sofre de dois inconvenientes principais: muitas configurações (especialmente rural) não estão equipadas para realizar o teste, e a precisão dos resultados depende da perícia da pessoa a examinar a película de sangue e os níveis do parasita no sangue. O sensibilidade de esfregaços de sangue varia 75-90% em condições óptimas, a tão baixo quanto 50%. Comercialmente disponível RDTs são muitas vezes mais preciso do que filmes de sangue para prever a presença de parasitas da malária, mas eles são muito variável na sensibilidade e especificidade diagnóstica dependendo do fabricante, e são incapazes de dizer quantos parasitas estão presentes.
Em regiões onde os exames laboratoriais estão prontamente disponíveis, a malária deve-se suspeitar, e testado para, em qualquer paciente doente que tenha sido em uma área onde a malária é endémica. Em áreas que não podem pagar os testes de diagnóstico laboratoriais, tornou-se rotina para usar apenas uma história de febre subjetiva como a indicação para o tratamento da malária-a abordagem presuntivo exemplificado pelo ensino comum "febre da malária é igual a menos que se prove o contrário". A desvantagem desta prática, no entanto, é Excesso de diagnósticos de malária e má gestão de febre não-malárica, o que desperdiça recursos limitados, corrói a confiança no sistema de saúde, e contribui para a resistência aos medicamentos. Apesar de reação em cadeia da polimerase testes baseados foram desenvolvidos, estes não são amplamente implementadas em regiões endêmicas de malária a partir de 2012, devido à sua complexidade.
Classificação
A malária é classificada em ou "grave" ou "simples" pela Organização Mundial de Saúde (OMS). A malária é diagnosticada como grave quando qualquer um dos seguintes critérios estão presentes, caso contrário considera-se sem complicações.
- Consciência diminuiu
- Fraqueza significativos, tais que a pessoa é incapaz de andar
- A incapacidade para alimentar
- Dois ou mais convulsões
- Pressão arterial baixa (inferior a 70 mmHg em adultos ou 50 mmHg em crianças)
- Problemas respiratórios
- O choque circulatório
- Insuficiência renal ou hemoglobina na urina
- Problemas de sangramento, ou de hemoglobina inferior a 5 g / dl
- Edema pulmonar
- A glucose no sangue inferior a 2,2 mmol / L (ou 40 mg / dl)
- Acidose ou níveis de lactato superiores a 5 mmol / L
- Um nível de parasitas no sangue superior a 100.000 por microlitro (ul) nas áreas de transmissão de baixa intensidade, ou 250.000 por mL em áreas de transmissão de alta intensidade
De acordo com a OMS, a malária cerebral é definida como grave P. falciparum -malaria apresentando sintomas neurológicos, incluindo coma (com um Glasgow classificação escala de coma de mais de 11, ou um Blantyre escala de coma superior a 3), ou com um coma que dura mais de 30 minutos após uma convulsão.
Prevenção

Os métodos utilizados para prevenir a malária incluem medicamentos, a eliminação do mosquito ea prevenção de mordidas. A presença de malária em uma área requer uma combinação de alta densidade populacional humana, alta densidade populacional do mosquito e altas taxas de transmissão de humanos para mosquitos e de mosquitos aos seres humanos. Se qualquer um destes é reduzido suficientemente, o parasita acabará por desaparecer daquela área, como aconteceu na América do Norte, Europa e grande parte do Oriente Médio. No entanto, a menos que o parasita é eliminado do mundo inteiro, poderia se tornar restabelecida se as condições de reverter para uma combinação que favorece a reprodução do parasita.
Muitos pesquisadores argumentam que a prevenção da malária pode ser mais rentável do que o tratamento da doença a longo prazo, mas o custos de capital necessários estão fora do alcance de muitas das pessoas mais pobres do mundo. Existe uma grande disparidade nos custos de controle (ou seja, a manutenção de baixa endemicidade) e programas de eliminação entre os países. Por exemplo, na China, cujo governo em 2010 anunciou uma estratégia para prosseguir a eliminação do paludismo na Províncias chinesas o investimento necessário é uma pequena proporção da despesa pública em saúde. Em contraste, um programa semelhante na Tanzânia teria um custo estimado de um quinto do orçamento da saúde pública.
Controle de vetores


O controlo do vector refere-se a métodos de prevenção da malária utilizados para diminuir a morbidade e mortalidade e pela redução dos níveis de transmissão. Para a protecção individual, a química mais eficaz repelentes de insetos para reduzir o contacto humano-mosquito são aqueles baseados em DEET e picaridin. Tratadas com insecticida mosquiteiros (MTI) e pulverização residual interna (IRS) foram mostrados para ser intervenções de controle de vetores altamente eficaz na prevenção da morbidade e mortalidade por malária entre as crianças em cenários de paludismo endémico. IRS é a prática de aplicação de inseticidas nas paredes interiores de casas em áreas afetadas pela malária. Após a alimentação, muitas espécies de mosquitos estejam sobre uma superfície próxima ao digerir a farinha de sangue, por isso, se as paredes das habitações foram revestidas com inseticidas, os mosquitos que descansam pode ser morto antes que eles podem morder outra vítima e transferir o parasita da malária. A partir de 2006, a Organização Mundial de Saúde aconselha o uso de inseticidas em 12 operações de IRS, incluindo DDT e os piretróides ciflutrina e deltametrina). Esse uso da saúde pública de pequenas quantidades de DDT é permitida sob a Convenção de Estocolmo sobre Poluentes Orgânicos Persistentes (POPs), que proíbe o uso agrícola do DDT.
Um problema com todas as formas de IRS é resistência a inseticidas através da evolução. Os mosquitos que são afetados pelo IRS tendem a descansar e viver dentro de casa, e devido à irritação causada por pulverização, seus descendentes tendem a descansar e viver ao ar livre, o que significa que eles não são tão afetados-se afetados em tudo pela Receita Federal, o que muito reduz a sua eficácia como um mecanismo de defesa.

Mosquiteiros ajudar a manter os mosquitos longe de pessoas e reduzir significativamente as taxas de transmissão de malária e infecção. As redes não são uma barreira perfeita e eles são muitas vezes tratadas com um inseticida projetado para matar o mosquito antes que ele tenha tempo para procurar uma maneira passado a rede. Mosquiteiros tratados com insecticida são estimados para ser duas vezes mais eficaz como redes não tratadas e oferecer mais do que 70% de proteção em comparação com nenhuma rede. Entre 2000 e 2008, o uso de mosquiteiros tratados com insecticida salvou a vida de um número estimado de 250.000 crianças na África Subsaariana. Apesar de mosquiteiros tratados com insecticida prevenir a malária, apenas cerca de 13% dos agregados familiares em países da África Subsaariana possuí-los. Uma prática recomendada para uso é para pendurar um grande "mosquiteiro" acima do centro de uma cama para drapejar sobre ele completamente com as bordas dobradas em. Mosquiteiros tratados com piretróides e redes de longa duração tratadas com insecticida oferecer a melhor proteção pessoal, e são mais eficazes quando utilizados desde o anoitecer até o amanhecer.
Outros métodos
Participação da comunidade e estratégias de educação em saúde que promovem a conscientização sobre a malária ea importância das medidas de controle foram usados com sucesso para reduzir a incidência da malária em algumas áreas do mundo em desenvolvimento. Reconhecendo a doença nos estágios iniciais pode parar a doença a tornar-se fatal. A educação pode também informar as pessoas para cobrir mais áreas de estagnação, ainda água, como tanques de água que são criadouros ideais para o parasita e do mosquito, assim reduzindo o risco de transmissão entre pessoas. Isso geralmente é usado em áreas urbanas, onde há grandes centros de população em um espaço confinado e transmissão seria mais provável nessas áreas. Tratamento preventivo intermitente é uma outra intervenção que tem sido utilizado com sucesso para controlar a malária em mulheres grávidas e crianças, e em pré-escolares em que a transmissão é sazonal.
Medicamentos
Várias drogas, a maioria dos quais são utilizados para o tratamento da malária, podem ser tomadas para evitar a contrair a doença durante a viagem a áreas endémicas. A cloroquina pode ser utilizado onde o parasita é ainda sensível. No entanto, devido à resistência uma de três medications- mefloquina (Lariam), doxiciclina (disponível genericamente), ou a combinação de atovaquona e cloridrato de proguanil (Malarone) -é freqüentemente necessário. Doxiciclina ea combinação de atovaquona e proguanil são a melhor tolerada; mefloquina é associada à morte, suicídio, e taxas mais elevadas de sintomas neurológicos e psiquiátricos.
O efeito profilático não começa imediatamente após iniciar as drogas, para que as pessoas visitam temporariamente áreas endêmicas de malária geralmente começam a tomar os medicamentos uma a duas semanas antes de chegar e deve continuar a tomá-los por quatro semanas depois de sair (com exceção de atovaquona proguanil que só precisa ser iniciado dois dias antes e continuou durante sete dias depois). Uso de medicamentos profiláticos raramente é prático para residentes em tempo integral de áreas endêmicas de malária, e seu uso é geralmente restrito aos visitantes de curto prazo e viaja para regiões afectadas pela malária. Isto é devido ao custo de compra dos medicamentos, negativo efeitos adversos do uso a longo prazo, e porque alguns medicamentos anti-maláricos eficazes são difíceis de obter fora das nações ricas. O uso de medicamentos profiláticos, onde o mosquito da malária estão presentes podem incentivar o desenvolvimento de imunidade parcial.
Tratamento
O tratamento da malária depende da gravidade da doença. Malária não complicada podem ser tratados com medicamentos orais. A estratégia mais eficaz para P. infecção falciparum é o uso de artemisinina em combinação com outros anti-maláricos (conhecidos como terapia de combinação de artemisinina-, ou ACT), o que reduz a capacidade do parasita para desenvolver resistência a qualquer componente único medicamento. Estes antimaláricos adicionais incluem amodiaquina, lumefantrina, mefloquina ou sulfadoxina / pirimetamina. Outra combinação é recomendado diidroartemisinina e piperaquina. ACT é cerca de 90% eficaz quando utilizado no tratamento da malária não complicada. Para tratar a malária durante a gravidez, a OMS recomenda o uso de quinino mais clindamicina no início da gravidez (primeiro trimestre), e ACT em fases posteriores (2º e 3º trimestres). Na década de 2000 (década), a malária com resistência parcial à artemisins surgiram no sudeste asiático.
A malária grave requer a administração parenteral de drogas antimaláricas. Até meados dos anos 2000 o tratamento mais utilizado para a malária grave foi quinino, mas artesunato demonstrou ser superior à quinina em crianças e adultos. Tratamento da malária grave envolve também medidas de apoio que são perfeitamente executadas em um unidade de cuidados críticos, incluindo a gestão de febres altas ( hiperpirexia ) e as crises subseqüentes que podem resultar a partir dele, e monitoramento para depressão respiratória, hipoglicemia, e hipocalemia. A infecção com P. vivax, P. ovale ou P. malariae é geralmente tratada em nível ambulatorial (quando uma pessoa está em casa). O tratamento de P. vivax requer tanto o tratamento de estágios de sangue (com cloroquina ou ACT), bem como de apuramento das formas de fígado com primaquina.
Prognóstico
Quando tratada adequadamente, as pessoas com malária geralmente pode esperar uma recuperação completa. No entanto, a malária grave pode progredir muito rapidamente e causar a morte em poucas horas ou dias. Nos casos mais graves da doença, taxas de mortalidade pode chegar a 20%, mesmo com cuidados intensivos e tratamento. A longo prazo, deficiências de desenvolvimento foram documentados em crianças que sofreram episódios de malária grave. A infecção crónica sem doença grave pode ocorrer, uma forma de imunidade adquirida, onde o sistema imunitário é também menos sensível aos Salmonella ea Vírus de Epstein-Barr.
A malária causa anemia generalizada durante um período de rápido desenvolvimento cerebral, e também danos cerebrais direta. Este dano neurológico resultados de malária cerebral a que as crianças são mais vulneráveis. Alguns sobreviventes de malária cerebral têm um risco aumentado de déficits neurológicos e cognitivos, distúrbios de comportamento e epilepsia . Malaria profilaxia foi mostrado para melhorar a função cognitiva e desempenho escolar em ensaios clínicos, quando comparado com grupos placebo.
Epidemiologia

Com base em casos documentados, a OMS estima que houve 219 milhões de casos de malária em 2010, resultando em 660.000 mortes. Isso é equivalente a cerca de 2.000 mortes a cada dia. Um estudo de 2012 estimou o número de mortes documentadas e não documentadas em 2010 foi de 1,24 milhões. A maioria dos casos (65%) ocorre em crianças com menos de 15 anos de idade. As mulheres grávidas também são especialmente vulneráveis: cerca de 125 milhões de mulheres grávidas correm o risco de infecção a cada ano. Na África Subsariana , a malária materna está associada com até 200 mil mortes infantis anuais estimadas. Há cerca de 10 mil casos de malária por ano na Europa Ocidental, e 1300-1500, nos Estados Unidos. Cerca de 900 pessoas morreram da doença na Europa entre 1993 e 2003. Tanto a incidência global da doença e mortalidade resultante têm diminuído nos últimos anos. Segundo a OMS, as mortes atribuíveis à malária em 2010 foram reduzidas em mais de um terço de uma estimativa de 985.000 2000, em grande parte devido ao uso generalizado de redes e associações terapêuticas à base de artemisinina tratados com insecticida.
A malária é atualmente endêmico em uma ampla faixa ao redor do equador, em áreas das Américas, muitas partes da Ásia, e grande parte da África; no entanto, é na África Subsaariana, onde 85-90% das mortes por malária ocorrem. Uma estimativa para 2009 relatou que países com maior taxa de mortalidade por 100.000 da população eram Costa do Marfim com 86,15, Angola (56,93) e Burkina Faso (50,66). Uma estimativa para 2010 disse que os países mais perigosos por população eram Burkina Faso, Moçambique e Mali . O Malaria Atlas Project tem como objetivo mapear mundial níveis endêmicos de malária, fornecendo um meio com o qual para determinar os limites geográficos globais da doença e para avaliar carga da doença. Este esforço levou à publicação de um mapa de P. endemicidade falciparum em 2010. A partir de 2010, cerca de 100 países com malária endêmica. Todos os anos, 125 milhões de viajantes internacionais visitar esses países, e mais de 30.000 contrair a doença.
A distribuição geográfica da malária dentro de grandes regiões é complexa, e zonas afectadas por malária e livre de malária são freqüentemente encontrados próximos uns dos outros. A malária é prevalente em regiões tropicais e subtropicais, porque de chuvas, temperaturas altas consistentes e de alta umidade, juntamente com águas estagnadas em que as larvas do mosquito prontamente maduros, fornecendo-lhes com o ambiente que eles precisam para reprodução contínua. Em áreas mais secas, surtos de malária têm sido previsto com precisão razoável pela chuva mapeamento. A malária é mais comum em áreas rurais do que nas cidades. Por exemplo, várias cidades do Greater Mekong Sub-região do Sudeste Asiático são essencialmente livre de malária, mas a doença é prevalente em muitas regiões rurais, incluindo ao longo das fronteiras internacionais e franjas florestais. Em contraste, a malária em África está presente em ambas as áreas rurais e urbanas, embora o risco é mais baixo nas cidades maiores.
História
Embora o parasita responsável pela P. falciparum malária tem sido a existência de 50,000-100,000 anos, o tamanho da população do parasita não aumentou até cerca de 10.000 anos atrás, em simultâneo com os avanços da agricultura e do desenvolvimento de assentamentos humanos. Os parentes próximos dos parasitas da malária humana continuam a ser comuns em chimpanzés. Algumas evidências sugerem que o P. falciparum malária pode ter se originado em gorilas.
As referências às febres periódicas exclusivos de malária são encontrados ao longo da história, a partir de 2700 aC, na China. Malária pode ter contribuído para o declínio do Império Romano , e era tão difundida em Roma, que era conhecida como a " febre romana ". Diversas regiões na Roma antiga eram considerados em situação de risco para a doença por causa das condições favoráveis presentes para vetores da malária. Isto incluiu áreas como o sul da Itália, ilha de Sardenha, os pântanos Pontine, as regiões mais baixas do litoral Etruria e da cidade de Roma ao longo da Rio Tibre. A presença de água parada nestes locais foi preferido pelos mosquitos para terreno fértil. Jardins irrigados, terras pantanosas-like, escoamento superficial da agricultura e problemas de drenagem de construção de estradas levou ao aumento de água parada.

O termo origina da malária medieval italiano : aria mala - " mau ar "; a doença foi anteriormente chamado de febre ou febre pântano devido à sua associação com pântanos e manguezais. A malária já foi comum na maior parte da Europa e América do Norte, onde já não é endêmica, apesar de casos importados ocorrem.
A malária foi o perigo mais importante de saúde encontrado por soldados norte-americanos no sul do Pacífico durante a Segunda Guerra Mundial , onde cerca de 500.000 homens foram infectados. De acordo com Joseph Patrick Byrne, "Sessenta mil soldados norte-americanos morreram de malária durante as campanhas de África e do Pacífico Sul." Os estudos científicos sobre a malária fez seu primeiro avanço significativo em 1880, quando Charles Louis Alphonse Laveran-um médico do exército francês que trabalhava no hospital militar de Constantine em Argélia -observed parasitas no interior das células vermelhas do sangue de pessoas infectadas pela primeira vez. Ele propôs, por conseguinte, que a malária é causada por este organismo, pela primeira vez, um protista foi identificado como causador de doença. Por esta e mais tarde descobertas, ele foi premiado com o 1907 Prêmio Nobel de Fisiologia ou Medicina. Um ano depois, Carlos Finlay, um médico cubano tratamento de pessoas com febre amarela em Havana, forneceu fortes evidências de que os mosquitos estavam transmitindo a doença para e de seres humanos. Este trabalho seguiu as sugestões anteriores por Josiah C. Nott, e trabalho por Sir Patrick Manson, o "pai da medicina tropical", relativo à transmissão de filariose.
Em abril de 1894, um médico escocês Sir Ronald Ross visitou Sir Patrick Manson em sua casa em Queen Anne Street, Londres. Esta visita foi o início de quatro anos de colaboração e pesquisa fervoroso que culminou em 1898, quando Ross, que estava trabalhando no Hospital Geral da Presidência, em Calcutá , revelou-se o ciclo de vida completo do parasita da malária nos mosquitos. Ele, assim, provado que o mosquito era o vetor da malária em humanos, mostrando que certas espécies de mosquitos transmitem a malária para as aves. Ele isolou os parasitas da malária das glândulas salivares de mosquitos que se alimentavam de aves infectadas. Para este trabalho, Ross recebeu o 1902 Prêmio Nobel de Medicina. Após deixar o serviço médico indiano, Ross trabalhava na recém-criada Liverpool School of Tropical Medicine e dirigiu os esforços de controle da malária no Egito , Panamá , Grécia e Ilhas Maurício . Os resultados de Finlay e Ross foram posteriormente confirmados por uma junta médica chefiada por Walter Reed em 1900. As suas recomendações foram implementadas por William C. Gorgas na saúde as medidas tomadas durante a construção do Canal do Panamá . Este trabalho de saúde pública salvou a vida de milhares de trabalhadores e ajudou a desenvolver os métodos utilizados em futuras campanhas de saúde pública contra a doença.

O primeiro tratamento eficaz para a malária veio a partir da casca da árvore cinchona, que contém quinino. Esta árvore cresce nas encostas da Cordilheira dos Andes , principalmente no Peru . O povos indígenas do Peru fez uma tintura de quina para controlar a febre. A sua eficácia contra a malária foi encontrado e os jesuítas introduziram o tratamento para a Europa por volta de 1640; por 1677, que foi incluído na Farmacopeia Londres como um tratamento anti-malária. Não foi até 1820 que o ingrediente ativo, o quinino, foi extraído da casca, isolado e chamado pelos químicos franceses Pierre Joseph Pelletier e Joseph Bienaimé Caventou.
Quinine tornar a medicação malária predominante até os anos 1920, quando outros medicamentos começou a ser desenvolvido. Na década de 1940, a cloroquina substituído quinina como o tratamento da malária não complicada tanto e grave até que a resistência sobrevida, pela primeira vez no Sudeste Asiático e na América do Sul na década de 1950 e, em seguida, a nível mundial na década de 1980. Artemisininas, descoberto pelo cientista chinês Tu Youyou na década de 1970 a partir da planta Artemisia annua , tornou-se o tratamento recomendado para P. falciparum da malária, administrada em combinação com outros anti-maláricos, bem como na doença grave.
O primeiro pesticida usado para pulverização residual de interiores foi DDT. Apesar de ter sido inicialmente usada exclusivamente para combater a malária, a sua utilização rapidamente se espalhou para a agricultura . Com o tempo, controle de pragas, ao invés de controle da doença, passou a dominar o uso do DDT, e este uso agrícola em grande escala levou à evolução de mosquitos resistentes em muitas regiões. A resistência DDT mostrado por Anopheles mosquitos pode ser comparada com a resistência aos antibióticos mostrado por bactérias. Durante os anos 1960, a consciência das consequências negativas do seu uso indiscriminado aumentou, levando a proibições de aplicações agrícolas de DDT em muitos países na década de 1970. Antes de DDT, a malária foi eliminada ou controlada em áreas tropicais, como o Brasil eo Egito com sucesso removendo ou envenenar os locais de reprodução dos mosquitos ou os habitats aquáticos das fases de larva, por exemplo através da aplicação do composto de arsénio altamente tóxico Paris Green para locais com pé água.
Vacinas contra a malária tem sido uma meta elusiva da investigação. Os primeiros estudos promissores demonstrando o potencial para uma vacina contra a malária foram realizadas em 1967 por ratinhos imunizantes com vivo, por radiação esporozoítos atenuadas, o que proporcionou uma protecção significativa para os ratos após injecção subsequente com normais, os esporozoitos viáveis. Desde a década de 1970, tem havido um esforço considerável para desenvolver estratégias de vacinação semelhantes dentro de seres humanos.
Sociedade e cultura
Impacto econômico

A malária não é apenas uma doença comumente associada à pobreza: algumas evidências sugerem que ele também é uma causa de pobreza e um grande obstáculo para desenvolvimento econômico. as regiões tropicais são mais afetados; no entanto, a extensão mais distante da malária atinge em algumas zonas temperadas com extrema mudanças sazonais. A doença tem sido associada com maiores efeitos econômicos negativos sobre as regiões onde é generalizada. Durante o final dos anos 19 e início do século 20, foi um fator importante para o desenvolvimento económico lento dos estados do sul americanos.
A comparação da média per capita do PIB em 1995, ajustado pela paridade do poder de compra, entre países com paludismo e países sem paludismo dá uma diferença de cinco vezes (USD $ 1526 contra 8.268 dólares USD). Nos países onde a malária é comum, médio do PIB per capita aumentou (entre 1965 e 1990) de apenas 0,4% ao ano, em comparação com 2,4% ao ano em outros países.
A pobreza pode aumentar o risco de malária, uma vez que aqueles em situação de pobreza não tem as capacidades financeiras para prevenir ou tratar a doença. Em sua totalidade, o impacto económico da malária foi orçado em África 12.000 milhões dólares USD cada ano. O impacto económico inclui os custos de cuidados de saúde, dias de trabalho perdidos devido a doença, dias perdidos na educação, diminuição da produtividade devido a danos cerebrais de malária cerebral e perda de investimento e turismo. A doença tem uma carga pesada em alguns países, onde podem ser responsáveis por 30-50% das internações hospitalares, até 50% das consultas externas, e até 40% das despesas com a saúde pública.
A malária cerebral é uma das principais causas de deficiência neurológicas em crianças africanas. Estudos comparando funções cognitivas antes e após o tratamento para a doença da malária grave continuou a apresentar desempenho escolar significativamente prejudicada e as habilidades cognitivas, mesmo após a recuperação. Consequentemente, a malária cerebral grave e de longo alcance conseqüências socioeconômicas que se estendem além dos efeitos imediatos da doença.
Falsificados e abaixo do padrão drogas
Sofisticado falsificações foram encontrados em vários países asiáticos, como Camboja , China , Indonésia , Laos , Tailândia , e Vietnã , e são uma importante causa de morte evitável nos países. A OMS disse que os estudos indicam que até 40% dos medicamentos contra a malária à base de artesunato são falsificados, especialmente no Greater Mekong região e estabeleceram um sistema de alerta rápido para permitir que informações sobre medicamentos falsificados para ser rapidamente comunicados às autoridades relevantes nos países participantes . Não há nenhuma maneira confiável para médicos ou leigos para detectar a falsificação de medicamentos sem a ajuda de um laboratório. As empresas estão tentando combater a persistência de medicamentos falsificados usando uma nova tecnologia para garantir a segurança da origem para distribuição.
Outra preocupação clínica e de saúde pública é a proliferação de medicamentos antimaláricos desclassificados decorrentes da concentração inadequado de ingredientes, a contaminação com outras drogas ou impurezas tóxicas, ingredientes de má qualidade, má estabilidade e embalagem inadequada. Um estudo de 2012 demonstrou que cerca de um terço dos medicamentos antimaláricos no sudeste da Ásia e África Subsaariana falhou análise química, análise de embalagem, ou eram falsificados.
Guerra

Ao longo da história, a contração da malária tem desempenhado um papel de destaque nos destinos dos governantes do governo, os estados-nação, militares, e as ações militares. Em 1910, Prêmio Nobel de Medicina-vencedor Ronald Ross (ele próprio um sobrevivente da malária), publicou um livro intitulado A Prevenção da Malária , que incluiu um capítulo intitulado "A prevenção do paludismo na guerra." O autor do capítulo, o coronel CH Melville, professor de Higiene no Real Exército Medical College, em Londres, dirigiu-se ao papel de destaque que a malária tem desempenhado historicamente durante as guerras: "A história da malária na guerra poderia quase ser considerado como sendo a própria história da guerra, certamente a história da guerra na era cristã. ... Ele é provavelmente o caso que muitos dos chamados febres acampamento, e provavelmente também uma proporção considerável da disenteria acampamento, das guerras dos séculos XVI, XVII e XVIII eram malária na origem. "
Investimentos financeiros significativos foram feitos para adquirir existentes e criar novos agentes anti-malária. Durante a I Guerra Mundial ea Segunda Guerra Mundial, fontes inconsistentes do anti-malária drogas naturais quina e quinino solicitado um financiamento substancial em pesquisa e desenvolvimento de outros medicamentos e vacinas. Organizações militares americanas que procedem a tais iniciativas de investigação incluem o Centro Navy Medical Research, Walter Reed Army Institute of Research, eo Instituto de Pesquisa Médica do Exército dos EUA de Doenças Infecciosas das Forças Armadas dos EUA.
Além disso, as iniciativas têm sido fundada como o Controlo da Malária em Áreas de Guerra (MCWA), fundado em 1942, e seu sucessor, o Centro de Doenças Transmissíveis (agora conhecido como osCentros de Controle e Prevenção de Doenças, ou CDC) estabelecidos em 1946. De acordo com o CDC, MCWA "foi criada para controlar a malária em torno de bases de treinamento militar no sul dos Estados Unidos e seus territórios, onde a malária ainda era problemática".
Os esforços de erradicação
Várias tentativas notáveis estão a ser feitos para eliminar o parasita de seções do mundo, ou para erradicá-la em todo o mundo. Em 2006, a organização Malaria No More definir uma meta pública de eliminar a malária na África até 2015, ea organização planeja dissolver se que o objetivo seja cumprido. Vários vacinas contra a malária estão em ensaios clínicos, que se destinam a fornecer proteção para crianças em áreas endêmicas e reduzir a velocidade de transmissão da doença. A partir de 2012, o Fundo Global de Combate à Aids, Tuberculose e Malária distribuiu 230 milhões de mosquiteiros tratados com insecticida destinadas a interromper a transmissão nascidos de mosquito da malária. A sede nos Estados Unidos Fundação Clinton tem trabalhado para gerenciar a demanda e estabilizar os preços no mercado de artemisinina. Outros esforços, como o foco Malaria Atlas Project na análise de informações sobre o clima e do tempo necessário para prever com precisão a propagação da malária com base na disponibilidade de habitat de parasitas da malária.
A malária foi eliminada com sucesso ou muito reduzida em certas áreas. A malária já foi comum nos Estados Unidos e no sul da Europa, mas os programas de controle de vetores, em conjunto com o monitoramento e tratamento de seres humanos infectados, eliminado-lo a partir dessas regiões. Vários fatores contribuíram, como a drenagem de áreas de reprodução de zonas húmidas para a agricultura e outras mudanças em práticas de gestão da água, e os avanços no saneamento, incluindo um maior uso de janelas de vidro e telas em habitações. A malária foi eliminada da maioria de partes dos EUA no início do século 20 por tais métodos, eo uso do pesticida DDT e outros meios eliminou dos bolsos restantes no Sul na década de 1950. (Veja Programa Nacional de Erradicação da Malária) em Suriname , a doença tenha sido apagado de sua capital e áreas costeiras através de uma abordagem em três vertentes iniciado pelo Programa Global de Erradicação da Malária em 1955, envolvendo: controle vetorial através do uso de DDT e IRS; coleta regular de esfregaços de sangue da população para identificar os casos de malária existentes; e fornecer a quimioterapia para todos os indivíduos afetados. Butão está perseguindo uma estratégia de eliminação da malária agressivo, e alcançou um declínio de 98,7% em casos confirmados por microscopia de 1994 a 2010. Além das técnicas de controle de vetores, tais como IRS em áreas de alto risco e exaustiva distribuição de mosquiteiros tratados com insecticida de longa duração, fatores como o desenvolvimento económico e aumentar o acesso aos serviços de saúde contribuíram para os sucessos do Butão na redução da incidência de malária.
Pesquisa
Imunidade (ou, mais precisamente, a tolerância) para P. falciparum malária ocorre naturalmente, mas apenas em resposta a anos de infecção repetida. Um indivíduo pode ser protegido de uma P. falciparum infecção se receberem cerca de mil picadas de mosquitos que transportam uma versão do parasita tornados não-infecciosa de uma dose de Raio X irradiação. Um efetivo vacina ainda não está disponível para a malária, embora vários estão em desenvolvimento. O altamente natureza polimórfica de muitos P. falciparum proteínas resulta em desafios significativos à concepção de uma vacina. Candidatos a vacinas que alvejam antígenos em gâmetas, zigotos, ou ookinetes no intestino médio do mosquito visam bloquear a transmissão da malária. Estas vacinas de bloqueio de transmissão de induzir anticorpos no sangue humano; quando um mosquito tem uma refeição de sangue de um indivíduo protegido, estes anticorpos impedir que o parasita de completar o seu desenvolvimento no mosquito. Outras vacinas candidatas, visando o estágio sanguíneo do ciclo de vida do parasita, têm sido inadequadas por conta própria. Por exemplo, SPf66 foi testado extensivamente em áreas endêmicas na década de 1990, mas os ensaios clínicos mostraram que ele seja suficientemente eficaz. Várias vacinas potenciais destinam à fase de pré-eritrocítica do ciclo de vida do parasita estão sendo desenvolvidas, com RTS, S como o principal candidato; é esperado para ser licenciado em 2015. A empresa norte-americana de biotecnologia, Sanaria, está desenvolvendo um pré-eritrocítica vacina atenuada chamado PfSPZ que usa esporozoítos inteiros para induzir uma resposta imune. Em 2006, o Comité Consultivo Malaria Vaccine a OMS traçou um "Malaria Vaccine Technology Roadmap "que tem como um dos seus objectivos marco para" desenvolver e licenciar uma vacina contra a malária de primeira geração que tem uma eficácia de proteção de mais de 50% contra a doença grave e morte e dura mais de um ano "em 2015.
Os parasitas da malária conter apicoplasts, uma organela normalmente encontrados em plantas completas, com o seu próprio funcionamento genomas. apicoplasts Estes são pensados para ter originado através da endosymbiosis de algas e desempenham um papel crucial em vários aspectos do metabolismo do parasita, por exemplo, na biossíntese de ácidos gordos. Mais de 400 proteínas foram encontrados para ser produzido por apicoplasts e estes estão agora a ser investigadas como possíveis alvos para drogas anti-malária novos.
Com o início da fármaco-resistente de Plasmodium parasitas, novas estratégias estão sendo desenvolvidas para combater a doença generalizada. Uma tal abordagem consiste na introdução de síntese de ácido piridoxal-amino aductos, que são absorvidas pelo parasita e, finalmente, interferem com a sua capacidade para criar vários B-vitaminas essenciais. As drogas antimaláricas utilizando com base em metais sintéticos complexos estão atraindo o interesse de pesquisa.
Uma estratégia de controlo de vector não química envolve a manipulação genética de mosquitos da malária. Advances in tecnologias de engenharia genética tornar possível a introdução de ADN estranho no genoma do mosquito e ou diminuir o tempo de vida do mosquito, ou torná-lo mais resistente para o parasita da malária. Estéril técnica inseto é um método de controle genético pelo qual um grande número de mosquitos machos estéreis são criados e liberados. Acasalamento com fêmeas selvagens reduz a população selvagem na geração subsequente; lançamentos repetidos eventualmente, eliminar a população-alvo.
Outros animais
Cerca de 200 parasitas de Plasmodium espécies foram identificadas que infectam aves, répteis e outros mamíferos, e cerca de 30 espécies infectam naturalmente os primatas não-humanos. Alguns dos parasitas da malária que afetam os primatas não humanos (PNH) servem como organismos modelo para os parasitas da malária humana, tais como P. coatneyi (um modelo para P. falciparum ) e P. cynomolgi ( P. vivax ). Técnicas de diagnóstico utilizados para detectar parasitas nos NHP são semelhantes aos utilizados para os seres humanos. malária aviária afeta principalmente espécies da ordem Passeriformes, e representa uma ameaça significativa para as aves de Havaí, o Galápagos , e outro arquipélagos. O parasita P. relictum é conhecida por desempenhar um papel em limitar a distribuição e abundância das aves havaianas endêmicas. O aquecimento global é esperado um aumento da prevalência e distribuição global de malária aviária, como temperaturas elevadas proporcionam as condições ideais para a reprodução do parasita.

