
Níquel
Fundo para as escolas Wikipédia
Crianças SOS oferecem um download completo desta seleção para as escolas para uso em escolas intranets. patrocínio SOS Criança é legal!
| Níquel | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
28 Ni | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||||||||
brilhante, metálico, prata e com um tom de ouro  | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | níquel, Ni, 28 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / n ɪ k əl / NIK -əl | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | de metal de transição | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 10, 4, d | ||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 58,6934 (4) (2) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Ar ] 4s 2 3d 8 ou [ Ar ] 4s 1 3d 9 (ver texto) 2, 8, 16, 2, ou 2, 8, 17, 1 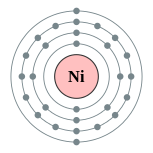 | ||||||||||||||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Axel Fredrik Cronstedt (1751) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Primeiro isolamento | Axel Fredrik Cronstedt (1751) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 8,908 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 7,81 g cm -3 · | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 1728 K , 1455 ° C, 2651 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 3186 K, 2913 ° C, 5275 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 17,48 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 377,5 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 26,07 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 4, 3, 2, 1, -1 (Levemente óxido de base) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,91 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 737,1 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2: 1753,0 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 3395 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 124 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 124 ± 16:00 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 163 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | cúbica de face centrada  | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | ferromagnético | ||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 69,3 Nco · m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 90,9 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) de 13,4 pM · · K -1 m -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | ( RT) 4900 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | 200 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 76 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | 180 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0.31 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Vickers | 638 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 700 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-02-0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de níquel | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
O níquel é um elemento químico com o símbolo químico Ni e número atômico 28. É um brilhante branco-prateado de metal com um ligeiro tom dourado. Níquel pertence aos metais de transição e é difícil e dúctil. Níquel puro apresenta uma actividade química significativa que pode ser observado quando é níquel pó para maximizar o exposto área de superfície na qual as reacções podem ocorrer, mas maiores pedaços de metal são lentos a reagir com ar em condições ambiente, devido à formação de uma superfície de óxido de protecção. Mesmo assim, o níquel é suficientemente reactivos com o oxigénio de modo que níquel nativo raramente é encontrado na superfície da Terra, sendo na sua maioria confinados ao interior dos maiores meteoritos de ferro-níquel que estavam protegidos contra a oxidação durante o seu tempo no espaço. Na Terra, como níquel nativo é sempre encontrada em combinação com ferro, um reflexo da origem desses elementos como principais produtos finais da nucleossíntese supernova. Uma mistura de ferro-níquel é pensado para compor a da Terra núcleo interior.
A utilização de níquel (como um naturais meteórica liga de níquel-ferro) foi rastreada tanto para trás como 3500 aC. O níquel foi isolado pela primeira vez e classificado como um elemento químico em 1751 pela Axel Fredrik Cronstedt, que inicialmente confundiu sua minério de um mineral de cobre. O nome do elemento vem de um sprite pernicioso da mitologia do mineiro alemão, Nickel (semelhante ao Old Nick), que personificava o fato de que os minérios de cobre-níquel resistiu refinamento em cobre. Uma fonte economicamente importante de níquel é o ferro minério limonite, que muitas vezes contém 1-2% de níquel. Outros minérios importantes de níquel incluem garnierite, e pentlandite. Os principais locais de produção incluem Sudbury região no Canadá (que é pensado para ser de origem meteórica), Nova Caledônia , no Pacífico e Norilsk na Rússia.
Por causa do ritmo lento do níquel de oxidação à temperatura ambiente, ele é considerado resistente à corrosão. Historicamente isso levou a sua utilização para metais chapeamento como o ferro eo bronze, para a sua utilização para o aparelho de química, e o seu uso em certas ligas que retêm um elevado polonês prateado, tal como Prata alemã. Cerca de 6% da produção mundial de níquel é usado ainda para o chapeamento puro-níquel resistente à corrosão. O níquel foi uma vez um componente comum de moedas, mas tem sido largamente substituído por ferro mais barato para o efeito, especialmente uma vez que o metal é uma pele alérgeno para algumas pessoas.
O níquel é um dos quatro elementos que são ferromagnético próximo da temperatura ambiente. Alnico ímãs permanentes com base, em parte, níquel são de força intermediária entre ímãs permanentes à base de ferro e ímãs de terras raras. O metal é especialmente valioso no mundo moderno para o ligas que ele forma; cerca de 60% da produção mundial é utilizado em baterias de níquel-aço (particularmente aço inoxidável). Outras ligas comuns, assim como nova superligas, fazer-se a maior parte do restante da utilização mundial do níquel, por processos químicos utiliza para compostos de níquel que consomem menos do que 3% da produção. Como um composto, de níquel tem um número de utilizações de fabrico nicho químicos, tais como um catalisador para hidrogenação. Enzimas de alguns microrganismos e plantas contêm níquel como um local activo, o que faz com que o metal de um nutriente essencial para eles.
Características
Propriedades atômicas e físicas
O níquel é um metal prateado-branco com um ligeiro tom dourado que leva um polonês alto. É um dos únicos quatro elementos que são magnética em temperatura ambiente ou próximo, os outros são de ferro, cobalto e gadolínio . Sua Temperatura de Curie é 355 ° C, o que significa que grandes quantidades de níquel é não magnético acima dessa temperatura. A célula unitária de níquel é um face do cubo centrado com o parâmetro de rede de 0,352 nm dando uma raio atômico de 0,124 nm. Níquel pertence aos metais de transição e é difícil e dúctil.
Electron disputa configuração
O átomo de níquel tem dois configurações eletrônicas, [ar] 4s 2 3d 8 e [Ar] 4s 1 3d 9, que são muito próximos em energia, em que o símbolo [Ar] refere-se ao argônio estrutura do núcleo -como. Há algum desacordo quanto ao que deve ser considerado a configuração de energia mais baixo. Livros de química citar a configuração eletrônica do níquel como [Ar] 4s 2 3d 8, ou equivalentemente como [Ar] 3d 8 4s 2. Esta configuração está de acordo com o Madelung regra ordenação energia, que prevê que 4s é preenchido antes 3d. Ele é apoiada pelo facto experimental de que o estado mais baixo de energia do átomo de níquel é um nível de energia 4s 2 3d 8, especificamente a 3d 8 (3 M) 4s 2 3 F, J = 4 nível.
No entanto cada uma destas duas configurações, de facto, dá origem a um conjunto de estados a diferentes energias. Os dois conjuntos de energias se sobrepõem, ea energia média de estados que têm configuração [Ar] 4s 1 3d 9 é na verdade menor do que a energia média dos estados que têm configuração [Ar] 4s 2 3d 8. Por este motivo a literatura de pesquisa sobre cálculos atômicos cita a configuração estado fundamental de níquel como um 4s 3d 9.
Isótopos
De ocorrência natural de níquel é composto por 5 estáveis isótopos ; 58 Ni, 60 Ni, Ni 61, 62 e 64 Ni Ni Ni com 58 sendo o mais abundante (68,077% abundância natural). 62 Ni é o nuclídeo mais estável de todos os elementos existentes, com energia de ligação mais do que ambos 56 Fe, muitas vezes erradamente citado como mais estável, e 58 Fe. 18 radioisótopos tem sido caracterizado como sendo o mais estável 59 Ni com uma meia-vida de 76.000 anos, 63 Ni com uma meia-vida de 100,1 anos, e 56 de Ni com uma meia-vida de 6,077 dias. Todos os restantes isótopos radioativos possuem meias-vidas que são menos de 60 horas ea maioria destes com meias-vidas abaixo de 30 segundos. Este elemento apresenta também uma estado meta.
Níquel-56 é produzido pela processo e queima de silício mais tarde libertado em grandes quantidades durante Tipo Ia supernovas . A forma do curva de luz dessas supernovas na intermediária da década de vezes corresponde à decadência via a captura eletrônica de níquel-56 a cobalto -56 e, finalmente, para o ferro-56. Nickel-59 é uma vida longa cosmogênico radionuclídeos com meia-vida de 76.000 anos. 59 Ni encontrou muitas aplicações em isótopo geologia. 59 Ni tem sido usado para datar a idade terrestre de meteoritos e determinar abundâncias de poeira extraterrestre em gelo e sedimentos . Nickel-60 é o produto filha do radionuclídeo extinto 60 Fe, que decai com uma meia-vida de 2,6 milhões de anos. Porque 60 Fe tem uma meia-vida tão longa, sua persistência no materiais no sistema solar em concentrações suficientemente elevadas pode ter gerado variações observáveis na composição isotópica de 60 Ni. Portanto, a abundância de 60 Ni presente no material de extraterrestre pode fornecer informações sobre a origem do sistema solar e sua história. Níquel-62 tem a maior energia por núcleo de qualquer isótopo obrigatório para qualquer elemento (8,7946 MeV / nucleon). Isótopos mais pesados do que 62 Ni não pode ser formado por fusão nuclear sem perder energia. 48 Ni, descoberto em 1999, é o mais forte elemento de isótopos ricos em prótons conhecido. Com 28 prótons e 20 nêutrons 48 Ni é " dupla mágica "(como 208 Pb ) e, portanto, extraordinariamente estável.
Os isótopos de níquel no intervalo peso atômico de 48 U (48 NI) 78 L (78 Ni). Meia-vida de Níquel-78 foi recentemente medido a 110 milissegundos, e acredita-se um isótopo importante nucleossíntese supernova de elementos mais pesados do que o ferro.
Ocorrência

Na Terra, níquel ocorre mais freqüentemente em combinação com enxofre e ferro em pentlandite, com enxofre em millerite, com arsênico no mineral nickeline, e com arsênico e enxofre em níquel galena. O níquel é comumente encontrada em meteoritos de ferro como as ligas kamacite e taenite.
A maior parte do níquel extraído vem de dois tipos de depósitos de minério. Os primeiros são lateritos onde as principais minérios são nickeliferous limonite: (Fe, Ni) O (OH) e garnierite (um silicato hidratado de níquel): (Ni, Mg) 3 Si 2 O 5 (OH) 4. O segundo são depósitos de sulfeto magmáticos, onde o mineral de minério principal é pentlandite: (Ni, Fe) S 9 8.
Austrália e Nova Caledônia tem as maiores reservas de estimativa (45% todos juntos).
Em termos de Recursos Mundiais, recursos terrestres identificados média de 1% de níquel ou superior conter, pelo menos, 130 milhões de toneladas de níquel (cerca do dobro das reservas conhecidas). Cerca de 60% está em laterites e 40% está em depósitos de sulfeto.
Baseado em evidência geofísica, a maior parte do níquel na Terra é postulada para ser concentrada na Terra núcleo exterior e núcleo interior. Kamacite e taenite são naturais ligas de ferro e níquel. Para kamacite a liga é geralmente na proporção de 90:10 a 95: 5, embora as impurezas, tais como cobalto ou carbono podem estar presentes, enquanto que para taenite o teor de níquel é entre 20% e 65%. Kamacite e taenite ocorrer em meteoritos de ferro níquel.
Compostos
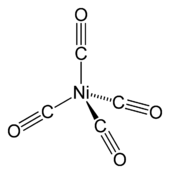
O mais comum estado de oxidação do níquel é 2, mas compostos de 0 Ni, Ni +, Ni 3+ e são bem conhecidos, e Ni 4+ tem sido demonstrada.
Níquel (0)
Tetracarbonylnickel (Ni (CO) 4), descoberto pela Ludwig Mond, é um líquido volátil, altamente tóxico, à temperatura ambiente. No aquecimento, o complexo decompõe de volta ao monóxido de níquel e carbono:
- Ni (CO) 4
 Ni + 4 CO
Ni + 4 CO
Este comportamento é explorado na Mond processo para a purificação de níquel, como descrito acima. O níquel relacionados (0) complexa bis (ciclo-octadieno) níquel (0) é um catalisador útil na química organo devido à facilmente deslocados ligantes de bacalhau.
O níquel (I)
De níquel (I) e os compostos complexos são raras. O vermelho escuro diamagnético K 4 [2 Ni (CN) 6] é um exemplo representativo de Ni (I). Ele é preparado por redução de K 2 [2 Ni (CN) 6] usando amálgama de sódio. Este composto é instável e liberta H2 gasoso a partir de água.
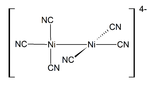
O níquel (II)


Níquel (II) forme compostos com todos os aniões comuns, ou seja, se o sulfureto, sulfato, carbonato, hidróxido, carboxilatos e halogenetos. O níquel (II) sulfato é produzido em grandes quantidades através da dissolução de metal de níquel ou óxidos em ácido sulfúrico. Ela existe tanto como um hexa- e heptahydrates. Este composto é útil para níquel galvanoplastia.
Os quatro halogênios formar compostos de níquel, os quais adotam geometrias octaédricas. Níquel (II), cloreto é o mais comum, e o seu comportamento é ilustrativo dos outros halogenetos. O níquel (II) é produzido cloreto de resíduos por dissolução do níquel em ácido clorídrico. O dicloreto é normalmente encontrado como o hexahidrato de verde, mas pode ser desidratado para dar o amarelo anidro NiCl2. Alguns complexos de níquel tetracoordinate (II) formam duas geometrias planares tetraédricos e quadrados. Os complexos são tetraédricos paramagnéticos eo planar quadrado complexos são diamagnetic. Este equilíbrio, bem como a formação de complexos octaédricos contrasta com o comportamento dos complexos bivalentes dos metais mais pesados do grupo 10, de paládio (II) e platina (II), que tendem a adoptar apenas complexos planares quadrados.
Niqueloceno é conhecida; que tem uma contagem de electrões de 20, tornando-se relativamente instáveis.

O níquel (III) e (IV)
Para compostos simples, de níquel (III) e de níquel (IV) ocorre apenas com fluoreto e óxidos, com excepção de KNiIO 6, que pode ser considerado como um sal formal do [IO 6] 5- iónica. Ni (IV) estiver presente no óxido misto banio 3, enquanto Ni (III) está presente em óxido de níquel (III), que é utilizado como o cátodo em muitos baterias recarregáveis, incluindo níquel-cádmio, níquel-ferro, hidrogénio níquel, e hidreto de níquel-metal, e usada por determinados fabricantes Baterias Li-ion. O níquel (III) podem ser estabilizadas por ligandos σ doadores, como e tióis fosfinas.
História
Porque os minérios de níquel são facilmente confundidos com minérios de prata, a compreensão deste metal e seu uso remonta a tempos relativamente recentes. No entanto, o uso não intencional de níquel é antigo, e pode ser rastreada tanto quanto 3500 aC. Bronzes do que é agora a Síria continha até 2% de níquel. Além disso, há manuscritos chineses sugerindo que "cobre branco" ( cuproníquel, conhecido como Baitong) foi usado lá entre 1700 e 1400 aC. Esta cobre branco Paktong foi exportada para a Grã-Bretanha já no século 17, mas o teor de níquel desta liga não foi descoberto até 1822.
Em medievais Alemanha, um mineral vermelho foi encontrado no Erzgebirge (Montanhas Ore) que lembravam minério de cobre. No entanto, quando os mineiros foram incapazes de extrair qualquer cobre a partir dele, eles culparam um sprite pernicioso da mitologia alemã, Nickel (semelhante ao Old Nick), para que assedia o cobre. Eles chamaram isso de minério kupfernickel do Kupfer alemão para o cobre. Este minério é agora conhecido por ser nickeline ou niccolite, um níquel arsenieto. Em 1751, o Barão Axel Fredrik Cronstedt estava tentando extrair cobre a partir de kupfernickel-e, em vez produziu um metal branco que ele nomeado após o espírito que tinha dado seu nome ao mineral, de níquel. Em alemão moderno, kupfernickel ou Kupfer-Níquel designa a liga cuproníquel.
Após a sua descoberta, a única fonte de níquel era o raro kupfernickel mas, a partir de 1824 em diante, o níquel foi obtido como um subproduto de produção de azul cobalto. O primeiro grande produtor de níquel foi a Noruega, que explorava rica em níquel pyrrhotite de 1848 por diante. A introdução de níquel na produção de aço em 1889 aumentou a demanda por níquel, e os depósitos de níquel de Nova Caledônia , que foram descobertos em 1865, desde que a maioria de oferta mundial entre 1875 e 1915. A descoberta de grandes depósitos no Bacia Sudbury, no Canadá, em 1883, em Norilsk-Talnakh, a Rússia em 1920, e na Merensky Reef, África do Sul, em 1924, fez a produção em larga escala de níquel possível.

Níquel tem sido um componente de moedas desde meados do século 19. Nos Estados Unidos, o termo "níquel" ou "nick" inicialmente aplicado ao cobre-níquel Voando cento Eagle, que substituiu o cobre com 12% de níquel 1857-1858, em seguida, o Centavo principal indiano da mesma liga 1859-1864. Ainda mais tarde, em 1865, o termo designava o níquel de três cento, com o níquel aumentou para 25%. Em 1866, o cinco centavos níquel escudo (25% de níquel, 75% de cobre) apropriou-se da designação. Juntamente com a proporção de liga, este termo tem sido utilizado para o presente nos Estados Unidos. Moedas de níquel quase puro foram utilizados pela primeira vez em 1881, na Suíça, e mais notadamente 99,9% de níquel moedas de cinco centavos foram atingidas no Canadá (maior produtora de níquel do mundo no momento) durante os anos de guerra não-1.922-1.981, e seu teor de metais fez essas moedas magnético. Durante o período da guerra 1942-45, mais ou todos níquel foi removido de moedas canadenses e norte-americanos, devido ao uso da guerra crítica de níquel na armadura. Canadá comutada novamente para ligas de aço banhado durante a Guerra da Coréia, mas foi forçado a parar de fazer níquel puro "níqueis", em 1981, reservando-se a liga de níquel puro 99,9% depois de 1968 apenas aos seus moedas de maior valor. Finalmente, no século 21, com o aumento dos preços do níquel, a maioria dos países que antes eram usadas níquel em suas moedas abandonaram o metal por razões de custo, e os EUA cinco centavos continua sendo uma das poucas moedas que ainda usa o metal para outra coisa senão exterior chapeamento.
A produção mundial
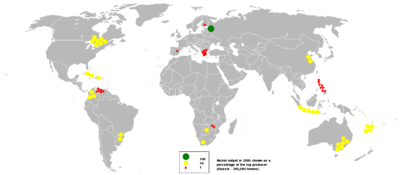
| Produção e reservas Mina | 2010 | 2011 | Reservas |
|---|---|---|---|
| Austrália | 170.000 | 180.000 | 24000000 |
| Botswana | 28.000 | 32.000 | 490.000 |
| Brasil | 59.100 | 83.000 | 8700000 |
| Canadá | 158.000 | 200.000 | 3300000 |
| China | 79.000 | 80.000 | 3,000,000 |
| Colômbia | 72.000 | 72.000 | 720.000 |
| Cuba | 70.000 | 74.000 | 5500000 |
| República Dominicana | 0 | 14.000 | 1.000.000 |
| Indonésia | 232.000 | 230.000 | 3900000 |
| Madagáscar | 15.000 | 25.000 | 1600000 |
| New Caledonia | 130.000 | 140.000 | 12000000 |
| Filipinas | 173.000 | 230.000 | 1100000 |
| Rússia | 269.000 | 280.000 | 6.000.000 |
| África Do Sul | 40.000 | 42.000 | 3700000 |
| Outros países | 99.000 | 100.000 | 4600000 |
| Total mundial (toneladas métricas, arredondado) | 1590000 | 1800000 | 80000000 |
Em 2011, a Rússia foi o maior produtor de níquel com cerca de quota mundial de um quinto seguido de perto pelo Canadá, Austrália e Indonésia e Filipinas, conforme relatado pelo US Geological Survey. Os maiores depósitos de níquel na Europa não russa estão localizadas na Finlândia, ea segunda maior da Grécia. Um depósito de níquel no oeste da Turquia tinham sido exploradas, com este local ser especialmente conveniente para as fundições europeias, siderúrgicas e fábricas.
Recursos terrestres identificados média de 1% de níquel ou superior conter, pelo menos, 130 milhões de toneladas de níquel. Cerca de 60% está em laterites e 40% está em depósitos de sulfeto. Além disso, extensos recursos de profundidade de níquel estão em crostas e nódulos de manganês que cobrem grandes áreas do fundo do oceano, particularmente no Oceano Pacífico.
A uma localidade nos Estados Unidos onde o níquel foi extraído comercialmente é Riddle, Oregon, onde várias milhas quadradas de níquel-rolamento depósitos superficiais garnierite estão localizados. A mina fechou em 1987. O Projeto da mina de Eagle é uma proposta nova mina de níquel em Michigan de península superior.
Extracção e purificação
O níquel é recuperado através de metalurgia extrativa. O níquel é extraída a partir dos seus minérios por meio de processos de torrefacção e de redução convencionais que produzem um metal de maior do que 75% de pureza. Em muitos aplicações de aço inoxidável, de 75% de níquel puro pode ser utilizado sem purificação adicional, dependendo da composição das impurezas.
A maioria dos minérios de sulfureto têm sido tradicionalmente processadas utilizando técnicas pirometalúrgicas para produzir um fosco para refinação. Os recentes avanços na hidrometalurgia resultaram na purificação de níquel significativa usando esses processos. A maioria dos depósitos de sulfeto têm sido tradicionalmente processada por concentração através de um processo de flutuação em espuma, seguido por extração pirometalúrgico. Em processos hidrometalúrgicos, minérios de sulfeto de níquel passam por flotação (flutuação diferencial se a razão Ni / Fe é muito baixa) e, em seguida fundido. Depois de produzir o níquel matte, processamento adicional é feito através do Processo Sherritt-Gordon. Em primeiro lugar, o cobre é removido por adição de sulfureto de hidrogénio, deixando um concentrado de apenas cobalto e níquel. Em seguida, extracção com solvente é utilizado para separar o cobalto e níquel, com a concentração de níquel final superior a 99%.

Electrolítica
Uma segunda forma comum de refinação envolve a lixiviação do metal fosco em uma solução de um sal de níquel, seguido pelo electro-conquista do niquel a partir da solução por plaqueamento sobre um cátodo de níquel electrolítico.
Processo Mond

Purificação de óxidos de níquel para se obter o metal puro é realizada através da Mond processo, o que aumenta o concentrado de níquel a uma maior do que 99,99% de pureza. Este processo foi patenteada por L. Mond e tem estado em uso industrial uma vez antes do início do século 20. No processo, o níquel é feito reagir com monóxido de carbono a cerca de 40-80 ° C, para formar carbonilo de níquel, na presença de um catalisador de enxofre. Ferro dá pentacarbonil ferro também, mas esta reação é lenta. Se necessário, pode ser separado por destilação. Dicobalto octacarbonilo também é formada neste processo, mas decompõe-se a dodecacarbonyl tetracobalt à temperatura de reacção para dar um sólido não volátil.
O níquel é re-obtido a partir do carbonilo de níquel por um de dois processos. Ela pode ser passada através de uma câmara grande a temperaturas elevadas em que dezenas de milhares de esferas de níquel, chamados peletes, estão constantemente agitados. Em seguida, decompõe-se depositar níquel puro para as esferas de níquel. Alternativamente, o carbonilo de níquel pode ser decomposto numa câmara menor a 230 ° C para criar um pó fino de níquel. O monóxido de carbono resultante é re-circulada e reutilizado no processo. O níquel altamente pura produzida por este processo é conhecido como "níquel carbonilo".
Valor do metal
O preço do níquel subiram mercado ao longo de 2006 e nos primeiros meses de 2007; a partir de 05 de abril de 2007, o metal foi negociado a 52.300 USD / tonelada ou 1,47 USD / oz O preço posteriormente caiu drasticamente a partir destes picos, e de 19 de janeiro de 2009, o metal foi negociado a 10.880 USD / tonelada.
O Moeda de níquel US contém 0,04 onças (1,25 g) de níquel, que ao preço abril de 2007 foi no valor de 6,5 cêntimos, juntamente com 3,75 gramas de cobre no valor de cerca de 3 centavos de dólar, fazendo com que o valor do metal ao longo de 9 centavos. Uma vez que o valor de face de um níquel é de 5 centavos, isto tornou um alvo atraente para a fusão por pessoas que querem vender os metais com lucro. No entanto, o United States Mint, em antecipação a esta prática, implementadas novas regras provisórias em 14 de dezembro de 2006, sujeito a consulta pública por 30 dias, o que criminalizam a fusão e exportação de centavos e níqueis. Os infratores podem ser punidos com uma multa de até US $ 10.000 e / ou presos por um período máximo de cinco anos.
A partir de 16 de setembro de 2011, o valor de fusão de um níquel é US $ 0,0600409, que é 20% maior do que o valor de face.
Aplicações

A fracção da produção mundial de níquel presentemente utilizados para várias aplicações é a seguinte: 46% para fazer aços de níquel; 34% em não-ferrosos ligas e superligas; 14% galvanoplastia, e 6% em outros usos.
O níquel é usado em muitos produtos industriais e de consumo específicos e reconhecíveis, incluindo aço inoxidável, alnico ímãs, cunhagem, baterias recarregáveis, cordas da guitarra elétrica, cápsulas de microfone e ligas especiais. É também usado para efeitos de revestimento e como uma tonalidade verde em vidro. O níquel é um metal preeminently liga, e seu uso principal é nos aços de níquel e ferro fundido de níquel, de que há muitas variedades. É também amplamente utilizados em muitas outras ligas, tais como latões e bronzes, níquel e ligas com cobre, crómio, alumínio, chumbo, cobalto, prata, ouro e ( Inconel, Incoloy, Monel, Nimonic).

Devido à sua resistência à corrosão, o níquel tenha sido ocasionalmente utilizados historicamente como um substituto para a decoração de prata. O níquel também foi usado ocasionalmente em alguns países depois de 1859 como uma cunhagem de metal barato (ver acima), mas começando os últimos anos do século 20, em grande parte substituído pelo mais barato aço inoxidável (isto é, ligas de ferro), exceto nomeadamente nos Estados Unidos.
O níquel é um excelente agente de liga para alguns outros metais preciosos, e assim utilizado na chamada teste de fogo, como um coletor de elementos do grupo da platina (PGE). Como tal, o níquel é susceptível de recolha completa de todos os 6 elementos PGE, a partir de minérios, além de recolha parcial de ouro. Minas de níquel de alto rendimento pode também envolver-se em recuperação PGE (principalmente platina e paládio ); exemplos são Norilsk na Rússia e na Bacia de Sudbury, no Canadá.
Espuma de níquel ou níquel malha é usado em eletrodos de difusão de gás para células de combustível alcalinas.
Níquel e suas ligas são freqüentemente usados como catalisadores para hidrogenação reações. Níquel de Raney, uma liga de níquel-alumínio finamente dividido, é uma forma comum, no entanto catalisadores relacionados também são frequentemente utilizados, incluindo catalisadores relacionados 'Raney do tipo'.
O níquel é um material magnetostritivo naturalmente, o que significa que, na presença de um do campo magnético, o material sofre uma pequena alteração no comprimento. No caso do níquel, esta alteração no comprimento é negativo (contracção do material), que é conhecido como negativo magnetoestricção e é da ordem de 50 ppm.
O níquel é usado como um ligante na cimentada carboneto de tungsténio ou metal duro indústria e utilizados em proporções de seis a 12% em peso. O níquel pode fazer o carboneto de tungsténio magnética e adiciona propriedades resistentes à corrosão para as partes de carboneto de tungsténio cimentada, embora a dureza é inferior à das peças feitas com cobalto ligante.
Papel biológico
Apesar de não ser reconhecidas até 1970, níquel desempenha papéis importantes na biologia de microrganismos e plantas. A enzima vegetal urease (uma enzima que auxilia na hidrólise de ureia ) contém níquel. O NiFe- hidrogenases contêm níquel além conjuntos do ferro-enxofre. Tal [NiFe] -hydrogenases caracteristicamente oxidar H 2. Um coenzima níquel-tetrapirrole, Cofactor F430, está presente no metil redutase coenzima M, que poderes metanogênico archaea. Uma das enzimas desidrogenase de monóxido de carbono é composta por um conjunto de Fe-Ni-S. Outras enzimas que contém níquel incluem uma classe bacteriana rara de superóxido dismutase e glioxalase I enzimas em várias bactérias e parasitas eucarióticos parasitas tripanossoma (esta enzima em organismos superiores, incluindo leveduras e mamíferos, utiliza divalente de zinco , Zn 2+).
Toxicidade
Em os EUA, o nível mínimo de risco de níquel e seus compostos é definida como 0,2 mg / m 3 para inalação durante 15-364 dias. Fume sulfeto de níquel e poeira são acreditados outros compostos carcinogénicos, e vários níquel pode ser tão bem. Níquel carbonilo, [Ni (CO) 4], é um gás extremamente tóxico. A toxicidade de carbonilos de metais é uma função tanto da toxicidade do metal, bem como a capacidade do carbonilo para desprender altamente tóxico monóxido de carbono de gás, e esta não é excepção; carbonilo de níquel também é explosiva no ar. Indivíduos sensibilizados pode mostrar uma alergia ao níquel, que afectam a sua pele, também conhecido como dermatite. Sensibilidade ao níquel podem também estar presentes em pacientes com pompholyx. O níquel é uma causa importante de alergias de contacto, em parte devido à sua utilização em joalharia destinado a orelhas furadas. Alergias ao níquel que afectam orelhas furadas são muitas vezes marcadas por coceira, vermelhidão na pele. Muitos brincos são feitos agora livre de níquel devido a este problema. A quantidade de níquel permitido em produtos que entram em contacto com a pele humana é regulamentado pela União Europeia . Em 2002, pesquisadores descobriram quantidades de níquel a ser emitida por uma e duas moedas de euro muito além dessas normas. Isto é devido a uma Acredita reacção galvânica.
Nickel foi votado Alérgeno do Ano em 2008 pela American Society Dermatite de contato.
Relatórios também mostrou que tanto a activação induzida pelo factor de níquel de hipóxia-indutível (HIF-1) e a sobre-regulação de genes de hipoxia-inducible são devido aos níveis intracelulares de ascorbato empobrecido. A adição de ácido ascórbico para o meio de cultura aumentou o nível intracelular e ascorbato invertido tanto a estabilização induzida por metais de HIF-1 e expressão do gene dependente de HIF-1α.

