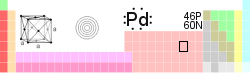
Paládio
Fundo para as escolas Wikipédia
Arranjar uma seleção Wikipedia para as escolas no mundo em desenvolvimento sem internet foi uma iniciativa da SOS Children. Clique aqui para saber mais sobre apadrinhamento de crianças.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dados gerais | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome , símbolo, número | paládio, Pd, 46 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | metais de transição | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, Período, Bloco | 10, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | metálico branco prateado  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 106,42 (1) · g mol-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Kr ] 4d 10 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elétrons por concha | 2, 8, 18, 18, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 12,023 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 10,38 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 1.828,05 K (1554,9 ° C, 2830,82 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 3236 K (2963 ° C, 5365 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 16,74 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Calor de vaporização 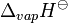 | 362 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade de calor específico | (25 ° C) 25,98 J · · mol -1 K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | cúbico centrado cara | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 2, 4 (Levemente óxido de base) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 2,20 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 804,4 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segunda: 1870 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 3177 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 140 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atómico (cale.) | 169 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 131 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 163 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | sem dados | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C), 105,4 N-m Ω | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | (300 K) de 71,8 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) de 11,8 pM · · K -1 m -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 3070 Senhora | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | 121 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 44 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | 180 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0.39 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 4.75 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Vickers | 461 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 37,3 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-05-3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos mais estáveis | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Referências | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Palladium (pronuncia \ pe-'lä-de-em \) é um metal branco-prateado rara e brilhante que foi descoberto em 1803 por William Hyde Wollaston, que deu o nome de paládio após o asteróide Pallas, que por sua vez, foi nomeado para a deusa da sabedoria grega. O símbolo de paládio é Pd, e a sua número atómico é 46. paládio, juntamente com a platina , ródio , ruténio , irídio e ósmio formar um grupo de elementos referido como o metais do grupo da platina (PGM). Platinóides partilham propriedades químicas semelhantes, mas de paládio é único na medida em que tem o ponto de fusão mais baixo e é a menos densa desses metais preciosos. Incrivelmente, quando é paládio à temperatura ambiente e à pressão atmosférica, que pode absorver até 900 vezes o seu próprio volume de hidrogénio , o que torna paládio num meio de armazenamento eficiente e seguro para os isótopos de hidrogénio e de hidrogénio. Paládio também é manchar de calor, bem como intensa electricamente resistente estável e resistente à erosão química.
As propriedades únicas de paládio e outras PGM exigem a sua utilização generalizada como um em cada quatro dos bens manufaturados hoje ou conter PGM ou tinha PGM desempenhar um papel fundamental durante o processo de fabricação. Mais de metade da oferta de paládio e sua irmã de metal platina vai para Os catalisadores, que convertem-se para 90% do escape de gases nocivos (auto hidrocarbonetos, monóxido de carbono e óxido de nitrogênio) em substâncias menos nocivas ( azoto , dióxido de carbono e vapor de água). Preciosas qualidades de metal de paládio e aparência gerar consumo significativo no luxo de jóias mercado. Palladium é encontrada em muitos aparelhos eletrônicos, incluindo computadores , telefones celulares , multi-camada de condensadores cerâmicos, chapeamento de componente, de baixa tensão contatos elétricos, e / OLED / LCD SED televisores . Paládio também é usado em odontologia, medicina , purificação do hidrogênio, para aplicações químicas, tratamento de águas subterrâneas, e está desempenhando um papel-chave na tecnologia utilizada para células de combustível, que combinam hidrogênio e oxigênio para produzir eletricidade, calor e água praticamente sem poluição .
Depósitos de minério de paládio e outras PGM são raros, e os depósitos mais extensas foram encontrados no cinturão do norite Complexo Bushveld Igneous no Transvaal na África do Sul , a Complexo Stillwater em Montana, EUA , a Distrito de Sudbury Ontario Canadá ea Complexo Norilsk na Rússia . Além de mineração , paládio também é recuperada através de reciclagem ; a maior parte dos quais vem de conversores catalíticos em fim de vida. As numerosas aplicações e fontes de fornecimento limitado de resultado paládio em paládio desenho considerável interesse de investimento.
História
Paládio era descoberto por William Hyde Wollaston em 1803 . Este elemento foi nomeado por Wollaston em 1804 após o asteróide Pallas, que foi descoberto dois anos antes.
Wollaston encontrado paládio em minério de platina bruto da América do Sul através da dissolução do minério em água régia, neutralizando a solução com hidróxido de sódio , e precipitando como platina cloroplatinato amónio com de cloreto de amónio. Acrescentou cianeto de mercúrio para formar o composto cianeto de paládio, o que foi aquecida para extrair metal paládio.
Cloreto de paládio foi em um tempo prescrito como tuberculose tratamento a uma taxa de 0,065 g por dia (cerca de um miligrama por quilograma de peso corporal). Este tratamento teve muitos negativo efeitos colaterais, e mais tarde foi substituída por medicamentos mais eficazes.
A afinidade de paládio para o hidrogênio a levou a desempenhar um papel essencial na Fleischmann-Pons experimento em 1989, também conhecido como a fusão a frio.
Na corrida até 2000 , a oferta russa de paládio para mercado global foi repetidamente adiado e interrompido porque a quota de exportação não foi concedida em tempo, devido a razões políticas. O que se seguiu compra de pânico do mercado levou os preços do paládio para um momento de alta de US $ 1100 por onça, alcançado em janeiro de 2001. Durante o período de tempo, a Ford Motor Company , com medo de perturbações da produção do veículo automóvel devido a uma possível escassez de paládio, estocou grande quantidades de metal, adquiridos perto do preço elevado. Como os preços posteriormente caiu no início de 2001 , a Ford perdeu US $ 1 bilhão de dólares dos EUA .
A procura mundial de paládio aumentou de 100 toneladas em 1990 para cerca de 300 toneladas em 2000. A produção global de minas era de 222 toneladas métricas em 2006, de acordo com dados do USGS. Mais paládio é utilizada para catalisadores na indústria automobilística.
Ocorrência
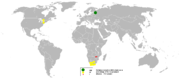
Em 2005, a Rússia foi o maior produtor de paládio com pelo menos 50% de participação mundial, seguido pela África do Sul, EUA e Canadá, relata o British Geological Survey.
Palladium é encontrado como um metal livre e ligado com platina e ouro com metais do grupo da platina em depósitos placer da Montes Urais, Austrália , Etiópia , Sul e América do Norte . Ele é produzido comercialmente a partir de níquel - cobre depósitos encontrados na África do Sul , Ontário, e Sibéria; o enorme volume de minério processado torna esta extracção rentável, apesar da baixa proporção de paládio nestes minérios. Maior produtor do mundo único de paládio é MMC Norilsk Nickel produzido a partir da Depósitos de níquel Norilsk-Talnakh. O Merensky do Reef Bushveld Igneous Complex da África do Sul contém paládio significativa, além de outras elementos do grupo da platina. O Complexo ígneo de Stillwater Montana também contém paládio lavráveis.
Palladium também é produzido em fissão nuclear e reatores pode ser extraído de combustível nuclear irradiado, ver Síntese de metais nobres, embora a quantidade produzida é insignificante.
O paládio é encontrado nos minerais raros cooperite e polarité.
Características

O paládio é um metal branco-prata macio que se assemelha platina . É o menos densa e tem o menor ponto de fusão do metais do grupo da platina. Ele é macio e maleável quando recozido e aumenta grandemente a sua resistência e dureza quando está frio trabalhado. O paládio é quimicamente atacado por sulfúrico , nítrico , e ácido clorídrico , em que se dissolve lentamente. Este metal também não reage com oxigénio a temperaturas normais (e, portanto, não manchar em ar ). Palladium aquecida a 800 ° C irá produzir uma camada de óxido de paládio (II) (DOP). É levemente mancha úmida na atmosfera contendo enxofre.
Esse metal tem a capacidade invulgar absorver até 900 vezes o seu próprio volume de hidrogénio à temperatura ambiente. Pensa-se que este possivelmente formas hidreto de paládio (PDH 2), mas ainda não é claro se isto é um verdadeiro composto químico .
Quando paládio absorveu grandes quantidades de hidrogênio, ele irá se expandir ligeiramente em tamanho.
Comuns estados de oxidação de paládio são 0, + 1, 2 e 4. Embora tenha sido originalmente 3 pensado como um dos estados fundamentais de oxidação de paládio, não há nenhuma evidência de paládio que ocorre no estado de oxidação +3; este tem sido investigada através Difracção de raios X para um certo número de compostos, o que indica um dímero de paládio (II) e paládio (IV) em vez disso. Recentemente, os compostos com um estado de oxidação de 6 foram sintetizados.
Isótopos
Paládio de ocorrência natural é composto por seis isótopos . O mais estáveis radioisótopos são 107 Pd com uma meia-vida de 6,5 milhões de anos 103 Pd com uma meia-vida de 17 dias, e 100 de Pd com uma meia-vida de 3,63 dias. Dezoito outros radioisótopos foram caracterizados com pesos atômicos que variam de 92,936 u (Pd 93) para 119,924 u (120 Pd). A maioria destes com meias-vidas que são menos de meia hora, excepto 101 Pd (meia-vida: 8,47 horas), 109 Pd (meia-vida: 13,7 horas), e 112 Pd (meia-vida: 21 horas) .
O primário modo de decaimento antes do isótopo estável mais abundante, 106 Pd, é captura eletrônica eo primeiro modo após é decaimento beta. O primário produto de decaimento antes 106 Pd é ródio e do produto primário depois é prata .
Radiogênico 107 Ag é um produto do decaimento de 107 Pd e foi descoberto pela primeira vez no Santa Clara, Califórnia meteorito de 1978 . Os descobridores sugerem que a coalescência e diferenciação de pequenos planetas com núcleo de ferro pode ter ocorreu 10 milhões de anos após a evento nucleosynthetic. 107 Pd contra Ag correlações observadas nos corpos, que foram claramente derretido desde acreção do sistema solar , deve refletir a presença de nuclídeos de vida curta no início do Sistema Solar.
Aplicações
O paládio é utilizado em odontologia, assistir fazendo, em tiras de teste de açúcar no sangue, em aeronaves velas de ignição e na produção de instrumentos cirúrgicos e contatos elétricos. Paládio também é usado para fazer profissional flautas transversais.
Eletrônica
A maior aplicação de paládio em eletrônica está fazendo a condensador de cerâmica multicamadas. Paládio (paládio e prata ligas) são usados como eléctrodos em multi-camada de cerâmica capacitores. Palladium (por vezes ligado com níquel ) é usado em chapeamentos conector em eletrônicos de consumo.
É também usado em chapeamento de componentes electrónicos e nos materiais de soldadura. O setor de eletrônicos consumidos 1,07 milhões de onças troy de paládio em 2006, de acordo com um Relatório Johnson Matthey.
Tecnologia
Hidrogénio facilmente se difunde através paládio aquecida; assim, fornece um meio de purificação do gás. Reactores de membrana com membranas de Pd são, portanto, utilizados para a produção de hidrogénio .
É como parte do eléctrodo de paládio-em hidrogénio estudos electroquímicos. Paládio (II), cloreto pode absorver grandes quantidades de monóxido de carbono de gás, e é usado em detectores de monóxido de carbono.
Catálise
Quando se está finamente dividido, tal como em paládio sobre carvão, paládio constitui um bom catalisador e é utilizado para acelerar a hidrogenação e reacções de desidrogenação, bem como em craqueamento de petróleo. Um grande número de ligação carbono-carbono formando reacções em química orgânica (tal como a Heck e Acoplamento de Suzuki) são facilitados por catálise com compostos de paládio. O maior uso de paládio é hoje em conversores catalíticos.
Pd é também um metal versátil para catálise homogénea. Ele é utilizado em combinação com uma ampla variedade de ligandos para transformações químicas altamente selectivos.
Armazenamento de hidrogênio
Hidreto de paládio é paládio metálico que contém uma quantidade substancial de hidrogénio no seu estrutura de cristal. Em temperatura ambiente e atmosférica pressão, o paládio pode absorver até 935 vezes o seu próprio volume de hidrogênio em um processo reversível. Esta propriedade foi investigado por causa de armazenamento de hidrogénio é de tal interesse e uma melhor compreensão do que acontece no nível molecular pode dar pistas para a concepção melhorada hidretos metálicos. Uma loja de paládio com base, no entanto, seria proibitivamente dispendiosa devido ao custo do metal.
Jóias

Palladium si tem sido ocasionalmente usado como um metal precioso em jóias , como substituto para a platina ou ouro branco. Isto é devido às suas propriedades naturalmente brancos dando-lo sem necessidade de um ródio chapeamento. É um pouco mais branco, muito mais leve e cerca de 12% mais. Semelhante ao ouro, paládio pode ser derrotado em uma forma de folha fina tão fino quanto 100 nm (1 / 250.000 em). Como a platina, que vai desenvolver um nebuloso patina ao longo do tempo. Ao contrário de platina, no entanto, paládio a descolorir temperaturas de soldagem, tornar-se frágil com aquecimento e arrefecimento repetido, e reagir com ácidos fortes.
Ele também pode ser usado como um substituto para o níquel ao fazer ouro branco. O paládio é um dos três metais mais utilizados que podem ser ligados com ouro para produzir ouro branco. ( níquel e prata podem também ser usados.) paládio-ouro é uma liga muito mais caro do que o níquel-ouro, mas é hipoalergénico e mantém a sua cor branca melhor.
Quando platina foi declarado um recurso governo estratégico durante a Segunda Guerra Mundial , muitas bandas de jóias eram feitas de paládio. Ainda recentemente, em Setembro de 2001, paládio era mais caro do que a platina e raramente usado em jóias, também devido ao obstáculo técnico de casting. No entanto o problema de vazamento foi resolvido, e seu uso em jóias aumentou devido a um grande aumento nos preços da platina e uma queda no preço do paládio.
Antes de 2004, o principal uso do paládio em jóias foi como uma liga na fabricação de jóias de ouro branco, mas, começando no início de 2004 quando o ouro e os preços da platina começou a subir acentuadamente, joalheiros chineses começaram a fabricar volumes significativos de jóias de paládio. Johnson Matthey estima que, em 2004, com a introdução de jóias de paládio na China, a demanda por paládio para fabricação de jóias foi 920 mil onças ou cerca de 14% da demanda total de paládio para 2004, um aumento de quase 700 mil onças de 2003. Este crescimento contínuo em 2005, com a demanda mundial de jóias estimada para o paládio de cerca de 1,4 milhão onças, ou quase 21% da oferta de paládio net, novamente com a maior parte da demanda centrada na China.
Fotografia
Com o platinotype fotógrafos processo de impressão fazer belas-artes impressões em preto-e-branco, utilizando sais de platina ou paládio. Frequentemente utilizado com platina, paládio fornece uma alternativa à prata.
Arte
Folha Palladium é uma das várias alternativas à folha de prata usado na iluminação do manuscrito. O uso da folha de prata é problemática devido à sua predisposição para manchar. Folha de alumínio é uma alternativa muito barato, no entanto alumínio é muito mais difícil de trabalhar do que o ouro ou a prata e os resultados em menos de melhores resultados quando do emprego de técnicas tradicionais folheando de metal, e assim por folha de paládio é considerado o melhor substituto apesar de seu custo considerável. Folha de platina pode ser usada para o mesmo efeito que a folha de paládio com propriedades de trabalho semelhantes, mas não é tão facilmente disponíveis comercialmente em forma de folha.