
Fase (matéria)
Fundo para as escolas Wikipédia
Crianças SOS voluntários ajudaram a escolher artigos e fez outro material currículo Um link rápido para o patrocínio criança é http://www.sponsor-a-child.org.uk/
Nas ciências físicas , uma fase é uma conjunto de estados de um sistema físico macroscópica que têm composição química relativamente uniforme e propriedades físicas (ou seja, densidade , estrutura cristalina, índice de refracção, e assim por diante).
Fases vs. estados da matéria
As fases são, por vezes, confundido com estados da matéria, mas existem diferenças significativas. Membros da matéria refere-se a diferenças entre os gases , líquidos , sólidos , de plasma , etc. Se existem duas regiões de um sistema químico que se encontram em diferentes estados da matéria, então eles devem ser diferentes fases. No entanto, o inverso não é verdadeiro - um sistema pode ter várias fases que estão em equilíbrio um com o outro e também no mesmo estado da matéria. Esta diferença é particularmente importante quando se considera o Regra das fases de Gibbs, que regula o número de fases permitidos.
Misturas pode ter várias fases, o que muitas vezes acontece quando dois substâncias imiscíveis dissolver em um outro em pequenas quantidades. Por exemplo, uma mistura pode ser composto de uma fase de óleo (óleo de 95%, 5% de água) e uma fase aquosa (95% água, 5% de óleo).
O polimorfismo é a capacidade de um sólido de existir em mais do que uma forma cristalina. Por exemplo, água de gelo é normalmente encontrado sob a forma hexagonal Gelo Ih, mas também pode existir como a cúbica gelo Ic, o rhombohedral II gelo, e muitas outras formas.
As fases amorfas são também possíveis com a mesma molécula, tal como gelo amorfo. Neste caso, o fenómeno é conhecido como polyamorphism.
Para elementos químicos puros, polimorfismo é conhecido como allotropy . Por exemplo, diamante , grafite, e fulerenos são diferentes alótropos do carbono .
Definição geral de fases
Em geral, dois estados diferentes de um sistema estão em diferentes fases, se houver uma mudança abrupta em suas propriedades físicas enquanto a transformação de um estado para o outro. Por outro lado, dois estados estão na mesma fase, se eles podem ser transformados uns nos outros, sem quaisquer mudanças abruptas. Há, no entanto, excepções a esta afirmação - por exemplo, o ponto crítico líquido-gás discutido abaixo na seção de diagramas de fase.
Um ponto importante é que os diferentes tipos de fases estão associadas com diferentes qualidades físicas. Ao discutir o sólido, líquido e fases gasosas, falamos sobre rigidez e compressão, e os efeitos da variação da pressão e volume, porque essas são as propriedades relevantes que distinguem um sólido, um líquido e um gás. Por outro lado, quando se discute paramagnetismo e ferromagnetismo, olhamos para a magnetização, porque isso é o que distingue a fase ferromagnética da fase paramagnética. Vários outros exemplos de fases será dada na seção seguinte.
Em linguagem mais técnica, uma fase é uma região no espaço de parâmetros de variáveis termodinâmicas em que o energia livre é analítica; entre essas regiões há mudanças abruptas nas propriedades do sistema, que correspondem às descontinuidades nos derivados da função de energia livre. Contanto que a energia livre é analítica, todas as propriedades termodinâmicas (tais como entropia , capacidade de calor, magnetização, e compressibilidade) será comportou-se bem, porque eles podem ser expressos em termos de energia livre e seus derivados . Por exemplo, a entropia é o negativo da primeira derivada da energia livre com a temperatura (a uma pressão constante).
Quando um sistema passa de uma fase para outra, geralmente haverá uma fase em que a energia livre é não analítica. Isto é um transição de fase. Devido a isso não analiticidade, as energias livres de ambos os lados da transição são duas funções diferentes, assim uma ou mais propriedades termodinâmicas terão um comportamento muito diferente após a transição. A propriedade mais comumente examinados neste contexto é a capacidade de calor. Durante a transição, a capacidade de calor pode tornar-se infinito, saltar bruscamente para um valor diferente, ou exibem uma "dobra" ou descontinuidade no seu derivado . Veja também calorimetria de varrimento diferencial.

Diagramas de fase
As diferentes fases de um sistema pode ser representado usando um diagrama de fases. Os eixos dos diagramas são as variáveis termodinâmicas relevantes. Para os sistemas mecânicos simples, geralmente usamos o pressão e temperatura .
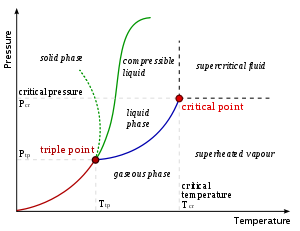
As marcas no diagrama de fases mostram os pontos onde a energia livre é não-analítica. Os espaços abertos, onde a energia livre é analítica, correspondem às fases. As fases são separadas por linhas de não-analiticidade, onde ocorrem as transições de fase, que são chamados fronteiras de fase.
No diagrama, o limite de fase entre o líquido e gás não continuar indefinidamente. Em vez disso, ele termina num ponto no diagrama de fase a chamada ponto crítico. A temperaturas e pressões acima do ponto crítico, as diferenças de propriedades físicas que diferenciam a fase líquida a partir da fase de gás tornam-se menos definida. Isso reflete o fato de que, em temperaturas extremamente altas e pressões, as fases líquidas e gasosas tornam-se indistinguíveis. Em água, o ponto crítico ocorre em cerca de 647 K (374 ° C ou 705 ° F) e 22,064 MPa.
A existência do ponto crítico líquido-gás revela uma ligeira ambiguidade em nossas definições acima. Ao passar do estado líquido para o estado gasoso, normalmente um cruza o limite de fase, mas é possível escolher um caminho que não atravessa a fronteira, indo para a direita do ponto crítico. Assim, as fases às vezes pode misturar continuamente um no outro. Esta nova fase que tem algumas propriedades que são semelhantes às de um líquido e algumas propriedades que são semelhantes às de um gás é um chamado fluido supercrítico. Devemos notar, porém, que isso não acontece sempre. Por exemplo, é impossível para o limite de fase sólida-líquida para terminar num ponto crítico da mesma maneira como o limite de gás-líquido, porque as fases sólida e líquida têm diferentes simetria.
Um aspecto interessante a notar é que o limite de fase sólida-líquida no diagrama de fases da maior parte das substâncias, tais como o mostrado acima, tem uma inclinação positiva. Isto é devido à fase sólida que tem uma densidade mais elevada do que o líquido, de modo que o aumento da pressão aumenta a temperatura de fusão. No entanto, no diagrama de fase para água o limite de fase sólido-líquido tem um declive negativo. Isto reflecte o facto de gelo tem uma densidade inferior à da água, o que é uma propriedade invulgar de um material.
A separação de fases
Separação de fases é a transformação de um sistema homogêneo em duas (ou mais) fases e comumente encontrado em muitos ramos da ciência e da tecnologia. Um exemplo é a a cristalização de um sólido a partir de uma solução. Um modelo matemático universal de separação de fases é fornecido pela Equação de Cahn-Hilliard.
Equilíbrio de fases
A distribuição da energia cinética entre moléculas não é uniforme, e muda de forma aleatória. Isto significa que, digamos, a superfície de um líquido, pode haver uma molécula individual com a energia cinética suficiente para saltar para a fase gasosa. Do mesmo modo, as moléculas de gás individuais podem ter baixa energia cinética suficiente para se juntar outras moléculas na fase líquida. Este fenómeno significa que em qualquer dada temperatura e pressão, múltiplas fases pode co-existir.
Por exemplo, sob condições normais de temperatura e pressão, uma tigela de água líquida no ar seco vai evaporar até que o pressão parcial da água gasosa é igual a pressão de vapor de água. Neste ponto, a taxa de moléculas que saem e que entram na fase líquida será a mesma que (devido ao aumento do número de moléculas de água gasosas disponível para re-condensado). O facto de que as moléculas de líquidos com uma energia cinética superior à média foram removidos a partir dos resultados na bacia resfriamento evaporativo. Processos semelhantes podem ocorrer em outros tipos de fronteiras de fase.
Gibbs ' regra fase refere-se ao número de possíveis fases, variáveis tais como a temperatura e a pressão, e se ou não um equilíbrio será alcançado.
Transição de fase
A transição de fase ou, mudança de fase, descreve quando uma substância muda de estado da matéria - ex. fusão do gelo à água é uma mudança de fase porque um sólido mudou para um líquido. Para uma mudança de fase a ocorrer, a energia deve ser adicionado ou removido da substância. A energia de calor, ou entalpia associada com uma transição de sólido para líquido, é a entalpia de fusão, que para o líquido para gás é a entalpia de vaporização, e para produtos sólidos de gás é a calor de sublimação. Normalmente a adição ou remoção de energia vai mudar a temperatura da substância, tal como a energia cinética das partículas aumentará ou diminuirá. Durante uma mudança de fase no entanto, a energia potencial de a substância muda medida que as partículas se movem mais afastadas ou aproximadas. Não há nenhuma variação da energia cinética das partículas e, portanto, nenhuma alteração resultante na temperatura.

