
Taxa de reação
Informações de fundo
Esta seleção Escolas foi originalmente escolhido pelo SOS Children para as escolas no mundo em desenvolvimento sem acesso à internet. Ele está disponível como um download intranet. SOS Children trabalha em 45 países africanos; você pode ajudar uma criança em África ?


A velocidade de reacção ou a taxa de reacção para uma ou reagente produto em uma determinada reacção é intuitivamente definida como o quão rápido uma reação ocorre. Por exemplo, a oxidação do ferro sob a atmosfera é uma reação lenta que pode levar muitos anos, mas a combustão de butano no fogo é uma reação que ocorre em frações de segundo.
Cinética química é a parte de físico-química que estuda as taxas de reação. Os conceitos de cinética química são aplicadas em muitas disciplinas, tal como engenharia química, enzimologia e engenharia ambiental .
Definição formal de taxa de reação
Considere-se um típico reacção química :
- aA + bB → PP + qQ
As letras minúsculas (a, b, p, e q) representam coeficientes estequiométricos, enquanto que as letras maiúsculas representam a reagentes (A e B) e o produtos (P e Q).
Conforme IUPAC de Gold Book definição da velocidade da reacção v (também R ou R) para uma reacção química que ocorre numa sistema fechado sob condições de volume constante, sem uma acumulação de intermediários da reacção, é definido como:
A IUPAC recomenda que a unidade de tempo deve ser sempre o segundo. Em tal caso, a velocidade da reacção difere da taxa de aumento da concentração de um produto P por um factor constante (o recíproco da sua número estequiométrico) e por um reagente pelo menos a um inverso do número estequiométrico. Taxa de reação geralmente tem as unidades de mol dm -3 s -1. É importante ter em mente que a definição anterior só é válido para uma única reação, em um sistema fechado de volume constante. Este pressuposto mais normalmente implícito deve ser expressamente mencionado, caso contrário, a definição é incorrecta: Se a água é adicionada a um vaso contendo água salgada, a concentração de sal diminui, embora não haja nenhuma reacção química.
Para qualquer sistema em geral a plena balanço de massa deve ser levada em conta: IN - OUT + GERAÇÃO = ACÚMULO
Quando aplicado ao caso referido anteriormente simple esta equação reduz-se a: ![v = \ frac {d [A]} {dt}](../../images/163/16346.png)
Para uma única reacção em sistema fechado, de volume variável a chamada taxa de conversão pode ser utilizado, a fim de evitar o manuseamento concentrações. É definida como a derivada da extensão da reacção em função do tempo.
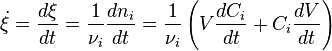
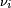 é o coeficiente estequiométrico para a substância i,
é o coeficiente estequiométrico para a substância i, 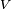 é o volume de reacção e
é o volume de reacção e 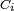 é a concentração da substância de i.
é a concentração da substância de i.
Quando os produtos secundários ou intermediários da reacção são formados, a IUPAC recomenda a utilização de uma taxa de aparência e velocidade de desaparecimento para os produtos e reagentes, respectivamente termos.
As taxas de reacção também pode ser definido de forma que não é o volume do reactor. Quando um catalisador é utilizado a taxa de reacção pode ser expressa numa base de peso de catalisador (g mol-1 s-1) ou a área de superfície (mol m -2 s -1) base. Se a base é um local de catalisador específico que podem ser rigorosamente contado por um método especificado, a taxa é dado em unidades de s-1 e é chamada uma frequência de turnover.
Fatores que influenciam a taxa de reação
Os factores que afectam a velocidade da reacção:
- Concentração: velocidade de reacção aumenta com a concentração, tal como descrito pela lei de velocidade e explicou por teoria da colisão. Com o aumento da concentração dos reagentes, a frequência de aumentos colisão.
- A natureza da reacção: Algumas reacções são naturalmente mais rapidamente do que outros. O número de espécies reagentes, o seu estado físico (as partículas que se formam sólidos mover-se muito mais lentamente do que aqueles de gases ou aqueles em solução ), a complexidade da reacção e de outros factores que podem influenciar grandemente a taxa de reacção.
- Temperatura : Normalmente, a realização de uma reacção a uma temperatura mais elevada, proporciona mais energia para o sistema e aumenta a velocidade de reacção, fazendo com que mais colisões entre partículas, tal como explicado pela teoria de colisão. No entanto, a principal razão por que ela aumenta a velocidade da reacção é mais que das partículas que colidem terá a necessária energia de activação resultante em colisões mais bem sucedidos (quando os laços são formados entre os reagentes). A influência da temperatura é descrita pela Equação de Arrhenius. Como uma regra geral, as taxas de reacção para muitas reacções duplas ou triplas para cada 10 graus Celsius aumento da temperatura, embora o efeito da temperatura pode ser muito maiores ou menores do que esta (na medida em que as taxas de reacção pode ser independente da temperatura ou diminuir com o aumento da temperatura!)
Por exemplo, queima de carvão numa lareira, na presença de oxigénio mas não quando é armazenado a temperatura ambiente. A reacção é espontânea a baixas e altas temperaturas, à temperatura ambiente, mas a sua taxa é tão lenta que é negligenciável. O aumento da temperatura, conforme criado por um fósforo, permite que a reacção começar e em seguida, aquece-se, porque é exotérmica. Isto é válido para diversos outros combustíveis, como o metano , butano, hidrogênio ...
- Solvente : Muitas reacções têm lugar em solução e as propriedades do solvente afecta a velocidade de reacção. O força iónica assim tem um efeito sobre a velocidade da reacção.
- Pressão: A taxa de reacções gasosas aumenta com a pressão, que é, de facto, o que equivale a um aumento da concentração do gás. Para as reacções de fase condensada, o dependendence pressão é fraca.
- Radiação eletromagnética : radiação eletromagnética é uma forma de energia por isso pode acelerar a taxa ou até mesmo fazer uma reação espontânea, uma vez que fornece as partículas dos reagentes com mais energia. Esta energia é, de uma forma ou de outra armazenada nas partículas que reagem (pode quebrar ligações, promover moléculas aos estados eletronicamente ou vibracionais excitados ...) a criação de espécies intermediárias que reagem facilmente.
Por exemplo, quando o metano reage com o cloro no escuro, a taxa de reacção é muito lenta. Ele pode ser acelerado quando o mistura é colocada sob luz difusa. Sob luz solar intensa, a reação é explosivo.
- Um catalisador : A presença de um catalisador aumenta a velocidade da reacção (tanto na frente e reverso reacções), fornecendo uma via alternativa com uma menor energia de activação .
Por exemplo, platina catalisa a combustão de hidrogénio com oxigénio à temperatura ambiente.
- Isótopos : A efeito isotópico cinético consiste em uma taxa de reacção diferentes para a mesma molécula se ele tem diferentes isótopos, geralmente hidrogénio isótopos, devido à diferença de massa entre o hidrogénio e deutério.
- Superfície: Em reações em superfícies, que ocorrem por exemplo, durante catálise heterogénea, a taxa de reacção aumenta à medida que a área de superfície faz. Isso é devido ao facto de que mais partículas do sólido são expostas e pode ser atingido por moléculas do reagente.
- Pedido: A fim de os controlos de reacção como a concentração de reagente afecta velocidade de reacção.
- A agitação: A agitação pode ter um forte efeito sobre a velocidade da reacção para reações heterogêneas.
Todos os factores que afectam a uma taxa de reacção são tomadas em conta na equação da velocidade da reacção.
Taxa Equação
Para obter uma reacção química n A + B m → C + D, a equação da velocidade ou lei de velocidade é uma expressão matemática utilizada na cinética química para conectar-se a taxa de reacção à concentração de cada reagente. É do tipo:
Nesta equação k (t) é o coeficiente de taxa ou velocidade de reacção constante, embora não seja realmente uma constante, pois inclui todos os parâmetros que afectam a velocidade de reacção, excepto para a concentração, que é expressamente tomado em consideração. De todos os parâmetros descritos antes, a temperatura é normalmente a mais importante.
Os expoentes n  e m
e m  são chamados de reacção ordens e dependem do Mecanismo de reacção. Eles são, por vezes, o mesmo que o coeficientes estequiométricas de A e B, mas não necessariamente.
são chamados de reacção ordens e dependem do Mecanismo de reacção. Eles são, por vezes, o mesmo que o coeficientes estequiométricas de A e B, mas não necessariamente.
A estequiometria, molecularidade (o número real de moléculas que colidem) e ordem de reação única coincidem necessariamente em reações elementares, ou seja, aquelas reações que ocorrem em apenas uma etapa. A equação de reação para reações elementares coincide com o processo a decorrer no nível atômico, ou seja, n moléculas do tipo A estão colidindo com moléculas m de tipo B (n além de m é a molecularidade).
Para gases a lei de velocidade também podem ser expressas em unidades de pressão usando por exemplo o lei do gás ideal.
Ao combinar a lei de velocidade com um balanço de massa para o sistema no qual ocorre a reacção, uma expressão para a taxa de variação em concentração pode ser derivada. Para um sistema fechado com volume constante tal expressão pode parecer
Dependência de temperatura
Cada coeficiente K velocidade de reacção tem uma dependência de temperatura, que é geralmente administrado pela Equação de Arrhenius:
E a é a energia de activação e R é a constante de gás. Uma vez que a temperatura T as moléculas têm energias dadas por um Distribuição de Boltzmann, pode-se esperar que o número de colisões com energia superior a E um ser proporcional ao 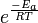 . Um é o factor de pré-exponencial ou fator de freqüência.
. Um é o factor de pré-exponencial ou fator de freqüência.
Os valores de A e E um são dependentes da reacção. Há também equações mais complexas possíveis, que descrevem a dependência de temperatura de outros constantes de velocidade que não seguem esse padrão.
Dependência de pressão
A dependência da pressão constante de velocidade para condensadas -fase reacções (ou seja, quando os reagentes e produtos são sólidos ou líquidos) é normalmente suffficiently fraco no intervalo de pressões normalmente encontrados na indústria que é negligenciado na prática.
A dependência da pressão da constante de velocidade está relacionado com o volume de activação. Para a reacção de prosseguir através de um complexo de ativação de estado:
o volume de ativação, 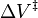 , É:
, É:
onde 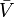 denotam os volumes parciais molares dos reagentes e produtos, e
denotam os volumes parciais molares dos reagentes e produtos, e 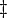 indica o complexo de ativação de estado.
indica o complexo de ativação de estado.
Para a reacção acima, pode-se esperar que a alteração da constante de velocidade de reacção (com base em moles ou fracção molar ou da concentração) com pressão a uma temperatura constante de ser:
Na prática, a matéria pode ser complicado porque os volumes parciais molares e o volume de activação próprios podem ser uma função da pressão.
As reacções podem aumentar ou diminuir as taxas de pressão, depeding no valor de 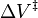 . Como um exemplo do possível magnitude do efeito de pressão, algumas reacções orgânicas foram mostrados para duplicar a velocidade de reacção quando a pressão foi aumentada de atomospheric (0,1 MPa) a 50 MPa (que dá
. Como um exemplo do possível magnitude do efeito de pressão, algumas reacções orgânicas foram mostrados para duplicar a velocidade de reacção quando a pressão foi aumentada de atomospheric (0,1 MPa) a 50 MPa (que dá 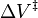 = -0,025 L / mol).
= -0,025 L / mol).
Exemplos
Para a reacção de
A equação da taxa é:
A equação de taxa não reflectir simplesmente os reagentes coeficientes estequiométricas na reacção global: ele é de primeira ordem em H 2, embora o coeficiente estequiométrico é 2 e é de segunda ordem em NO.
Em cinética química a reacção global é normalmente proposta para ocorrer através de uma série de passos elementares. Nem todos estes passos afectar a velocidade da reacção; normalmente é apenas o passo mais lento, que afetam a taxa de reation. Por exemplo, em:
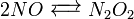 (Equilíbrio rápido)
(Equilíbrio rápido) 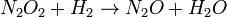 (Lento)
(Lento) 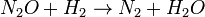 (Rápido)
(Rápido)
Reacções 1 e 3 são muito rápida em relação ao segundo, por isso, é a reacção mais lenta que se reflete na equação de velocidade. O passo lento é considerado o passo determinante da velocidade. As ordens da equação da taxa são aqueles da etapa determinante da velocidade.

![v = - \ frac {1} {a} \ frac {d [A]} {dt} = - \ frac {1} {b} \ frac {d [B]} {dt} = \ frac {1} { p} \ frac {d [P]} {dt} = \ frac {1} {q} \ frac {d [Q]} {dt}](../../images/163/16344.png)
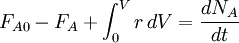
![\, R = k (t) [A] ^ {n '} [B] ^ m {'}](../../images/163/16350.png)
![\ Frac {d [C]} {dt} = k (T) [A] ^ {n '} [B] ^ {m'}](../../images/163/16352.png)
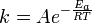
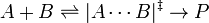
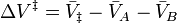
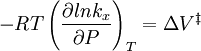
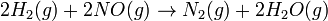
![r = k [H_2] ^ 1 [NO] ^ 2 \,](../../images/163/16362.png)
