Rutherfordium
Fundo para as escolas Wikipédia
Esta seleção Escolas foi originalmente escolhido pelo SOS Children para as escolas no mundo em desenvolvimento sem acesso à internet. Ele está disponível como um download intranet. Antes de decidir sobre o patrocínio de uma criança, por que não aprender sobre as diferentes instituições de caridade de patrocínio primeiro ?
| Rutherfordium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
104 Rf | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| desconhecido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | rutherfordium, RF, 104 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / ˌ r ʌ ð ər f ɔr d Eu ə m / Rûdh -ər- PARA -dee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | de metal de transição | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 4, 7, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | [267] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Rn ] 5f 14 6d 2 7s 2 2, 8, 18, 32, 32, 10, 2 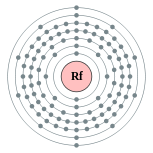 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Instituto Conjunto de Pesquisa Nuclear (1964) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido (prevista) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 23 (avaliado) · g cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 2400 K , 2100 ° C, 3800 (avaliado) ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 5800 K, de 5500 ° C, 9900 (avaliado) ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 4, 3 (prevista) (Estados de oxidação única em negrito são conhecidos experimentalmente) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 579,9 (estimado) kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segunda: 1389,4 (avaliado) kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 2.296,4 (estimado) kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 150 (avaliado) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 157 (avaliado) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 53850-36-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de rutherfordium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Rutherfordium é um elemento químico com o símbolo Rf e número atômico 104, nomeado em honra do neozelandês físico britânico Ernest Rutherford . É um elemento sintético (um elemento que pode ser criado num laboratório, mas não se encontra na natureza) e radioactivos; o mais estável conhecida isótopo , 267 Rf, tem uma meia-vida de aproximadamente 1,3 horas.
No tabela periódica dos elementos, é um elemento de bloco-d e o primeiro da elementos transactinide. Ele é um membro da 7a período que pertence à grupo 4 elementos. Experiências químicas confirmaram que rutherfordium comporta-se como o mais pesado homólogo de háfnio no grupo 4. As propriedades químicas de rutherfordium são caracterizados apenas parcialmente. Eles comparam bem com a química dos outros elementos do grupo 4, apesar de alguns cálculos indicaram que o elemento pode mostrar as propriedades significativamente diferentes, devido à efeitos relativísticos.
Na década de 1960, pequenas quantidades de rutherfordium foram produzidos nos laboratórios da ex- União Soviética e na Califórnia . A prioridade da descoberta e, por conseguinte, o nomeação do elemento foi disputada entre cientistas soviéticos e norte-americanos, e não foi até 1997 que União Internacional de Química Pura e Aplicada (IUPAC) estabeleceu rutherfordium como o nome oficial para o elemento.
História
Descoberta
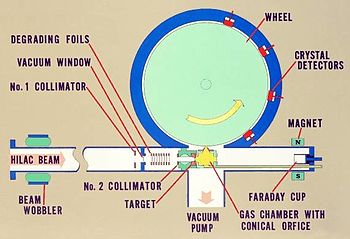
Rutherfordium era declaradamente detectado pela primeira vez em 1964 no Instituto Conjunto de Pesquisa Nuclear em Dubna (então na União Soviética ). Pesquisadores há bombardeado um plutónio -242 alvo com neon -22 íons e separou os produtos de reacção por thermochromatography gradiente após a conversão para cloretos pela interação com ZrCI4. A equipe identificou atividade fissão espontânea contido dentro de um cloreto volátil retratando propriedades eka-háfnio. Embora uma meia-vida não foi determinada com precisão, cálculos posteriores indicaram que o produto era mais provável rutherfórdio-259 (abreviado como 259 Rf em notação padrão ):
- 242
94 Pu + 22
10 Ne → 264- x
104 Rf → 264- x
104 Rf Cl 4
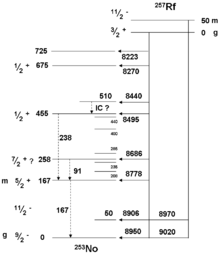
Em 1969, pesquisadores da University of California, Berkeley conclusivamente sintetizado o elemento bombardeando um califórnio -249 alvo com 12 carbono-iões e mediu o decaimento alfa de 257 Rf, correlacionada com a decadência filha de nobelium -253:
- 249
98 Cf + 12
6 C → 257
104 Rf + 4 n
A síntese americana foi confirmada independentemente em 1973 e fixada a identificação de rutherfórdio como o progenitor pela observação de K-alfa Raios-X na assinatura elementar do produto do decaimento 257 Rf, nobélio-253.
Naming controvérsia
Os cientistas russos propôs o nome kurchatovium e os cientistas americanos sugeriram a rutherfordium nome para o novo elemento. Em 1992, o IUPAC / Grupo de Trabalho Transfermium IUPAP (TWG) avaliou as reivindicações de descoberta e concluíram que ambas as equipes desde elemento de prova contemporâneo a síntese do elemento 104 e que o crédito deve ser compartilhada entre os dois grupos.
O grupo americano escreveu uma resposta contundente para as conclusões do grupo de trabalho técnico, afirmando que eles tinham dado muita ênfase sobre os resultados do grupo de Dubna. Em particular, apontou que o grupo russo tinha alterado os detalhes de suas reivindicações várias vezes ao longo de um período de 20 anos, um fato que a equipe russa não nega. Eles também ressaltaram que a TWG tinha dado muito crédito às experiências químicas realizadas pelos russos e acusou a TWG de não ter pessoal devidamente qualificado na comissão. A TWG respondeu dizendo que este não era o caso e tendo avaliado cada ponto levantado pelo grupo americano disse que eles não encontraram nenhuma razão para alterar a sua conclusão sobre a prioridade da descoberta. A IUPAC finalmente usou o nome sugerido pela equipe americana (rutherfordium) que pode de alguma forma refletem uma mudança de opinião.
Como consequência da inicial reivindicações de descoberta, um concorrente elemento nomeando controvérsia surgiu. Desde os soviéticos afirmaram ter detectado pela primeira vez o novo elemento que sugeriu o nome kurchatovium, Ku, em honra de Igor Kurchatov (1903-1960), ex-chefe da Pesquisa nuclear soviética. Este nome havia sido usado em livros da Bloco soviético como o nome oficial do elemento. O rutherfordium americanos, no entanto, proposto (Fr) para o novo elemento para honrar Ernest Rutherford , que é conhecido como o "pai" da física nuclear . A União Internacional de Química Pura e Aplicada ( IUPAC) adotou unnilquadium, UNQ, como temporário, nome de elemento sistemático, derivados dos nomes latinos para dígitos 1, 0 e 4. Em 1994, a IUPAC sugeriu o nome dubnium para ser usado desde rutherfordium foi sugerida para o elemento 106 e IUPAC senti que a equipe de Dubna deve ser corretamente reconhecidos por suas contribuições . No entanto, ainda havia uma disputa sobre os nomes dos elementos 104-107. Em 1997, as equipes envolvidas resolvido a disputa e adotou o nome atual rutherfordium. O nome dubnium foi dada para elemento 105 ao mesmo tempo.
Nucleosynthesis
Elementos super-pesados como rutherfordium são produzidos bombardeando elementos mais leves em aceleradores de partículas que induz reações de fusão. Considerando que a maior parte dos isótopos de rutherfordium pode ser sintetizado diretamente dessa maneira, alguns mais pesados foram observados apenas como produtos de decaimento de elementos com maiores números atómicos .
Consoante as energias envolvidas, os primeiros são separados em "quente" e "frio". Em reações de fusão quente, muito leves, projéteis de alta energia são acelerados em direção a metas muito pesados ( actinídeos ), dando origem a núcleos compostos em energia de alta excitação (~ 40-50 MeV) que podem ou fissão ou evaporar várias (3-5) nêutrons. Nas reações de fusão a frio, os núcleos fundidos produzidos têm uma relativamente baixa energia de excitação (~ 10-20 MeV), o que diminui a probabilidade de que estes produtos serão submetidos a reações de fissão. Como os núcleos fundidos arrefecer para a estado fundamental, que necessitam de emissão de apenas um ou dois neutrões, e, assim, permite a geração de mais produtos ricos em neutrões. O último é um conceito distinto do de fusão nuclear, onde reivindicado para ser alcançada em condições de temperatura ambiente (ver a fusão a frio).
Estudos de fusão quente
A síntese de rutherfordium foi tentada pela primeira vez em 1964 pela equipe em Dubna usando a reação de fusão a quente de néon -22 projéteis com plutónio -242 metas:
- 242
94 Pu + 22
10 Ne → 264-x
104 Rf + 3 ou 5 n .
O primeiro estudo produziu evidências de uma fissão espontânea com um 0,3 segundo meia-vida e outra em 8 segundos. Enquanto a primeira observação foi finalmente retraído, este último, eventualmente, tornou-se associado com o isótopo 259 Rf. Em 1966, a equipe soviética repetiu o experimento usando um estudo químico de produtos de cloreto de voláteis. Eles identificaram um cloreto volátil com propriedades eka-háfnio que cariados rápido através de fissão espontânea. Isto deu uma forte evidência para a formação de RFCL 4, e apesar de uma meia-vida não foi medida com precisão, provas posteriores sugeriram que o produto era mais provável 259 Rf. A equipe repetiu o experimento diversas vezes ao longo dos próximos anos, e em 1971, eles revisaram a fissão espontânea meia hora para o isótopo em 4.5 segundos.
Em 1969, pesquisadores da Universidade da Califórnia liderado por Albert Ghiorso, tentou confirmar os resultados originais relatados em Dubna. Em uma reação de cúrio -248 com oxigênio-16, eles foram incapazes de confirmar o resultado da equipe soviética, mas conseguiu observar a fissão espontânea de 260 Rf com uma meia-vida muito curta de 10-30 ms:
- 248
96 Cm + 16
8 O → 260
104 Rf + 4 n .
Em 1970, a equipe americana também estudou a mesma reação com oxigénio-18 261 Rf e identificada com uma meia-vida de 65 segundo (posteriormente refinada a 75 segundos). Experiências posteriores na Lawrence Berkeley National Laboratory, na Califórnia também revelou a formação de um isómero de curta duração de 262 Rf (que sofre fissão espontânea com uma meia-vida de 47 ms), e as actividades de fissão espontânea com longos períodos de tentativamente atribuído a 263 Rf.
A reação de califórnio com -249 carbono-13 também foi investigada pela equipe Ghiorso, o que indica a formação da vida curta 258 Rf (que sofre fissão espontânea em 11 ms):
- 249
98 Cf + 13
6 C → 258
104 Rf + 4 n .
Na tentativa de confirmar estes resultados através da utilização carbono-12 em vez disso, eles também observaram o primeiro alfa decai a partir de 257 Rf.
A reacção de berkélio -249 com azoto -14 foi estudada pela primeira vez em Dubna em 1977 e em 1985, os investigadores não confirmaram a formação do 260 Rf isótopo que sofre rapidamente fissão espontânea em 28 ms:
- 249
97 Bk + 14
7 260 N →
104 Rf + 3 n .
Em 1996, o isótopo 262 Rf foi observada em LBNL a partir da fusão de plutônio-244 com neon-22:
- 244
94 Pu + 22
10 Ne → 266-x
104 Rf + 4 ou 5 n .
A equipe determinou uma meia-vida de 2,1 segundos e, em contraste com relatos anteriores de 47 ms e sugeriu que as duas meias-vidas poderiam ser devido a diferentes estados isoméricos de 262 Rf. Estudos sobre a mesma reacção por uma equipe em Dubna, levar à observação, em 2000, de alfa decai a partir de 261 Rf e fissões espontâneas de 261m Rf.
A reação de fusão a quente utilizando um alvo urânio foi relatada pela primeira vez em Dubna em 2000:
- 238
92 L + 26
12 mg → 264-x
104 Rf x + n (x = 3, 4, 5, 6).
Eles observaram decaimentos de 260 Rf e Rf 259, e mais tarde para 259 Rf. Em 2006, como parte de seu programa sobre o estudo de alvos de urânio em reações de fusão quente, a equipe da LBNL também observaram 261 Rf.
Estudos de fusão a frio
As primeiras experiências de fusão a frio envolvendo elemento 104 foram feitos em 1974 em Dubna, usando luz titânio-50 núcleos que visam alvos de isótopos de chumbo-208:
- 208
82 Pb + 50
22 Ti → 258-x
104 Rf x + n (x = 1, 2, ou 3).
A medição de uma actividade de fissão espontânea foi atribuído a 256 Rf, enquanto estudos posteriores feito no Gesellschaft für Instituto Schwerionenforschung (GSI), também mediu as propriedades de decaimento de isótopos 257 RF e 255 de RF.
Em 1974 pesquisadores em Dubna investigou a reação de levar-207 com titânio-50 para produzir o isótopo 255 Rf. Em um estudo de 1994, GSI utilizando o isótopo de chumbo-206, 255 Rf, bem como 254 Rf foram detectados. 253 Rf foi igualmente detectada naquele ano quando chumbo-204 foi utilizado em seu lugar.
Estudos de decaimento
A maioria dos isótopos com uma massa atômica abaixo 262 também observaram como produtos de decaimento de elementos com um maior número atômico , permitindo refinamento de suas propriedades previamente medidos. Isótopos mais pesados de rutherfordium só foram observados como produtos de decaimento. Por exemplo, alguns eventos de decaimento alfa terminando em 267 Rf foram observadas na cadeia de decaimento do darmstadtium -279 desde 2004:
- 279
110 Ds → 275
108 Hs + α → 271
106 Sg + α → 267
104 Rf + α.
Este sofreu uma nova fissão espontânea com uma meia-vida de cerca de 1,3 h.
As investigações sobre a síntese do dubnium -263 isótopo em 1999 na Universidade de Berna revelou acontecimentos consistentes com captura de elétrons para formar 263 Rf. Uma fracção rutherfórdio foi separada, e foram observados vários eventos de fissão espontânea, com longos tempos de vida de cerca de 15 minutos, bem como alfa e decai com o tempo de vida de cerca de 10 minutos. Relatórios sobre a cadeia de decaimento de fleróvio -285 em 2010 mostrou cinco alfa seqüencial decai que terminam em 265 Rf, que sofre ainda mais fissão espontânea, com um tempo de vida de 152 segundos.
Algumas evidências experimentais foi obtida em 2004 por um isótopo ainda mais pesado, 268 Rf, na cadeia de decaimento de um isótopo de ununpentium :
- 288
115 UUP → 284
113 Uut + α → 280
111 Rg + α → 276
109 Mt + α → 272
107 Bh + α → 268
105 Db + α? → 268
104 Rf + ν
e.
No entanto, a última etapa desta cadeia era incerto. Depois de observar os acontecimentos cinco alfa decaimento que geram dubnium -268, eventos fissão espontânea foram observados com um longo intervalo. Não está claro se esses eventos foram devido a dirigir fissão espontânea de 268 Db, ou 268 Db produzido eventos de captura de elétrons com longas meias-vidas para gerar 268 Rf. Se o último é produzido e decai com um tempo de vida curto, as duas possibilidades não podem ser distinguidos. Dado que o captura de electrões de 268 Db não pode ser detectado, estes eventos de fissão espontânea pode ser devido a Rf 268, caso em que a semi-vida deste isótopo não pode ser extraída.
De acordo com um relatório de 2007, sobre a síntese de unúntrio , o isótopo 282 113 Observou-se submeter a uma degradação semelhante para formar 266 dB, o que sofre fissão espontânea com uma meia-vida de 22 minutos. Dado que a captura de electrões de 266 Db não podem ser detectados, estes eventos de fissão espontânea pode ser devido a Rf 266, caso em que a meia-vida do isótopo este não pode ser extraída.
Isótopos
| Isótopo | Meia-vida | Decadência modo | Descoberta ano | Reação |
|---|---|---|---|---|
| 253 Rf | 48 mS | α, SF | 1994 | 204 Pb (50 Ti, n) |
| 254 Rf | 23 mS | SF | 1994 | 206 Pb (Ti 50, 2n) |
| 255 Rf | 2,3 | ε ?, α, SF | 1974 | 207 Pb (Ti 50, 2n) |
| 256 Rf | 6,4 ms | α, SF | 1974 | 208 Pb (Ti 50, 2n) |
| 257 Rf | 4,7 | ε, α, SF | 1969 | 249 Cf (12 C, 4n) |
| 257m Rf | 4,1 | ε, α, SF | 1969 | 249 Cf (12 C, 4n) |
| 258 Rf | 14,7 ms | α, SF | 1969 | 249 Cf (13 C, 4n) |
| 259 Rf | 3,2 | α, SF | 1969 | 249 Cf (13 C, 3n) |
| 259m Rf | 2,5 | ε | 1969 | 249 Cf (13 C, 3n) |
| 260 Rf | 21 | α, SF | 1969 | 248 cm (16 Ó, 4n) |
| 261 Rf | 78 s | α, SF | 1970 | 248 cm (18 O, 5N) |
| 261m Rf | 4 | ε, α, SF | 2001 | 244 Pu (22 Ne, 5N) |
| 262 Rf | 2,3 | α, SF | 1996 | 244 Pu (22 Ne, 4n) |
| 263 Rf | 15 min | α, SF | 1999 | 263 dB ( e - , ν e) |
| 263m Rf? | 8 | α, SF | 1999 | 263 dB ( e - , ν e) |
| 264 Rf | 1? h | α? | desconhecido | - |
| 265 Rf | 2,5 min | SF | 2010 | 269 Sg (-, α) |
| 266 Rf | 10 h? | α, SF? | 2007? | 266 dB ( e - , ν e)? |
| 267 Rf | 1,3 h | SF | 2004 | 271 Sg (-, α) |
| 268 Rf | 6 h? | α, SF? | 2004? | 268 dB ( e - , ν e)? |
Rutherfordium não tem isótopos estáveis ou que ocorrem naturalmente. Vários isótopos radioactivos foram sintetizados no laboratório, ou pela fusão de dois átomos ou através da observação da deterioração dos elementos mais pesados. Quinze isótopos diferentes foram relatados com massas atômicas 253-268 (com excepção de 264). A maioria destes decair predominantemente através de vias fissão espontânea.
Vida vezes
Os isótopos mais leves geralmente têm mais curtas meias-vidas; meia-vida de menos de 50 mS foram observados para 253 Rf e Rf. 254 256 Rf, Rf 258, 260 Rf são mais estáveis em cerca de 10 ms, 255 Rf, Rf 257, 259 Rf, e 262 Rf vivo entre 1 e 5 segundos e Rf 261, 265 Rf, e 263 Rf são mais estáveis, em torno de 1, 1,5, e 10 min, respectivamente. Os isótopos mais pesados são as mais estáveis, com 267 Rf tendo uma meia-vida medida de cerca de 1,3 h.
Os isótopos mais leves foram sintetizados por fusão direta entre dois núcleos mais leves e, como produtos de decaimento. O isótopo mais pesado produzido pela fusão directa é de 262 Rf; isótopos mais pesados foram observados apenas como produtos de decaimento de elementos com números atômicos maiores, dos quais apenas 267 Rf foi confirmada. Isótopos 266 e 268 Rf Rf podem também ter sido observado como produtos de decaimento e são pensados para ter longas meias-vidas de 10 h e 6 h, respectivamente, mas estes foram medidos indiretamente, por meio de estudos sistemáticos. Enquanto o isótopo 264 Rf ainda tem de ser observada, prevê-se ter uma semi-vida longo de 1 h. Antes da sua descoberta, 265 Rf foi previsto para que este tenha uma maior meia-vida de 13 h, mas que tem uma meia-vida de apenas 2,5 min.
Em 1999, cientistas americanos da Universidade da Califórnia, em Berkeley, anunciaram que tinham conseguido sintetizar três átomos de 293 118. Estes núcleos pais foram relatados para ter emitido sucessivamente sete partículas alfa para formar 265 núcleos de Rf, mas o seu pedido foi recolhido em 2001.
Isomeria nuclear
Vários estudos iniciais sobre a síntese de 263 Rf indicaram que este nuclídeo decai principalmente por fissão espontânea com uma meia-vida de 10-20 minutos. Mais recentemente, um estudo de hassium isótopos permitiu a síntese de átomos de Rf em decomposição 263 com uma meia-vida mais curto de 8 segundo. Estes dois modos diferentes de decaimento deve ser associado a dois estados isom�icas, mas atribuições específicas são difíceis devido ao baixo número de eventos observados.
Durante a investigação sobre a síntese de isótopos rutherfordium utilizando o Pu 244 (22 Ne, 5n) 261 Rf reacção, o produto foi encontrado para submeter exclusiva alf a 8,28 MeV decaimento, com uma meia-vida de 78 segundos. Estudos posteriores na GSI sobre a síntese de Copernicium e hassium isótopos produzidos dados conflitantes, como 261 Rf produzida na cadeia de decaimento foi encontrada a sofrer decaimento 8,52 MeV alfa com uma semi-vida de 4 segundos. Resultados posteriores indicaram uma filial fissão predominante. Essas contradições levou a algumas dúvidas sobre a descoberta de copernicium. O primeiro isómero é actualmente indicado 261a Rf (ou simplesmente Rf 261) enquanto que o segundo é designado 261b Rf (Rf ou 261m). No entanto, pensa-se que o primeiro núcleo pertence a um estado de terra de alta rotação e o último a um estado metaestável de baixa rotação. A descoberta e confirmação de 261b Rf fornecida prova para a descoberta de copernicium em 1996.
Um estudo espectroscópica detalhada da produção de núcleos 257 Rf utilizando a reacção de 208 Pb (50 Ti, n) 257 Rf permitiu a identificação de um nível isomérica em 257 Rf. O trabalho confirmou que 257g Rf tem um espectro complexo com 15 linhas alfa. Um diagrama de estrutura de nível foi calculado para ambos os isômeros. Isômeros semelhantes foram relatados por 256 Rf também.
Propriedades previstas
Químico
Rutherfórdio é o primeiro transactinide elemento e o segundo membro da série de metais de transição 6d. Os cálculos relativos a sua potenciais de ionização, raio atómico, bem como raios, energias orbitais, e níveis de solo dos seus estados ionizados são semelhantes à de háfnio e muito diferente da de chumbo . Por conseguinte, concluiu-se que as propriedades básicas do rutherfordium vai se assemelham aos de outros grupo 4, abaixo elementos titânio , zircónio , háfnio e. Algumas das suas propriedades foram determinadas por experiências em fase gasosa e química aquosa. O estado de oxidação +4 é o único estado estável durante os dois últimos elementos e, portanto, rutherfordium também deve apresentar um 4 estado estável. Além disso, rutherfórdio também deverá ser capaz de formar um estado menos 3 estável.
As propriedades químicas de rutherfordium foram baseadas em cálculos que indicavam que os efeitos relativísticos sobre o escudo do elétron pode ser forte o suficiente para que o orbitais p têm um nível de energia inferior ao orbitais d, dando-lhe uma valência configuração eletrônica de 6d 1 7s 2 7P 1 ou até mesmo 7s 2 7P 2, portanto, tornando o elemento se comportar mais como liderança de háfnio. Com melhores métodos de cálculo e de estudos das propriedades químicas dos compostos rutherfordium poderia ser mostrado que rutherfórdio se comporta de acordo com o resto da grupo 4 elementos.
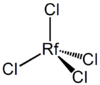
De um modo análogo ao zircónio e háfnio, rutherfórdio é projectada para formar um, óxido de alta ponto de fusão muito estável, ORP 2. Ele reage com halogéneos para formar tetra-RFX, 4, que se hidrolisam por contacto com a água para formar oxi-halogenetos RfOX 2. Os tetra-halogenetos são sólidos voláteis existentes como moléculas tetraédricas monoméricas em fase de vapor.
Na fase aquosa, o ião de Rf 4+ hidrolisa menos de titânio (IV) e para um grau semelhante como zircónio e háfnio, resultando assim no ião ORP 2+. O tratamento dos halogenetos com iões halogeneto promove a formação de iões complexos. A utilização de iões cloreto e brometo produz os complexos hexahalide RFCL 2-
6 e RfBr 2-
6. Para os complexos de flúor, zircónio e háfnio tendem a formar complexos de hepta- e octa. Assim, para a maior ião rutherfórdio, os complexos RFF 2-
6, RFF 2-
7 e RFF 4-
8 são possíveis.
Física e atômica
Rutherfórdio se espera que seja um sólido em condições normais. Deve ser um metal muito pesado com uma densidade de cerca de 23 g / cm 3; Em comparação, o elemento mais denso conhecido que teve a sua densidade medida, ósmio , tem uma densidade de 22,61 g / cm3. Isto resulta do elevado peso atômico do rutherfordium, o lantanídeos e actinídeos contrações, e os efeitos relativísticos, embora a produção de rutherfordium suficiente para medir essa quantidade seria impraticável, ea amostra seria rapidamente decair. O raio atômico para rutherfordium é esperado para ser em torno de 150 pm. Devido à estabilização relativista dos 7s orbitais e de desestabilização da 6d orbital, os íons RF + 2 + e RF estão previstas para desistir de elétrons em vez de 7s 6d elétrons, que é o oposto do comportamento dos seus homólogos mais leves.
Química experimental
| Fórmula | Nomes |
|---|---|
| RFCL 4 | tetracloreto de rutherfordium, rutherfordium (IV) cloreto |
| RfBr 4 | tetrabrometo rutherfordium, rutherfordium (IV) brometo |
| RfOCl 2 | oxicloreto rutherfórdio, rutherfordyl (IV), cloreto de rutherfórdio (IV) dicloreto |
| [RFCL 6] 2- | hexachlororutherfordate (IV) |
| [RFF 6] 2- | hexafluororutherfordate (IV) |
| K 2 [RFCL 6] | hexachlororutherfordate de potássio (IV) |
Fase Gasosa
Os primeiros trabalhos sobre o estudo da química de rutherfórdio focada em thermochromatography gás e de medição de temperatura de deposição relativa curvas de adsorção. O trabalho inicial foi realizado em Dubna, na tentativa de reafirmar a sua descoberta do elemento. Um trabalho recente é mais fiável sobre a identificação dos radioisótopos rutherfordium pai. O isótopo 261m Rf foi utilizado para estes estudos. Os experimentos contou com a expectativa de que rutherfordium começaria a nova série 6d de elementos e, portanto, devem formar uma tetracloreto volátil devido à natureza tetraédrica da molécula. Rutherfórdio (IV) cloreto é mais volátil do que o seu homólogo mais leve háfnio (IV) cloreto (HfCl4) porque os seus laços são mais covalente.
Uma série de experiências confirmou que rutherfórdio comporta-se como um membro típico do grupo 4, formando um cloreto tetravalente (RFCL 4) e brometo de (RfBr 4), bem como um oxicloreto (RfOCl 2). A volatilidade diminuiu foi observado para RFCL 4 quando cloreto de potássio é fornecida como a fase sólida, em vez de gás, altamente indicativo da formação de não volátil K 2 6 RFCL sal misto.
Fase Aquosa
Rutherfórdio espera-se ter a configuração de electrões [n] 5f 14 6d 7s 2 2 e, por conseguinte, se comportam como o homólogo mais pesado de háfnio no grupo 4 da tabela periódica. Deve, por conseguinte, formam prontamente uma hidratado Rf 4+ de iões em solução de ácido forte e devem formar facilmente complexos em ácido clorídrico , ou bromídrico As soluções de ácido fluorídrico.
Os estudos de química aquosas mais conclusivos de rutherfordium foram realizados pela equipe japonesa em Japão Atomic Instituto de Pesquisas Energéticas usando o radioisótopo 261m Rf. Experimentos de extração de soluções de ácido clorídrico, usando isótopos de rutherfordium, háfnio, zircónio e tório revelaram-se um comportamento não-actinide para rutherfordium. Uma comparação com os seus homólogos mais leves rutherfórdio colocado firmemente no grupo 4 e indicaram a formação de um complexo hexachlororutherfordate em soluções de cloreto, de um modo semelhante ao háfnio e zircónio.
- 261m Rf 4+ + 6 Cl - → [261m RFCL 6] 2-
Muito resultados semelhantes foram observados em soluções de ácido fluorídrico. As diferenças nas curvas de extracção foram interpretados como uma afinidade mais fraca para o ião de fluoreto e a formação do ião hexafluororutherfordate, enquanto que os iões de zircónio e háfnio sete ou oito iões complexos de fluoreto nas concentrações usadas:
- 261m Rf 4+ + 6 F - → [261m RFF 6] 2-