
O sulfato de sódio
Sobre este escolas selecção Wikipedia
Este conteúdo da Wikipedia foi escolhida pela SOS Children para adequação nas escolas de todo o mundo. SOS mães cada um cuidar de uma família de crianças apadrinhadas .
| O sulfato de sódio | |
|---|---|
 |  |
Outros nomes Thenardite (mineral) | |
| Identificadores | |
| Número CAS | 7757-82-6 7727-73-3 (forma deca-hidratada) |
| PubChem | 24436 |
| ChemSpider | 22844 |
| UNII | 36KCS0R750 |
| Chebi | Chebi: 32149 |
| ChEMBL | CHEMBL233406 |
| Número RTECS | WE1650000 |
| Código ATC | A06 A12 CA02 |
| Imagens-jmol 3D | Imagem 1 |
SMILES
| |
InChI
| |
| Propriedades | |
| Fórmula molecular | Na 2 SO 4 |
| Massa molar | 142,04 g / mol (anidro) 322,20 g / mol (deca-hidratado) |
| Aparência | sólido cristalino branco higroscópico |
| Odor | inodoro |
| Densidade | 2,664 g / cm3 (anidro) 1,464 g / cm3 (deca-hidrato) |
| Ponto de fusão | 884 ° C (anidro) |
| Ponto de ebulição | 1429 ° C (anidro) |
| Solubilidade em água | anidro: 4,76 g / 100 mL (0 ° C) 42,7 g / 100 mL (100 ° C) hepta: 19,5 g / 100 mL (0 ° C) 44 g / 100 ml (20 ° C) |
| Solubilidade | insolúvel em etanol solúvel em glicerol e iodeto de hidrogénio |
| Índice de refracção (n D) | 1.468 (anidro) 1.394 (deca-hidratado) |
| Estrutura | |
| A estrutura de cristal | orthorhombic ou hexagonal (anidro) monoclinic (deca-hidratado) |
| Perigos | |
| MSDS | MSDS External |
| Índice da UE | Não listado |
| Principal Perigos | Irritante |
| NFPA 704 |  0 1 0 |
| Ponto de centelha | Não inflamável |
| Os compostos relacionados | |
| Outros aniões | Selenato de sódio Telurato de sódio |
| Outros cátions | Sulfato de lítio Sulfato de potássio Sulfato de rubídio Sulfato de césio |
| Os compostos relacionados | Bissulfato de sódio O sulfito de sódio Persulfato de sódio |
| Página Suplementar dados | |
| Estrutura e Propriedades | N, ε r, etc. |
| Termodinâmica dados | Comportamento de fase Sólido, líquido, gasoso |
| Os dados espectrais | UV, IV, RMN , MS |
Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
O sulfato de sódio é o de sódio sal de ácido sulfúrico . Quando anidro, que é um sólido de fórmula Na 2 SO 4 cristalino branco conhecido como o mineral thenardite; o decahidrato Na 2 SO 4 · 10H 2 O tem sido conhecido como sal de Glauber ou, historicamente, mirabilis sal desde o século 17. Um outro sólido é o hepta-hidrato, que transforma a mirabilite quando arrefecida. Com uma produção anual de 6 milhões toneladas, é um importante produto químico commodity.
O sulfato de sódio é utilizado principalmente para o fabrico de detergentes e no Processo Kraft de papel polpação. Cerca de dois terços da produção mundial é de mirabilite, o natural mineral a forma de deca-hidrato, e o restante a partir de subprodutos de processos químicos tais como ácido clorídrico produção.
História
O hidrato de sulfato de sódio é conhecido como sal de Glauber, após o holandês / alemão químico e boticário Johann Rudolf Glauber (1604-1670), que a descobriu em 1625 em água de nascente austríaca. Ele a chamou de mirabilis sal (sal milagrosa), por causa de suas propriedades medicinais: os cristais foram usados como um propósito geral laxante, alternativas até mais sofisticados surgiu na década de 1900.
No século 18, o sal de Glauber começou a ser utilizado como uma matéria-prima para o produção industrial de carbonato de sódio ( carbonato de sódio), por reacção com cloreto de potássio ( carbonato de potássio). A demanda por carbonato de sódio aumentou e fornecimento de sulfato de sódio teve a aumentar em linha. Portanto, no século XIX, o grande escala Processo Leblanc, produzindo sulfato de sódio sintético como um intermediário chave, tornou-se o principal método de produção de carbonato de sódio.
Propriedades físicas e químicas
O sulfato de sódio é quimicamente muito estável, sendo não reactivo para mais oxidantes ou agentes de redução, a temperaturas normais. A temperaturas elevadas, ele pode ser convertido para sulfureto de sódio por redução carbotérmica:
- Na 2 SO 4 + 2 C → Na 2 S + 2 CO 2
Ácido-base
O sulfato de sódio é um neutro sal, que forma soluções aquosas com um pH de 7. A neutralidade de tais soluções reflecte o facto de que o sulfato é derivado, formalmente, a partir do ácido forte de ácido sulfúrico . Além disso, o ião Na +, com somente uma única carga positiva, apenas fracamente polariza os seus ligandos de água. O sulfato de sódio reage com o ácido sulfúrico para se obter o sal do ácido bissulfato de sódio:
- Na 2 SO 4 + H 2 SO 4 2 ⇌ NaHSO4
O constante de equilíbrio para este processo depende concentração e temperatura.
Solução e de troca iônica
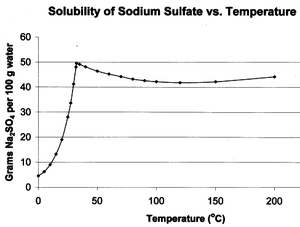
Sulfato de sódio tem características de solubilidade em água incomuns. A sua solubilidade em água sobe mais do que dez vezes entre 0 ° C e 32,384 ° C, onde se atinge um máximo de 497 g / L. Neste ponto, a curva de solubilidade muda declive, e a solubilidade torna-se praticamente independente da temperatura. Esta temperatura a 32,384 ° C, o que corresponde à libertação da água de cristalização e fusão do sal hidratado, serve como uma referência de temperatura precisas para termómetro calibração.
O sulfato de sódio é um típico iônica sulfato, contendo íons Na + e SO 4 2- íons. A existência de sulfato na solução é indicada pela formação de sulfatos insolúveis fácil quando estas soluções são tratadas com Ba2 + ou Pb 2+ sais:
- Na 2 SO 4 + BaCl2 → 2 NaCl + BaSO4
O sulfato de sódio exibe uma tendência para formar moderada sais duplos. A única alumes formados com metais trivalentes são comuns NaAl (SO4) 2 (instáveis acima de 39 ° C) e NACR (SO 4) 2, em contraste com sulfato de potássio e sulfato de amónio que formam muitos alumes estáveis. Sais duplos com alguns outros sulfatos de metal alcalino são conhecidos, incluindo Na 2 SO 4 · 3K 2 SO 4 que ocorre naturalmente como o mineral glaserite. Formação de glaserite por reacção de sulfato de sódio com cloreto de potássio foi usado como a base de um método para a produção sulfato de potássio, um fertilizante . Outros sais duplos incluem 3Na 2 SO 4 · CaSO4, 3Na 2 SO 4 · MgSO4 ( vanthoffite) e NaF · Na 2 SO 4.
Estrutura
Cristais consistem em [Na (OH 2) 6] + com os iões geometria molecular octaédrico, como visto por muitos sais de sulfato metálico. Estes catiões são ligadas aos aniões sulfato através ligações de hidrogênio. As distâncias Na-S são 240 pm. Duas moléculas de água por unidade de fórmula não são coordenados de Na +. Cristalina decahidrato sulfato de sódio também é incomum entre os sais hidratados em ter um mensurável entropia residual (entropia no zero absoluto ) de 6,32 J · K -1 · mol -1. Isto é atribuído à sua capacidade para distribuir a água muito mais rapidamente em comparação com a maioria dos hidratos.
Produção
A produção mundial de sulfato de sódio, principalmente sob a forma de deca-hidrato do ascende a cerca de 5,5-6.000.000 toneladas por ano (Mt / A). Em 1985, a produção foi de 4,5 Mt / a, metade de fontes naturais, e metade da produção química. Depois de 2000, a um nível estável até 2006, a produção natural tinha aumentado para 4 Mt / um, e produção de substâncias químicas diminuiu para 1,5 a 2 Mt / a, com um total de 5,5 a 6 Mt / a. Para todas as aplicações, produzida naturalmente e sulfato de sódio produzidos quimicamente são praticamente intercambiáveis.
Indústria química
Cerca de um terço de sulfato de sódio o mundo é produzido como subproduto de outros processos na indústria química. A maior parte desta produção é quimicamente inerente ao processo primário, e apenas marginalmente económicas. Pelo esforço da indústria, portanto, a produção de sulfato de sódio como subproduto está em declínio.
O mais importante de produção de sulfato de sódio durante química é ácido clorídrico a produção, quer a partir de cloreto de sódio (sal) e ácido sulfúrico , no Processo de Mannheim, ou a partir de dióxido de enxofre no Processo de Hargreaves. O sulfato de sódio resultante destes processos são conhecidos como bolo de sal.
- Mannheim: 2 NaCl + H 2 SO 4 → 2 HCl + Na 2 SO 4
- Hargreaves: NaCl 4 + 2 SO2 + O2 + 2 H2O → 4 HCl + 2 Na 2 SO 4
A segunda maior produção de sulfato de sódio são os processos em que o ácido sulfúrico é excedente neutralizada por hidróxido de sódio , tal como aplicado em larga escala na produção de rayon. Este método é também uma preparação laboratorial regularmente aplicada e conveniente.
- 2 (NaOH aq) + H 2 SO 4 (aq) → Na 2 SO 4 (aq) + 2H 2 O ( l )
No laboratório, ele também pode ser sintetizado a partir da reacção entre de bicarbonato de sódio e sulfato de magnésio.
- 2NaHCO 3 + MgSO4 → Na 2 SO 4 + Mg (OH) 2 + 2CO 2
Anteriormente, sulfato de sódio também foi um subproduto do fabrico de dicromato de sódio, em que o ácido sulfúrico é adicionado a solução de cromato de sódio formando o dicromato de sódio, ou ácido crómico posteriormente. Alternativamente, o sulfato de sódio é ou foi formado na produção de carbonato de lítio, agentes quelantes, resorcinol, ácido ascórbico, sílica pigmentos, ácido nítrico , e fenol .
Massa de sulfato de sódio é normalmente purificado via a forma deca-hidrato, desde que a forma anidra tende a atrair ferro compostos e compostos orgânicos . A forma anidra é facilmente produzido a partir da forma hidratada por aquecimento suave.
Sulfato de sódio importante subproduto produtores de 50-80 Mt / a em 2006 incluem Elementis Chromium (indústria cromo, Castelo Hayne, NC, EUA), a Lenzing AG (200 Mt / a, indústria rayon, Lenzing, Áustria), Addiseo (ex- Rhodia, indústria metionina, Les Roches-Roussillon, França), Elementis (indústria cromo, Stockton-on-Tees, Reino Unido), Shikoku Chemicals (Tokushima, Japão) e visko-R (indústria rayon, Rússia).
Aplicações
Indústrias de commodities
Com US fixando o preço em US $ 30 por tonelada em 1970, em 2006 até US $ 90 por tonelada para a qualidade do bolo de sal e US $ 130 para notas melhores, sulfato de sódio é um material muito barato. O uso maior é como carga em casa lavanderia em pó detergentes, consumindo aprox. 50% da produção mundial. Este uso está diminuindo como os consumidores domésticos estão cada vez mais migrando para compactar ou detergentes líquidos que não incluem o sulfato de sódio.
Outro ex-major utilização de sulfato de sódio, nomeadamente os EUA eo Canadá, está no Processo de Kraft para a produção de polpa de madeira. Organics presentes no "licor negro" deste processo são queimados para produzir calor, necessária para accionar a redução de sulfato de sódio para sulfeto de sódio. No entanto, este processo está a ser substituído por processos mais recentes; uso de sulfato de sódio em os EUA ea indústria de celulose canadense diminuiu de 1,4 Mt / a em 1970 para apenas aprox. 150 mil toneladas em 2006.
O vidro indústria fornece outra aplicação significativa para o sulfato de sódio, como a segunda maior aplicação na Europa. O sulfato de sódio é utilizado como um clarificante, para ajudar a remover pequenas bolhas de ar a partir de vidro fundido. É fundentes do vidro, e previne a formação de espuma da massa fundida de vidro durante a refinação. A indústria do vidro na Europa tem sido consumir 1970-2006 um estábulo 110 mil toneladas anuais.
O sulfato de sódio é importante no fabrico de têxteis , particularmente no Japão, onde é maior a pedido. Sulfato de sódio ajuda na "nivelamento", reduzindo cargas negativas em fibras de modo que os corantes podem penetrar uniformemente. Ao contrário da alternativa de cloreto de sódio , não corroa o recipientes de aço inoxidável usado no tingimento. Esta aplicação no Japão e US consumido em 2006 cerca de 100 mil toneladas.
Armazenagem térmica
A alta capacidade de armazenamento de calor na mudança de fase do estado sólido para líquido, e a temperatura de mudança de fase vantajosa de 32 ° C (90 ° F), faz com que este material especialmente apropriado para armazenar o calor solar de baixa qualidade para libertação posterior em aplicações de aquecimento de espaços. Em algumas aplicações, o material é incorporado em ladrilhos térmicos que são colocados em um espaço de sótão, enquanto em outras aplicações, o sal é incorporado nas células rodeadas por água aquecida pelo sol. A mudança de fase permite uma redução substancial da massa de material necessário para o armazenamento de calor eficaz (o calor de fusão de sulfato de sódio deca-hidratado é de 25,53 kJ / mol, ou cerca de 19 cal / g), com a vantagem adicional de consistência de uma temperatura tão como material de suficiente tempo na fase apropriada é disponível.
Aplicações em pequena escala
No laboratório, sulfato anidro de sódio é amplamente usado como um inerte agente de secagem, para remover vestígios de água a partir de soluções orgânicas. É mais eficiente, mas mais lento de acção, do que o agente semelhante sulfato de magnésio. Ela só é eficaz inferior a cerca de 30 ° C, mas pode ser usado com uma variedade de materiais desde que seja quimicamente inerte relativamente. O sulfato de sódio é adicionado à solução até que os cristais não se aglutinarem; os dois clipes de vídeo (veja acima) demonstram como os cristais se aglutinam quando ainda molhado, mas alguns cristais fluir livremente uma vez que uma amostra é seca.
Sal de Glauber, o deca-hidratado, foi usado historicamente como um laxante. É eficaz para a remoção de certas drogas, tais como acetaminofeno a partir do corpo, por exemplo, depois de uma dose excessiva.
Em 1953, o sulfato de sódio foi proposto para o calor de armazenamento em passiva sistemas de aquecimento solar. Isso leva vantagem de suas propriedades de solubilidade pouco usuais, eo calor elevado de cristalização (78,2 kJ / mol).
Outros usos para sulfato de sódio incluem De-gear janelas, em purificadores de tapete, fabrico de amido, e, como um aditivo para alimentos para o gado.
Ultimamente, sulfato de sódio foi encontrado eficaz na dissolução de ouro micrometre muito finamente galvanizado que é encontrada em hardware electroplated ouro em produtos eletrônicos, tais como pins e outros conectores e switches. É mais seguro e mais barato do que os outros reagentes utilizados para recuperação de ouro, com pouca preocupação com reações adversas ou efeitos na saúde.
Pelo menos uma empresa, a Thermaltake, faz uma esteira computador laptop frio (iXoft Notebook Cooler) usando sulfato de sódio deca-hidratado dentro de um bloco de plástico acolchoado. O material se transforma lentamente para recircula líquido e, igualando a temperatura laptop e agindo como um isolamento.
Segurança
Embora o sulfato de sódio é geralmente considerado como não tóxico, que deve ser manuseado com cuidado. A poeira pode causar asma temporária ou irritação ocular; este risco pode ser prevenida através da protecção do olho e uma máscara de papel. Transporte não é limitado, e nenhum Frase de risco ou Frase de segurança aplicáveis.

