Solubilidade
Você sabia ...
Esta seleção wikipedia foi escolhido por voluntários que ajudam Crianças SOS da Wikipedia para este Seleção Wikipedia para as escolas. Antes de decidir sobre o patrocínio de uma criança, por que não aprender sobre as diferentes instituições de caridade de patrocínio primeiro ?
A solubilidade é uma característica propriedade física referindo-se à capacidade de uma determinada substância, o soluto , para se dissolver num solvente . Mede-se em termos da quantidade máxima de soluto dissolvido em um solvente em equilíbrio . A solução resultante é chamada uma saturado solução . Determinados líquidos são solúveis em todas as proporções com um dado solvente, como etanol em água . Esta propriedade é conhecida como miscibilidade. Além disso, o equilíbrio de solubilidade podem ser ultrapassados em várias condições para dar um denominado solução supersaturada, a qual é metastable.
Em uma solução, o solvente é geralmente um líquido, que pode ser uma substância pura ou uma mistura. As espécies que se dissolve (soluto) pode ser um gás, um outro líquido ou um sólido. As solubilidades variar amplamente, de infinitamente solúvel tal como etanol em água , a pouco solúvel, tal como cloreto de prata na água. O termo insolúvel é frequentemente aplicada aos compostos fracamente solúveis, no entanto, estritamente falando, existem muito poucos casos em que não há absolutamente nenhum material dissolvido.
Vista Molecular
Solubilidade ocorre em equilíbrio dinâmico. Isto significa que a solubilidade deve ser visto como um resultado de dois processos simultâneos e opostas: a dissolução e a precipitação. A solubilidade de equilíbrio ocorre quando os dois processos de proceder com a mesma velocidade.
O equilíbrio de solubilidade é relativamente simples para substâncias covalentes, tais como etanol. Quando o etanol dissolve-se em água, as moléculas de etanol permanecem intactos, mas formar novo pontes de hidrogênio com a água. No entanto, quando um composto iónico tal como o cloreto de sódio (NaCl) se dissolve em água, o cloreto de sódio gelosia se dissocia em iões que são separadas solvatada (enrolado) com um revestimento de moléculas de água. No entanto, NaCl é dito para se dissolver em água, porque a evaporação do solvente os retornos de NaCl cristalino.
Algumas vezes o termo "dissolvente" é aplicado a uma irreversível reacção química , como com ferro em ácido nítrico , mas, nesse caso, o conceito de termodinâmica solubilidade não se aplica.
Quando se dissolve, um soluto podem formar várias espécies presentes na solução. Por exemplo, a água acima dos cristais de hidróxido de ferro, Fe (OH) 2, será, em equilíbrio, contêm Fe 2+, Fe (OH) +, o Fe (OH) 2, o Fe (OH) 3 - e, eventualmente, outros complexos. Por conseguinte, a solubilidade do hidróxido ferroso depende do pH. Em geral, a solubilidade na fase solvente pode ser dada apenas por um soluto específico, que é termodinamicamente estável, e o valor da solubilidade irá incluir todas as espécies na solução (no exemplo acima, todos os complexos contendo ferro).
Fatores que afetam a solubilidade
A solubilidade é definida para específicas as fases . Por exemplo, a solubilidade aragonite e calcite em água devem ser diferentes, embora ambos sejam a mesma substância química ( carbonato de cálcio ).
A solubilidade de uma substância dissolvendo em outro é determinado pelo equilíbrio de forças intermoleculares entre o solvente e o soluto e entropia mudança que acompanha a solvatação. Factores tais como a temperatura ea pressão irão alterar este equilíbrio, alterando assim a solubilidade.
A solubilidade pode também depender fortemente da presença de outras espécies dissolvidas no solvente, por exemplo, aniões formadores de complexos ( ligandos) em líquidos. A solubilidade irá também depender do excesso (ou deficiência) de um ião comum ( efeito de íon comum) na solução. Em menor grau, a solubilidade vai depender da força iónica de soluções líquidas. Os últimos dois efeitos pode ser quantificada utilizando a equação de equilíbrio de solubilidade.
Há também um certo número de factores menos frequentes que podem afectar a solubilidade. Solubilidade pode depender do tamanho do cristal (ou gota) da fase de soluto (tipicamente, a solubilidade aumenta com a diminuição de tamanho dos cristais de cristais muito menor do que 1 mm). Para cristais altamente defeituosos, a solubilidade pode aumentar com o aumento do grau de desordem. Os dois últimos efeitos, embora de grande importância prática, não são efeitos de solubilidade verdadeiros porque a verdadeira solubilidade ocorre em equilbrium, o que requer um monocristal perfeito. No caso das substâncias de dissolução em um reacção electroquímica, espera-se que a solubilidade dependem do potencial da fase de soluto.
Temperatura
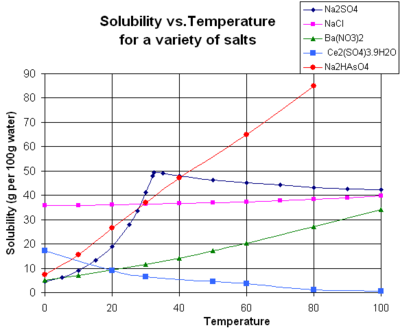
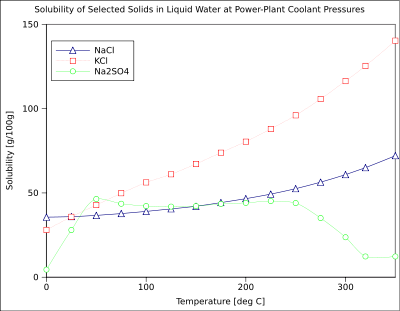
A solubilidade de um soluto num determinado dado solvente tipicamente depende da temperatura. Para cerca de 95% dos solutos sólidos, a solubilidade aumenta com a temperatura, na gama de temperaturas de cerca da temperatura ambiente até 100 ° C. Em água no estado líquido a temperaturas elevadas, (por exemplo, o que se aproxima temperatura crítica), a solubilidade de solutos iónicos tende a diminuir devido à mudança de propriedades de estrutura e de água no estado líquido (inferior constante dieléctrica, menos de um solvente polar ).
Gasosos solutos apresentar um comportamento mais complexo com a temperatura. À medida que a temperatura é aumentada de gases tornam-se menos solúveis em água, mas mais solúveis em solventes orgânicos.
O gráfico mostra as curvas de solubilidade para alguns inorgânico típico sais (todos os sólidos). Muitos sais comportam como nitrato de bário e de arsenato de hidrogénio dissódico, e mostram um grande aumento na solubilidade com a temperatura. Alguns solutos (por exemplo, NaCl em água) apresentam solubilidade que é relativamente independente da temperatura. Alguns, tais como de cério (III), sulfato, tornam-se menos solúveis em água quando a temperatura aumenta. Este é por vezes referido como "retrograte" ou solubilidade "inversa". Ocasionalmente, um padrão mais complexo é observada, como com sulfato de sódio , em que o deca menos solúvel cristalina de hidrato perde água de cristalização a 32 ° C para formar uma forma mais solúvel fase anidro.
Os compostos orgânicos que quase sempre se tornam solúveis quanto a temperatura é elevada, na maioria dos solventes. A técnica de recristalização, utilizada para a purificação de sólidos, depende deste diferenças na solubilidade em solvente quente e frio. Há algumas exceções, como certos ciclodextrinas.
Pressão
Para fases condensadas (sólidos e líquidos), a dependência da pressão de solubilidade é tipicamente fraco e geralmente negligenciado na prática. Assumindo uma solução ideal, a dependência pode ser quantificado como:
N, onde i é a fracção molar do componente i na solução, P é a pressão, o índice T refere-se a temperatura constante, V i, aq é a volume molar parcial do componente i na solução, i V, Cr é o volume molar parcial do componente i na dissolução sólida, e R é a constante de gás universal.
A lei de Henry afirma que a solubilidade de um gás num líquido é directamente proporcional à a pressão parcial do referido gás acima do líquido, o qual pode ser escrito como:
onde k é uma constante dependente da temperatura (por exemplo, 769,2 L • atm / mol para dioxigénio (O2) em água a 298 K), P é a pressão parcial (atm), e c é a concentração do gás dissolvido no líquido (mol / L).
Polaridade
Um populares aforisma utilizado para prever a solubilidade é "como se dissolve como" Isto indica que um soluto vai dissolver melhor em um solvente que tem uma semelhante polaridade para si. Esta é uma visão bastante simplista, uma vez que ignora muitas interações solvente-soluto, mas é uma regra de polegar útil. Por exemplo, uma muito polar ( hidrofílico) de soluto, tais como ureia é altamente solúvel em água altamente polar, solúvel em menos razoavelmente polar metanol , e praticamente insolúvel em solventes não-polares tais como benzeno . Em contraste, um não-polar ou soluto lipofílico tal como naftaleno é insolúvel em água, relativamente solúvel em metanol, e altamente solúvel em benzeno não-polar.
Solubilidades líquidos também geralmente seguem esta regra. Óleos vegetais lipófilos, tais como azeite e óleo de palma, dissolver em gasolina não-polar (gasolina), mas os líquidos polares como a água não se mistura com a gasolina.
Químicos sintéticos geralmente usam as diferentes solubilidades dos compostos para separar e purificar compostos a partir de misturas de reacção.
Taxa de dissolução
A dissolução não é sempre um processo instantâneo. É rápido quando o sal e o açúcar se dissolver na água, mas muito mais lento para um comprimido de aspirina ou de um grande cristal hidratado de cobre (II) sulfato . A velocidade com que um sólido se dissolve pode depender das suas propriedades cristalinas (cristalinos vs amorfa, tamanho do cristal) e a presença de polimorfismo. Isto é importante em muitos sistemas práticos, por exemplo, na concepção de métodos para controlada entrega de drogas. Fundamentalmente, a taxa de dissolução depende da presença de mistura e outros factores que determinam o grau de undersaturation no filme solvente líquido imediatamente adjacente ao cristal soluto sólido. Em alguns casos, os equilíbrios de solubilidade pode levar um longo tempo para estabelecer (horas, dias, meses ou anos, dependendo da natureza do soluto e outros factores). Na prática, isso significa que a quantidade de soluto numa solução não é sempre determinada pela sua solubilidade termodinâmica, mas pode depender da cinética de dissolução (ou precipitação).
A taxa de dissolução e a solubilidade não deve ser confundido - eles são diferentes conceitos (cinéticos e termodinâmicos, respectivamente).
Quantificação de solubilidade
A solubilidade é normalmente expressa como uma operação de concentração, tanto a concentração de massa (g de soluto por quilograma de dissolvente, g por 100 mL (dl) de solvente), molaridade, molalidade, fração molar ou outras descrições similares de concentração. A quantidade máxima de equilíbrio de soluto que pode dissolver-se por quantidade de solvente é que a solubilidade do soluto no solvente que sob as condições especificadas. A vantagem de expressar solubilidade desta maneira é a sua simplicidade, enquanto a desvantagem é que ela pode depender fortemente da presença de outras espécies no solvente (por exemplo, o efeito do ião comum).
As constantes de solubilidade são usados para descrever as soluções saturadas de compostos iónicos de solubilidade relativamente baixa (ver solubilidade de equilíbrio). A constante de solubilidade é um caso especial de um constante de equilíbrio. Ele descreve o equilíbrio entre íons dissolvidos do sal e sal não dissolvido. A constante de solubilidade é também "aplicável" (isto é, útil) precipitação, o inverso da reacção de dissolução. Tal como acontece com outras constantes de equilíbrio, a temperatura pode afetar o valor numérico da constante de solubilidade. A constante de solubilidade é mais complicada do que a solubilidade. No entanto, o valor dessa constante é geralmente independente da presença de outras espécies no solvente.
A lei de Henry é utilizada para quantificar a solubilidade de gases em líquidos, como uma função da de gás pressão parcial. Ele é um caso especial de um equilíbrio de solubilidade.
O Teoria solução de Flory-Huggins é um modelo teórico que descreve a solubilidade de polímeros. O Hansen Parâmetros e solubilidade do Parâmetros de solubilidade de Hildebrand são métodos empíricos para a predição da solubilidade. também é possível prever a solubilidade de outros constantes físicas, tais como a entalpia de fusão.
O coeficiente de partição ( Log P) é uma medida da solubilidade diferencial de um composto numa solvente hidrofóbico ( octanol) e um solvente hidrofílico ( água ). O logaritmo destes dois valores permite compostos a serem classificados em termos de hidrofilicidade (ou hidrofobia).
Aplicações
Solubilidade é de fundamental importância em um grande número de disciplinas científicas e aplicações práticas, os mais óbvios sendo em engenharia química, ciência dos materiais, geologia e ciências ambientais.
A solubilidade é frequentemente dito ser uma das "propriedades características de uma substância". Isso significa que a solubilidade é comumente usado para descrever a substância, para lançar luz sobre a natureza da substância, para ajudar a distingui-la de outras substâncias, e para guiar com uma aplicação da substância. Por exemplo, índigo é descrito como "insolúvel em água, álcool ou éter, mas solúvel em clorofórmio, nitrobenzeno, ou ácido sulfúrico concentrado".
Por exemplo, a solubilidade de uma substância é útil na separação de misturas. Por exemplo, uma mistura de sal ( cloreto de sódio ) de sílica e podem ser separados por dissolução do sal em água, e filtração da sílica não dissolvido. A síntese de compostos químicos, por miligrama num laboratório, ou pela tonelada na indústria, fazer uso tanto das solubilidades relativas do produto desejado, assim como materiais de partida que não reagiram, subprodutos e produtos secundários para conseguir a separação.
Outro exemplo disto seria a síntese de ácido benzóico a partir de brometo de fenilmagnésio e gelo seco . O ácido benzóico é mais solúvel num solvente orgânico, tal como ou diclorometano éter dietílico, e agitou-se com quando este solvente orgânico numa funil de separação, preferencialmente irá dissolver-se na camada orgânica. Os outros produtos de reacção, isto é, o brometo de magnésio permanecem na fase aquosa, que mostra claramente que a separação com base na solubilidade é conseguida. (Numa nota, na prática, o ácido benzóico obtido após evaporação do solvente orgânico deve, idealmente, ser purificado por recristalização a partir de água quente).
Solubilidade de compostos iônicos em água
A solubilidade de um sal que se ioniza em água é determinado pela produto de solubilidade (K SP), que é uma constante para uma dada temperatura. O cloreto de prata é um sal relativamente insolúvel em água. Ele ioniza:
- Ag + + Cl - ↔ AgCl (s)
O produto de solubilidade de AgCl, 1.8E-10 é também o constante de equilíbrio da reacção esta que é calculada através da multiplicação das concentrações de iões de prata e de cloreto em uma solução saturada, isto é, [Ag +] [Cl]. Assim, a concentração máxima de uma solução pura de cloreto de prata é possível sqrt (1.8E-10) = 1,34 E-5 M. No entanto, se foram adicionados lá iões cloreto, talvez como uma solução de cloreto de sódio, o equilíbrio vai mudar de acordo com a princípio, e de cloreto de prata de Le Chatelier irá precipitar a partir da solução.
| Solúvel | Insolúvel |
|---|---|
| Grupo I e NH 4 + compostos | carbonatos (excepto o Grupo I , NH 4 + e compostos uranilo) |
| nitratos | sulfitos (exceto Grupo I e NH 4 + compostos) |
| acetatos (ethanoates) | fosfatos (excepto o Grupo I e NH 4 + compostos) |
| cloretos, e brometos iodetos (excepto Ag + , Pb2 + , Cu + e Hg 2+ 2 ) | hidróxidos e óxidos (excepto o Grupo I , NH 4 +, Ba 2+ , Sr 2+ e Tl + ) |
| sulfatos (exceto Ag + , Pb 2+ , Ba 2+ , Sr 2+ e Ca 2+ ) | sulfetos (exceto Grupo I , Grupo II e NH 4 + compostos) |
A solubilidade de compostos orgânicos
O princípio descrito acima sob polaridade , que se dissolve como gostam, é o guia que o habitual para solubilidade com os sistemas orgânicos. Por exemplo, vaselina irá dissolver-se na gasolina; ambas as quais são lipofílicos. Isto é porque vaselina consiste de cadeias de carbono longas, assim como a gasolina. Não será, por outro lado, dissolvem-se em álcool ou água, uma vez que a polaridade destes solventes é muito alta. O açúcar não se dissolve na gasolina, uma vez que o açúcar é também polar, em comparação com a gasolina. Uma mistura de gasolina e de açúcar pode, portanto, ser separado por filtração, ou extracção com água.
Solubilidade sólida
Este termo é geralmente utilizado no campo da metalurgia para referir-se na medida em que um elemento de liga se dissolverá na metal de base sem formar uma fase separada. A linha de solubilidade (ou curva) é a linha (ou linhas) de uma diagrama de fases que dão os limites de adição de soluto. Isto é, as linhas mostram a quantidade máxima de um componente que pode ser adicionado a outro componente e ainda estar no solução sólida. Na fabricação de micro-electrónica, a solubilidade sólida refere-se à concentração máxima de impurezas pode-se colocar no substrato.
Dissolução Incongruent
Muitas substâncias dissolver de forma congruente, isto é, a composição do sólido e a partida de soluto dissolvido estequiometricamente. No entanto, algumas substâncias podem dissolver incongruente, em que a composição do soluto na solução não coincide com a do sólido. Isto é acompanhado por alteração do "primário sólido" e, possivelmente, a formação de uma fase sólida secundário. No entanto, em geral, alguns sólidos primários e também se mantém um equilíbrio de solubilidade complexo estabelece. Por exemplo, a dissolução de albite pode resultar na formação de gibbsite.
- NaAlSi 3 O 8 (s) + H + + 7H 2 O = Na + + Al (OH) 3 (s) + 3H 4 SiO 4.
Neste caso, a solubilidade de albite é esperado que depende da proporção de sólido para solvente. Este tipo de solubilidade é de grande importância em geologia, em que resulta na formação de rochas metamórfica .