
Ácido sulfúrico
Você sabia ...
Esta seleção Wikipedia está offline disponível a partir de Crianças SOS, para distribuição no mundo em desenvolvimento. SOS mães cada um cuidar de uma família de crianças apadrinhadas .
| Ácido sulfúrico | |
|---|---|
 | |
 | |
Ácido sulfúrico | |
Outros nomes óleo de vitríolo | |
| Identificadores | |
| Número CAS | 7664-93-9 |
| Número RTECS | WS5600000 |
| Propriedades | |
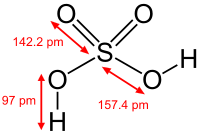
| Fórmula molecular | H 2 SO 4 |
| Massa molar | 98,078 g / mol |
| Aparência | límpida, incolor, líquido inodoro |
| Densidade | 1,84 g cm -3, líquida |
| Ponto de fusão | 10 ° C, 283 K, 50 ° F |
| Ponto de ebulição | 290 ° C, 563 K, 554 ° F (pb de ácido puro. Solução a 98% entra em ebulição a 338 ° C) |
| Solubilidade em água | totalmente miscível (Exotérmica) |
| Viscosidade | 26,7 c P a 20 ° C |
| Perigos | |
| MSDS | MSDS External |
| Classificação da UE | Altamente Corrosivo (C) |
| Frases R | R35 |
| Frases-S | (S1 / 2), S26, S30, S45 |
| NFPA 704 |  0 3 2 COR |
| Ponto de centelha | Não inflamável |
| Os compostos relacionados | |
| Relacionado ácidos fortes | Ácido selênico Ácido clorídrico Ácido nítrico |
| Os compostos relacionados | O sulfeto de hidrogênio Ácido sulfuroso Ácido Peroxymonosulfuric Trióxido de enxofre Óleum |
| Página Suplementar dados | |
| Estrutura e Propriedades | N, ε r, etc. |
| Termodinâmica dados | Comportamento de fase Sólido, líquido, gasoso |
| Os dados espectrais | UV, IV, RMN , MS |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
Ácido sulfúrico, (também conhecido como ácido sulfúrico) H 2 S S 4, é uma forte ácido mineral. É solúvel em água em todas as concentrações. Ele já foi conhecido como óleo de vitríolo, cunhado pelo século 8- Alquimista muçulmano Jabir ibn Hayyan (Geber), após a descoberta do produto químico. O ácido sulfúrico tem muitas aplicações, e é um dos principais produtos do indústria química. A produção mundial em 2001 foi de 165 milhões toneladas, com um valor aproximado de US $ 8 bilhões. Usos principais incluem processamento de minério, fertilizantes fabricação, refino de petróleo , processamento de águas residuais, e síntese química.
Muitas proteínas são feitas de enxofre molecular contendo amino ácidos (tais como e cisteína metionina), que produzem ácido sulfúrico quando metabolizado pelo organismo.
Ocorrência
Ácido puro (não diluído) sulfúrico não é encontrado na Terra, devido à grande afinidade de ácido sulfúrico para a água. Além disso, o ácido sulfúrico é um constituinte da chuva ácida , que é formado por atmosférica oxidação de dióxido de enxofre na presença de água , isto é, a oxidação de ácido sulfuroso. O dióxido de enxofre é o principal subproduto produzido quando combustíveis contendo enxofre tal como o carvão ou o óleo são queimados.
O ácido sulfúrico é formado naturalmente pela oxidação dos minerais de sulfureto, tal como sulfureto de ferro. A água resultante pode ser altamente ácidas e é chamada Drenagem Ácida de Mina (AMD). Esta água ácida é capaz de dissolver metais presentes em minérios de sulfureto, o que resulta em brilhantemente colorido, fluxos tóxicos. A oxidação do sulfureto de ferro pirite por oxigénio molecular produz ferro (II), ou Fe 2+:
O Fe 2+ pode ser posteriormente oxidada em Fe3 +, de acordo com:
e o Fe3 + produzido pode ser precipitado como o hidróxido ou óxido hidratado. A equação para a formação do hidróxido é
- Fe3 + + 3 H2O → Fe (OH) 3 + 3 H +.
O ferro (III) de iões ("ferro férrico", na nomenclatura ocasional) também pode oxidar pirita. Quando o ferro (III) a oxidação de pirita ocorre, o processo pode tornar-se rápida. valores de pH abaixo de zero foram medidos em AMD produzido por este processo.
A AMD também pode produzir o ácido sulfúrico, a uma taxa mais lenta, de modo que o Capacidade de neutralização ácida (ANC) do aquífero pode neutralizar o ácido produzido. Em tais casos, o Sólidos dissolvidos totais (TDS) concentração da água pode ser aumentada forma a dissolução de minerais a partir da reacção de ácido de neutralização com os minerais.
Ácido sulfúrico Extraterrestrial
O ácido sulfúrico é produzido na camada superior da atmosfera de Vénus pelo sol de ação fotoquímica em dióxido de carbono , dióxido de enxofre e água vapor. ultravioletas fótons de comprimentos de onda inferior a 169 nm pode photodissociate dióxido de carbono em monóxido de carbono e atômico de oxigênio . Oxigênio atômico é altamente reativo. Quando se reage com o dióxido de enxofre, um componente de rastreio da atmosfera de Vénus, o resultado é trióxido de enxofre, que pode combinar com vapor de água, outro componente traço da atmosfera de Vênus, para produzir ácido sulfúrico.
Nas partes superiores, mais frias da atmosfera de Vénus, existe ácido sulfúrico como um líquido, e ácido sulfúrico espessas nuvens superfície completamente obscuro do planeta quando visto de cima. A camada de nuvem principal estende 45-70 km acima da superfície do planeta, com neblinas finas que se estendem tão baixas quanto 30 e tão elevadas quanto 90 quilômetros acima da superfície.
Espectros infravermelhos de NASA 's Galileo missão mostrar absorções distintas sobre Júpiter lua 's Europa que têm sido atribuídos a um ou mais hidratos de ácido sulfúrico. A interpretação dos espectros é um tanto controverso. Alguns cientistas planetários preferem atribuir as características espectrais para o ião sulfato, talvez como parte de um ou mais minerais em superfície de Europa.
Fabricação
O ácido sulfúrico é produzido a partir de enxofre , oxigénio e água através da processo de contato.
No primeiro passo, enxofre é queimado para produzir dióxido de enxofre.
Este é então oxidado para trióxido de enxofre usando oxigénio na presença de um vanádio (V) de óxido de catalisador .
- (2) 2 SO 2 + O 2 (g) → 2 SO 3 (g) (em presença de V 2 O 5)
Finalmente, o trióxido de enxofre é tratado com água (normalmente como 97-98% de H 2 SO 4, contendo 2-3% de água) para produzir ácido sulfúrico 98-99%.
Note-se que a dissolução directamente SO3 em água não é prático devido ao grande natureza exotérmica da reacção , a formação de uma névoa corrosiva, em vez de um líquido. Alternativamente, SO 3 pode ser absorvida dentro de H 2 SO 4 para produzir óleum (H 2 S 2 O 7), o qual pode então ser misturado com água para formar o ácido sulfúrico.
- (3) H 2 SO 4 8 ( G 8) + SO3 → H 2 S 2 O 7 (l)
Oleum reage com água para formar H 2 SO 4 concentrado.
- (4) H 2 S 2 O 7 (l) + H2O (l) → 2 H 2 SO 4 (l)
Propriedades físicas
Formas de ácido sulfúrico
Embora o ácido sulfúrico cerca de 100% pode ser feito, este perde SO 3 no ponto de ebulição para a produção de ácido de 98,3%. O grau de 98% (18M) é mais estável em armazenamento, e é a forma usual do que é descrito como o ácido sulfúrico concentrado. Outro As concentrações são utilizadas para fins diferentes. Algumas concentrações são comuns
- 10%, de ácido sulfúrico diluído para uso em laboratório,
- 33,5%, ácido de bateria (usado em baterias de chumbo-ácido),
- 62,18%, câmara ou ácido fertilizante,
- 77,67%, torre ou ácido Glover,
- 98%, ácido concentrado.
Diferentes purezas também estão disponíveis. De grau técnico H 2 SO 4 é impura e muitas vezes colorido, mas é adequado para a produção de fertilizantes. Graus puro tal como United States Pharmacopoeia (USP) grau são usados para fazer produtos farmacêuticos e corantes.
Quando concentrações elevadas de SO 3 ( g ) são adicionados a ácido sulfúrico, H 2 S 2 O 7, chamada pirossulfúrico ácido, ácido sulfúrico fumante ou oleum ou, menos comumente, ácido Nordhausen, é formado. As concentrações de ácido sulfúrico fumante ou são expressos em termos de% de SO3 (chamado% oleum) ou como% de H 2 SO 4 (a quantidade feita se H 2 O foram adicionados); concentrações comuns são 40% ácido sulfúrico fumante (109% de H 2 SO 4) e 65% de ácido sulfúrico fumante (114,6% de H 2 SO 4). H pura 2 S 2 O 7 é um sólido com ponto de fusão 36 ° C.
A polaridade e condutividade
Anidro de H 2 SO 4 é um muito líquido polar, tendo um constante dieléctrica de cerca de 100. Tem uma elevada condutividade eléctrica, causada pela dissociação através protonação em si, um processo conhecido como autoprotolysis.
- 2 H 2 SO 4 ⇌ 3 H SO 4 + + HSO 4 -
O constante de equilíbrio para a autoprotolysis é
- Ap K (25 ° C) = [3 H SO 4 +] [HSO 4 -] = 2,7 x 10 -4.
A constante de equilíbrio para comparável água, K w é de 10 -14, de um factor de 10 a 10 (10 mil milhões) menor.
Apesar de a viscosidade do ácido, o eficaz condutividade de 3 a H SO 4 + e HSO 4 - iões são elevados, devido a um mecanismo de interruptor de protões intra-molecular (análogo ao Mecanismo Vilnius em água), ácido sulfúrico fazendo um bom condutor. É também um excelente solvente para muitas reacções.
O equilíbrio é, na verdade, mais complexo do que o indicado acima; 100% de H 2 SO 4 contém as seguintes espécies em equilíbrio (figuras como milimoles por kg de solvente): HSO 4 - (15,0), H SO 4 + 3 (11,3), H 3 O + (8,0), SH 2 O 7 - (4.4), H 2 S 2 O 7 (3,6), H2O (0,1).
Propriedades químicas
A reacção com água
O reacção de hidratação de ácido sulfúrico é altamente exotérmica. Se a água é adicionado ao ácido sulfúrico concentrado, que pode reagir, fervura e cuspir perigosamente. Deve-se sempre adicionar o ácido à água, em vez de água para o ácido. Isso pode ser lembrado através de mnemônicos, tais como: ". Faça o que você deveria, adicionar o ácido à água", "Se você acha que sua vida também plácido, adicione a água ao ácido", "AA: adicionar ácido", ou "Drop ácido, e não água", ou "o ácido à água, como A & W Root Beer "ou" Coloque o rei na água, não a água para o rei ". A necessidade desta medida de segurança é devido às densidades relativas destes dois líquidos. A água é menos densa do que o ácido sulfúrico, o que significa água tenderá a flutuar na parte superior deste ácido. A reacção é melhor pensado como formando iões hidrónio, por
- H 2 SO 4 + H2O → H3O + + HSO 4 -,
e depois
- HSO 4 - + H2O → H3O + + SO 4 2-.
Uma vez que a hidratação do ácido sulfúrico é termodinamicamente favorável, o ácido sulfúrico é um excelente agente de desidratação, e é utilizado para preparar muitos frutos secos. A afinidade de ácido sulfúrico para a água é suficientemente forte que ele irá remover hidrogênio e oxigênio átomos de outros compostos; por exemplo, misturando amido (C 6 H 12 O 6) n e ácido sulfúrico concentrado irá dar elementar de carbono e água que é absorvida pelo ácido sulfúrico (que se torna ligeiramente diluída): (C 6 H 12 O 6) n → 6C + 6H 2 O. O efeito disto pode ser visto, quando o ácido sulfúrico concentrado é derramada no papel; a celulose reage para dar um queimado aparência, o carbono aparece muito como fuligem seria em um incêndio. Uma reacção mais dramático ocorre quando o ácido sulfúrico é adicionado a uma colher de sopa de branco açúcar ; uma coluna rígida de preto, carbono poroso vai rapidamente emergir. O carbono terá um cheiro forte de caramelo.
Outras reacções
Como ácido, o ácido sulfúrico reage com a maioria bases para dar o correspondente sulfato . Por exemplo, de cobre (II) sulfato . Este sal azul de cobre , comumente usado para galvanoplastia e como um fungicida, é preparado pela reacção de óxido de cobre (II) com ácido sulfúrico:
Ácido sulfúrico, também pode ser utilizado para deslocar os ácidos mais fracos partir dos seus sais. A reacção com acetato de sódio, por exemplo, desloca o ácido acético :
- H 2 SO 4 + CH3 COONa → NaHSO4 + CH3COOH
Do mesmo modo, a reacção do ácido sulfúrico com nitrato de potássio pode ser usado para produzir ácido nítrico e um precipitado de bissulfato de potássio. Quando combinado com o ácido nítrico , ácido sulfúrico actua tanto como um ácido e um agente de desidratação, formando o ião nitrónio + NO2, que é importante em reações de nitração que envolvam substituição aromática electrofílica. Este tipo de reacção, em que a protonação ocorre em um oxigénio átomo, é importante em muitos de química orgânica , tais como reacções Fischer e esterificação desidratação de álcoois.
Ácido sulfúrico reage com a maioria dos metais através de um único reacção de deslocamento para produzir hidrogénio e gás do sulfato de metal. Dilui-se H 2 SO 4 ataques de ferro , alumínio , zinco , manganês , magnésio e níquel , mas reacções com estanho e cobre requerem o ácido a ser quente e concentrou-se. chumbo e de tungsténio , no entanto, são resistentes ao ácido sulfúrico. A reacção com o ferro (mostrado) é típico para a maioria destes metais, mas a reacção com estanho é invulgar na medida em que produz dióxido de enxofre em vez de hidrogénio.
- Sn (s) + 2 H 2 SO 4 (aq) → SnSO 4 (aq) + 2H 2 O (l) + SO2 (g)
O ácido sulfúrico é submetido substituição aromática electrofílica com compostos aromáticos para dar o correspondente ácidos sulfónicos:
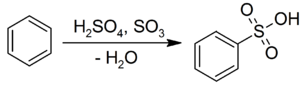
Usos
O ácido sulfúrico é muito importante produto químico, e de fato, a produção de ácido sulfúrico de uma nação é um bom indicador de sua força industrial. O uso principal (60% da produção mundial total) para o ácido sulfúrico é, pelo método "húmido" para a produção de ácido fosfórico , utilizado para o fabrico de fosfatos fertilizantes , bem como fosfato trissódico para detergentes. Neste método, é utilizada rocha de fosfato, e mais de 100 milhões de toneladas por ano são processados. Esta matéria-prima está apresentada abaixo como fluorapatite, embora a composição exacta pode variar. Esta é tratada com ácido sulfúrico a 93% para produzir sulfato de cálcio, fluoreto de hidrogénio (HF) e ácido fosfórico . O HF é removido como ácido fluorídrico. O processo global pode ser representado como:
O ácido sulfúrico é utilizado em grandes quantidades pelo ferro e siderurgia indústria para remover oxidação, ferrugem e escala de folha de laminados e tarugos antes da venda para o automóvel indústria e branco de bens. Ácido usado é muitas vezes reciclado usando um Regeneração de Ácido (SAR) planta gasto. Estas plantas combustão ácido gasto com gás natural, gás de refinaria, óleo combustível ou outras fontes de combustível. Este processo de combustão produz dióxido de enxofre gasoso (SO 2) e trióxido de enxofre (SO3), que são então utilizadas para fabricar ácido sulfúrico "novo". Plantas de SAR são adições comuns às plantas de fundição de metal, refinarias de petróleo e outras indústrias onde o ácido sulfúrico é consumido em grandes quantidades, como operar uma planta de SAR é muito mais barato do que os custos recorrentes de gasto disposição ácido e novas compras de ácido.
Sulfato de amónio, um importante fertilizante de nitrogênio, é mais comumente produzida como um subproduto de coquerias que abastecem a ferro e siderúrgicas fazendo. Reagindo a amônia produzida na decomposição térmica de carvão com ácido sulfúrico de resíduos permite a amônia a ser cristalizou como um sal (muitas vezes marrom por causa da contaminação de ferro) e vendidos para a indústria de agro-químicos.
Outro uso importante para o ácido sulfúrico é para o fabrico de sulfato de alumínio, também conhecido como alúmen da máquina de papel. Este pode reagir com pequenas quantidades de sabão sobre fibras de polpa de papel para dar alumínio gelatinoso carboxilatos, que ajudam a coagular as fibras de polpa de papel para uma superfície dura. É também usado para fazer hidróxido de alumínio, o qual é utilizado em estações de tratamento de água para filtrar para fora as impurezas, bem como para melhorar o sabor da água . Sulfato de alumínio é feito por reacção de bauxita com ácido sulfúrico:
O ácido sulfúrico é utilizado para uma variedade de outras finalidades na indústria química. Por exemplo, o catalisador ácido é usual para a conversão de cyclohexanoneoxime para caprolactama, usado para fazer nylon. É usado para fazer o ácido clorídrico a partir de sal através da Processo de Mannheim. Muito H 2 SO 4 é utilizado em petróleo de refinação, por exemplo, como um catalisador para a reacção de com isobutano isobutileno para dar iso-octano, de um composto que aumenta a octanagem da gasolina (gasolina). O ácido sulfúrico também é importante no fabrico de soluções de matérias corantes e é o "ácido" em chumbo-ácido (carro) baterias.
O ácido sulfúrico é também utilizado como um agente de desidratação, em geral na sua forma concentrada. Ver Reacção com água .
Ciclo do enxofre de iodo-
O ciclo do enxofre-iodo é uma série de processos de termo-químicos utilizados para a obtenção de hidrogénio . É composto de três reações químicas cuja líquido reagente é água e cujos produtos são hidrogénio líquido e oxigênio .
-
2 H 2 S S 4 → 2 S S 2 + 2 H 2 O + O 2 (830 ° C) I 2 + S S 2 + 2 H 2 O 2 → H I + H 2 S S 4 (120 ° C) 2 H I → I 2 + H 2 (320 ° C)
O enxofre e iodo compostos são recuperados e reutilizados, por conseguinte, a análise do processo como um ciclo. Este processo é endotérmico e deve ocorrer a temperaturas elevadas, de modo que energia na forma de calor tem que ser fornecido.
O ciclo de enxofre-iodo tem sido proposta como uma forma para fornecer hidrogénio para uma economia baseada no hidrogênio. Não exige hidrocarbonetos como métodos atuais de reforma a vapor.
O ciclo de enxofre-iodo está actualmente a ser pesquisadas como um método viável de obtenção de hidrogénio, mas o concentrado, ácido corrosivo a altas temperaturas actualmente apresenta riscos de segurança insuperáveis se o processo foram construídas em grande escala.
História

A descoberta de ácido sulfúrico é creditado ao século 8 Arabian químico e alquimista, Jabir ibn Hayyan (Geber). O ácido foi posteriormente estudado por século 9 Persa médico e alquimista Ibn al-Razi Zakariya (Rhazes), que obteve a substância por destilação seca de minerais, incluindo ferro (II) hepta-hidrato de sulfato, FeSO 4 • 7H 2 O, e cobre (II) sulfato pentahidrato, CuSO 4 5H 2 O. • Quando aquecida, estes compostos decompõem para óxido de ferro (II) e óxido de cobre (II), respectivamente, uma libertação de água e trióxido de enxofre, que se combinam para produzir uma solução diluída de ácido sulfúrico. Este método foi popularizado na Europa através de traduções do árabe e tratados persas, assim como livros de alquimistas europeus, como o século 13 alemão Albertus Magnus.
Ácido sulfúrico era conhecido por alquimistas medievais europeus como o óleo de vitríolo, espírito de vitríolo, ou simplesmente vitriol, entre outros nomes. A palavra deriva do vitriol vitreus Latina, "vidro", referindo-se a aparência glassy dos sais de sulfato, que também levou o nome vitriol. Sais chamados por esse nome incluído sulfato de cobre (II) (vitríolo azul, ou raramente Roman vitriol), sulfato de zinco (branco vitriol), de ferro (II) sulfato (vitríolo verde), de ferro (III) sulfato (vitríolo de Marte), e cobalto (II), sulfato de (virulência vermelho).
Vitriol foi considerado o mais importante alquímico substância, destina-se a ser usado como um Pedra filosofal. Virulência altamente purificada foi utilizada como um meio para a reacção de outras substâncias. Isso aconteceu principalmente porque o ácido não reage com o ouro , cuja produção foi muitas vezes o objetivo final de processos alquímicos. A importância de vitríolo à alquimia é destacado no lema alquímico, Visita interiore Terrae rectificando invenies Occultum lapidem que é um significado backronym ('Visite o interior da Terra e de retificação (ou seja, de purificação), você vai encontrar a pedra escondida / secret'), encontrado em L'azoth des Philosophes pelo alquimista do século 15 Basilius Valentinus,.
No século 17, o químico alemão-holandês Johann Glauber preparado ácido sulfúrico por queima de enxofre juntamente com salitre ( nitrato de potássio , KNO 3), na presença de vapor. Como salitre se decompõe, ele oxida o enxofre para SO 3, que combina com água para produzir ácido sulfúrico. Em 1736, Joshua Ward, Londres farmacêutico, usado este método para iniciar a primeira produção em larga escala de ácido sulfúrico.
Em 1746, em Birmingham , John Roebuck adaptado este método para produzir ácido sulfúrico em chumbo câmaras -lined, que foram mais fortes, mais barato, e pode ser feito maior do que os recipientes de vidro anteriormente utilizados. Este processo câmara de chumbo permitiu a industrialização eficaz de produção de ácido sulfúrico. Depois de vários refinamentos, este método manteve-se o padrão para a produção de ácido sulfúrico por quase dois séculos.
Ácido sulfúrico criado por processo de John Roebuck única abordado uma concentração de 35-40%. Refinamentos posteriores ao processo de chumbo-câmara por químico francês Joseph-Louis Gay-Lussac e químico britânico John Glover melhorou o rendimento para 78%. No entanto, o fabrico de alguns corantes e outros processos químicos exigem um produto mais concentrado. Ao longo do século 18, isso só poderia ser feito por minerais secos das destilarias em uma técnica semelhante à original alquímicos processos. pirite ( dissulfureto de ferro , FeS 2) foi aquecida em ar, para se obter ferro (II) sulfato, FeSO 4, o qual foi oxidado por um aquecimento adicional de ar para formar ferro (III), sulfato, Fe 2 (SO 4) 3, o qual, quando aquecido a 480 ° C, decomposto com óxido de ferro (III) e trióxido de enxofre, que pode ser passada através de água para produzir ácido sulfúrico, em qualquer concentração. No entanto, a despesa de este processo impedido a utilização em larga escala de ácido sulfúrico concentrado.
Em 1831, British vinagre comerciante Peregrine Phillips patenteou o processo de contacto, que foi um processo muito mais económico para a produção de trióxido de enxofre e ácido sulfúrico concentrado. Hoje em dia, quase todas de ácido sulfúrico do mundo é produzido utilizando este método.
Segurança
Riscos em Laboratório

As propriedades corrosivas de ácido sulfúrico são acentuados pela sua altamente reacção exotérmica com água . Assim queima a partir de ácido sulfúrico são potencialmente mais graves do que as comparáveis de ácidos fortes (por exemplo, ácido clorídrico ), como há danos adicionais do tecido devido à desidratação e, em particular, devido ao calor libertado pela reacção com água; ou seja, danos térmicos secundário. O perigo é, obviamente, uma maior com preparações mais concentradas de ácido sulfúrico, mas deve-se lembrar que mesmo o laboratório normal "diluir" grau (1 aprox. M, 10%) vai chamuscar papel por desidratação, se deixados em contato por um tempo suficiente. Soluções igual ou mais forte do que 1,5 M devem ser rotulados corrosivas, irritantes, enquanto soluções superior a 0,5 M, mas inferior a 1,5 m devem ser rotulados. Ácido sulfúrico fumante (oleum) não é recomendada para uso em escolas, devido ao facto de ser muito perigosos. O tratamento de primeiros socorros padrão para derramamentos de ácido na pele é, como para outros corrosivos agentes, irrigação com grandes quantidades de água: lavar roupa deve ser continuado durante, pelo menos, dez a quinze minutos, a fim de resfriar o tecido que envolve a queima de ácidos e prevenir dano secundário. O vestuário contaminado deve ser removido imediatamente ea pele subjacente lavados.
Preparação do ácido diluído também pode ser perigosa, devido ao calor libertado no processo de diluição. É essencial que o ácido concentrado é adicionado à água e não de outra maneira, para tirar vantagem da relativa alta capacidade de calor de água. A adição de água ao ácido sulfúrico concentrado conduz a melhor para a dispersão de um ácido sulfúrico aerossol, na pior das hipóteses a um explosão. Preparação de soluções superiores a 6 M (35%) na concentração é a mais perigosa, dado que o calor produzido pode ser suficiente para ferver o ácido diluído: agitação mecânica eficiente e arrefecimento externo (por exemplo um banho de gelo) são essenciais.
Riscos industriais
Embora o ácido sulfúrico é não inflamável, contactar com metais no caso de um derrame pode levar à libertação de hidrogénio gás. A dispersão de aerossóis e de ácido gasoso dióxido de enxofre é um perigo adicional de incêndios envolvendo ácido sulfúrico.
O ácido sulfúrico não é considerado tóxico para além do seu perigo corrosivo óbvio, e os principais riscos ocupacionais são contacto com a pele levando a queimaduras (ver acima) e a inalação de aerossóis. A exposição aos aerossóis em concentrações elevadas conduz a uma irritação severa e imediata dos olhos, tracto respiratório e membranas mucosas: esta cessa rapidamente após a exposição, embora haja um risco de subsequente edema pulmonar em caso de danos de tecidos tem sido mais grave. A concentrações mais baixas, o sintoma mais comum relatada de exposição crónica a aerossóis de ácido sulfúrico é a erosão dos dentes, encontrados em virtualmente todos os estudos: indicações de possíveis danos ao crónica trato respiratório são inconclusivos quanto de 1997. No Estados Unidos , o limite de exposição permissível (PEL) para o ácido sulfúrico é fixada em 1 mg / m³: limites em outros países são semelhantes. Curiosamente, tem havido relatos de ingestão de ácido sulfúrico levando a deficiência de vitamina B12 com subaguda combinada degeneração. A medula espinal é mais frequentemente afectadas, em tais casos, os nervos ópticos, mas podem mostrar desmielinização, perda de axônios e gliosis.
Restrições legais
O comércio internacional de ácido sulfúrico é controlado sob o Convenção das Nações Unidas Contra o Tráfico Ilícito de Estupefacientes e Substâncias Psicotrópicas de 1988, que lista ácido sulfúrico sob Tabela II da convenção como um produto químico frequentemente utilizados no fabrico ilícito de estupefacientes ou de substâncias psicotrópicas.
No Estados Unidos da América , o ácido sulfúrico é incluído em Lista II da lista de produtos químicos essenciais ou precursoras estabelecido em conformidade com o Chemical Diversion e Ato de Tráfico. Assim, as operações de ácido sulfúrico, tais como vendas, transferências, as exportações e as importações para os Estados Unidos, estão sujeitos à regulamentação e fiscalização da Drug Enforcement Administration.
Na ficção
Em vários filmes, desenhos animados e programas de TV, especialmente queridos sci-fi, ácido sulfúrico é normalmente retratado como um líquido fumegante verde borbulhante, às vezes capaz de dissolver quase tudo em um instante. Isto é puramente para o apelo visual, desde a ferver ácido verde é mais perigoso para o futuro do que a forma clara e xaroposo real que realmente é. O uso de ácido sulfúrico como uma arma em crimes de agressão, conhecido como " vitriol jogando ", às vezes tem sido suficientemente comum (se sensacional) para fazer o seu caminho para romances e contos. Os exemplos incluem A aventura do Ilustre cliente, por Arthur Conan Doyle, O Amor de Long Ago, por Guy de Maupassant e Brighton Rock por Graham Greene. A banda, My Vitriol, tomar o seu nome de seu uso como uma arma em Brighton Rock. Um episódio de Saturday Night Live apresentado por Mel Gibson incluiu um esboço ocidental paródia sobre "Ácido Jeff Sheriff", que carrega um frasco de ácido em vez de um jogo de tiro seis. O DC Comics vilão Duas Caras foi desfigurado em conseqüência de um tiro vitriol. Este crime também é mencionado em Nineteen Eighty-Four por George Orwell; o protagonista Winston Smith concorda em jogar sarcasmo no rosto de uma criança se isso seria ordem "da Irmandade", e inimigo de Winston O'Brien mais tarde usa essas palavras bárbaras para minar sua lógica. O romance Veronika Decide Morrer por Paulo Coelho fala de uma garota que tentou cometer suicídio e acaba com intoxicação vitriol. O médico / terapeuta neste romance também escreve uma tese sobre a cura envenenamento vitriol. A substância também foi usado por um jovem gangster na Temporada 6B, Episódio 5 de Os Sopranos como uma forma de tortura.

