
Tecnécio
Informações de fundo
Crianças SOS feita esta seleção Wikipedia ao lado de outras escolas recursos . Patrocínio da criança ajuda as crianças uma a uma http://www.sponsor-a-child.org.uk/ .
| Tecnécio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
43 Tc | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
metal cinza brilhante  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | tecnécio, Tc, 43 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / t ɛ k n Eu ʃ Eu əm / tek- NEE -shee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | de metal de transição | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 7, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Kr ] 4d 5 5s 2 2, 8, 18, 13, 2 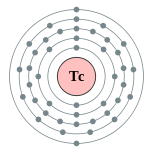 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Predição | Dmitri Mendeleev (1871) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Carlo Perrier e Emilio Segrè (1937) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primeiro isolamento | Carlo Perrier e Emilio Segrè (1937) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 11 g cm -3 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 2430 K , 2157 ° C, 3915 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 4538 K, 4265 ° C, 7709 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 33.29 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 585,2 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 24,27 J · · mol -1 K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor (extrapolada) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 7, 6, 5, 4, 3, 2, 1, -1, -3 (Fortemente ácida óxido) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,9 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 702 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segunda: 1470 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 2850 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 136 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 147 ± 19:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | hexagonal repleto de perto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | Paramagnético | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 50,6 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) de 16.200 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-26-8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de tecnécio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tecnécio é o elemento químico com número atômico 43 e símbolo Tc. É o menor número atômico elemento sem quaisquer isótopos estáveis ; toda forma de que é radioactivo. Quase todos tecnécio é produzido sinteticamente e apenas quantidades mínimas são encontradas na natureza. Que ocorre naturalmente tecnécio ocorre como espontânea produtos de cisão em minério de urânio ou por captura de nêutrons em molibdênio minérios. As propriedades químicas deste cinza prateado, cristalina do metal de transição são intermediários entre rênio e manganês .
Muitas das propriedades do tecnécio foram previstos por Dmitri Mendeleev antes do elemento foi descoberto. Mendeleev observou uma lacuna em sua tabela periódica e deu o elemento não descoberto o nome provisório ekamanganese (EM). Em 1937, o tecnécio (especificamente o tecnécio-97 isótopo) tornou-se o primeiro elemento predominantemente artificial a ser produzido, daí o seu nome (do grego τεχνητός, que significa "artificial").
Sua curta duração gama emissor de raios- isomer- nuclear de tecnécio-99m é usado em medicina nuclear para uma ampla variedade de testes de diagnóstico. Tecnécio-99 é utilizada como uma fonte isenta de raios gama de partículas beta. Longevo isótopos de tecnécio produzidos comercialmente são subprodutos de cisão de urânio-235 em reactores nucleares e são extraídos barras de combustível nuclear. Porque nenhum isótopo de tecnécio tem uma meia-vida mais longa do que 4,2 milhão anos ( tecnécio-98), sua detecção em 1952 em gigantes vermelhas , que são bilhões de anos, ajudou a reforçar a teoria de que as estrelas podem produzir elementos mais pesados.
História
Procurar por elemento 43
A partir da década de 1860 através de 1871, as primeiras formas da tabela periódica proposto por Dimitri Mendeleev continha uma lacuna entre o molibdênio (elemento 42) e rutênio (elemento 44). Em 1871, Mendeleev previu este elemento faltando iria ocupar o lugar vazio abaixo manganês e, portanto, têm propriedades químicas semelhantes. Mendeleev deu-lhe o nome provisório ekamanganese (a partir de eka -, o sânscrito palavra para um, porque o elemento previsto era um lugar para baixo do manganês elemento conhecido.)
Muitos pesquisadores iniciais, antes e depois da tabela periódica foi publicado, estavam ansiosos para ser o primeiro a descobrir e nomear o elemento que falta; sua localização na tabela sugeriu que deveria ser mais fácil de encontrar do que outros elementos desconhecidos. Ele foi primeiro pensado para ter sido encontrado em platina minérios em 1828 e recebeu o nome de polinium, mas acabou por ser impuro irídio . Em seguida, em 1846, o elemento ilmenium foi reivindicado ter sido descoberto, mas foi mais tarde determinado a ser impuro nióbio . Este erro foi repetido em 1847 com a "descoberta" de pelopium.
Em 1877, o químico russo Serge Kern relatou descobrir o elemento que falta em minério de platina. Kern chamado que ele pensava ser o novo elemento davyum (após o químico Inglês observou Sir Humphry Davy ), mas foi finalmente decidida a ser uma mistura de irídio , ródio e ferro . Outro candidato, lucium, seguido em 1896, mas que foi determinada como sendo de ítrio . Em seguida, em 1908, o químico japonês Masataka Ogawa encontrado provas no mineral torianita, que ele achava que indicou a presença de elemento 43. Ogawa nomeado o elemento nipponium , depois de Japão (que é Nippon em japonês). Em 2004, H. K Yoshihara utilizado "um registro do espectro de raios-X de amostra nipponium Ogawa de torianite [que] foi contido numa placa fotográfica preservado por sua família. O espectro foi lido e indicou a ausência do elemento 43 e o presença do elemento 75 ( rénio ). "
Químicos alemães Walter Noddack, Otto Berg, e Ida Tacke relatou a descoberta de elemento 75 e elemento 43 em 1925, e nomeado elemento 43 masurium (depois Masuria no leste Prussia, agora na Polônia , a região onde a família de Walter Noddack originado). O grupo bombardeado columbita com um feixe de elétrons e deduziu elemento 43 estava presente examinando Difracção de raios-X espectrogramas. O comprimento de onda dos raios X produzida está relacionada com o número atómico de uma fórmula derivada pela Henry Moseley em 1913. A equipe alegou para detectar um sinal de raio-X fraco no comprimento de onda produzido pelo elemento 43. experimentadores posteriores não conseguiu replicar a descoberta, e ele foi demitido como um erro por muitos anos. Ainda assim, em 1933, uma série de artigos sobre a descoberta de elementos citou o nome para masurium elemento ainda existe 43. Debate sobre se a equipe realmente fez 1.925 descobrir elemento 43.
Descoberta oficial e história mais tarde
O descoberta do elemento 43 foi finalmente confirmada em um experimento de dezembro 1936 no Universidade de Palermo, na Sicília conduzida por Carlo Perrier e Emilio Segrè. Em meados de 1936, Segrè visitou os Estados Unidos, em primeiro lugar Universidade de Columbia em Nova York e depois o Lawrence Berkeley National Laboratory, na Califórnia. Ele persuadiu inventor ciclotrão Ernest Lawrence para deixá-lo ter de volta algumas partes ciclotrão descartados que se tinham tornado radioactivo. Lawrence enviado a ele uma folha de molibdênio que tinha sido parte do deflector no ciclotrão.
Segrè alistou seu colega Perrier para tentar provar, por meio da química comparativa, que a actividade de molibdênio foi de fato a partir de um elemento com Z = 43. Eles conseguiram isolar os isótopos tecnécio-95m e tecnécio-97. Universidade de funcionários Palermo queria que eles para nomear sua descoberta "panormium", após a Latin nome para Palermo, Panormus. Em 1947 elemento 43 foi nomeado após o grego palavra τεχνητός, que significa "artificial", uma vez que foi o primeiro elemento a ser produzido artificialmente. Segrè voltou para Berkeley e conheceu Glenn T. Seaborg. Eles isolaram o isótopo metastável tecnécio-99m, que agora é usado em cerca de dez milhões de procedimentos de diagnóstico médico anualmente.
Em 1952, o astrônomo Paul W. Merrill, na Califórnia detectado o assinatura espectral de tecnécio (em particular, com luz comprimento de onda de 403,1 nm, 423,8 nm, 426,2 nm e 429,7 nm), à luz do Do tipo S gigantes vermelhas . As estrelas estavam perto do fim de suas vidas, ainda eram ricos nesse elemento de curta duração, ou seja, reações nucleares no interior das estrelas deve ser produzi-lo. Esta evidência foi usada para reforçar a teoria não comprovada, em seguida, que as estrelas são onde nucleossíntese dos elementos mais pesados ocorre. Mais recentemente, tais observações forneceu provas de que os elementos foram sendo formado por captura de neutrões no s processo.
Desde a sua descoberta, tem havido muitas pesquisas em materiais terrestres por fontes naturais de tecnécio. Em 1962, tecnécio-99 foi isolado e identificado em pitchblende do Congo Belga em quantidades extremamente pequenas (cerca de 0,2 ng / kg); não se origina como uma produtos de fissão espontânea de urânio-238. Há também evidência de que o Oklo naturais reator de fissão nuclear produzido quantidades significativas de tecnécio-99, que desde então deteriorado em rutênio-99.
Características
Propriedades físicas
Tecnécio é um radioactivos-cinzento prateado de metal com uma aparência semelhante à de platina . É geralmente obtido na forma de um pó cinzento. O estrutura de cristal do metal puro é hexagonal close-embalados. Tecnécio Atômica tem a característica linhas de emissão para estes comprimentos de onda de luz: 363,3 nm, 403,1 nm, 426,2 nm, 429,7 nm, e 485,3 nm.
A forma de metal é ligeiramente paramagnética, ou seja, a sua dipolos magnéticos alinhar com externo Os campos magnéticos, mas irá assumir orientações aleatórias uma vez que o campo é removido. Pura, metálico, tecnécio torna-se um único cristal de um tipo II supercondutor a temperaturas inferiores a 7,46 K . Abaixo dessa temperatura, tecnécio tem uma muito alta profundidade de penetração magnética, o maior entre os elementos para além de nióbio .
Propriedades químicas
Tecnécio é colocado no sétimo grupo da tabela periódica, entre rénio e manganês . Como previsto pela lei periódica, as suas propriedades químicas são, portanto, intermediário entre esses dois elementos. Dos dois, o tecnécio se assemelha mais de perto rénio, particularmente da sua inércia química e tendência para formar ligações covalentes. Ao contrário de manganês, tecnécio não formam facilmente cátions ( íons com carga positiva). Comum estados de oxidação do tecnécio incluem 4, 5, e 7. Tecnécio dissolve em água régia, ácido nítrico , e concentrada de ácido sulfúrico , mas não é solúvel em ácido clorídrico de qualquer concentração.
E hidreto de óxidos
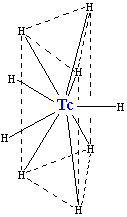
A reacção de tecnécio com hidrogénio produz o carregado negativamente hidreto TCH 2-
9 de iões, que tem o mesmo tipo de estrutura cristalina como (é isoestrutural com) ReH 2-
9. É constituída por um prisma triangular com um átomo de tecnécio no centro e seis átomos de hidrogênio nos cantos. Mais três átomos de hidrogénio fazer um triângulo encontra-se paralela à base e que cruza o prisma no seu centro. Embora esses átomos de hidrogénio não são equivalentes geometricamente, a sua estrutura electrónica é quase o mesmo. O complexo tem uma número de coordenação de 9 (o que significa que o átomo de tecnécio tem nove vizinhos), que é o mais alto para um complexo de tecnécio. Dois átomos de hidrogénio no complexo pode ser substituído por sódio (Na +) ou iões de potássio (K +).
Tecnécio metálico lentamente mancha no ar úmido, e em forma de pó, vai queimar no oxigênio . Dois óxidos têm sido observados: CO 2 e Tc 2 O 7. Sob condições de oxidação, que tendem a retirar electrões de átomos, tecnécio (VII) irá existir como o pertechnetate ion , TcO -
4.
No caso de temperaturas de 400-450 ° C, tecnécio oxida para formar o amarelo pálido heptoxide:
- 4 Tc + 7 O 2 → 2 Tc 2 O 7
Este composto adota uma centrossimétrico estrutura com dois tipos de Tc-O obrigações; os seus comprimentos de ligação são 167 e 184 pm, e o ângulo de O-Tc-O é de 180 °.
Tecnécio heptoxide é o precursor pertecnetato de sódio:
- Tc 2 O 7 + 2 NaOH → 2 Natco 4 + H2O
De cor preta dióxido de tecnécio (CO 2) pode ser produzido por redução do heptoxide com tecnécio ou hidrogénio.
Ácido Pertechnetic (HTCO 4) é produzido por reacção de Tc 2 O 7 com água ou ácidos oxidantes, tais como ácido nítrico , ácido sulfúrico concentrado, água régia, ou uma mistura de ácidos nítrico e clorídrico. O vermelho escuro resultante, higroscópico (absorve água) substância é um ácido forte e facilmente doa prótons. Em concentrada de ácido sulfúrico Tc (VII) converte anião tetraoxidotechnetate para a forma octaédrica de technetic (VII) de ácido 3 TcO (OH) (H2O) 2.
O pertecnato (tetroxidotechnetate) ânion TcO -
4 consiste de um tetraedro com oxigénios nos cantos e um átomo de tecnécio no centro. Ao contrário permanganato (MnO -
4), que é apenas um fraco agente de oxidação. Pertecnato é frequentemente utilizado como uma fonte solúvel em água conveniente de isótopos de tecnécio, tais como 99m Tc, e como um catalisador .
Sulfuretos, selenetos e teluretos
Formas de tecnécio vários sulfetos. TCS 2 é obtido por reacção directa de tecnécio e elementar de enxofre , enquanto Tc 2 S 7 é formado a partir do ácido pertechnic como se segue:
- 2 HTCO 4 + 7 H 2 S → Tc 2 S 7 + 8 H2O
Nesta reacção é tecnécio Tc reduzido para (IV), enquanto que o excesso de formas de enxofre um ligando dissulfureto. O tecnécio heptasulfide produzido tem uma estrutura polimérica (Tc 3 (μ 3-S) (S 2) 3 S 6) n com um núcleo semelhante ao Mo 3 (μ 3-S) (S2) 6 2-.
Após o aquecimento, tecnécio heptasulfide se decompõe em dissulfeto e enxofre elementar:
- Tc 2 S 7 → 2 TCS 2 + 3 S
Ocorrem reacções análogas com selénio e telúrio .
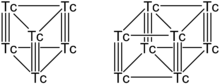
Carboneto de Tecnécio e fase de metal tecnécio ortorrômbica
Quando pequenas quantidades de carbono estão presentes em tecnécio metal, sua estrutura cristalina hexagonal ideal repleto de perto é distorcida para Orthorhombic estrutura metálica tecnécio. Maior teor de carbono (a partir de 15-17% em.) Fornecem a conversão completa de tecnécio metal para carboneto de tecnécio cúbica com composição aproximada de Tc6C. O aumento no teor de carbono não fornece qualquer mudança na estrutura de carboneto de tecnécio.
Clusters e complexos orgânicos
Vários grupos de tecnécio são conhecidos, incluindo Tc 4, Tc 6, 8 e Tc Tc 13. Os mais estáveis Tc Tc 6 e 8 clusters têm formas de prisma onde pares verticais de átomos de Tc são conectados por ligações triplas e os átomos planares por ligações simples. Cada átomo de tecnécio faz seis títulos, e os elétrons de valência restantes podem ser saturado por um axial e dois ponte ligando átomos de halogéneo, tais como cloro ou bromo .
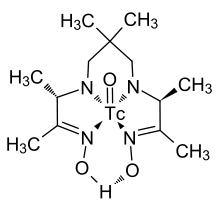
Formas de tecnécio numerosos complexos orgânicos, que são relativamente bem investigados devido à sua importância para a medicina nuclear. Carbonil tecnécio (Tc 2 (CO) 10) é um sólido branco. Nesta molécula, dois átomos de tecnécio são fracamente ligados um ao outro; cada átomo está rodeado por octaedros de cinco ligandos carbonilo. O comprimento da ligação entre os átomos de tecnécio, 303 pm, é significativamente maior do que a distância entre dois átomos de tecnécio metálico (272 pm). Semelhante carbonilos são formados por tecnécio de congéneres, manganês e rênio.
Um complexo de tecnécio com um ligante orgânico (mostrado na figura da direita) é comumente utilizado em medicina nuclear. Tem um único Tc-O grupo funcional (unidade) orientadas perpendicularmente ao plano da molécula, em que o átomo de oxigénio pode ser substituído por um átomo de azoto.
Isótopos
Tecnécio, com número atómico (denotado Z) 43, é o elemento de número mais baixo na tabela periódica que é exclusivamente radioactivo. O segundo-mais leve, exclusivamente elemento radioativo, promethium , tem um número atômico de 61. Os núcleos atômicos com um número ímpar de prótons são menos estáveis do que aqueles com até mesmo números, mesmo quando o número total de núcleons (prótons + nêutrons ) são mesmo. Odd elementos numerados, portanto, têm menos estáveis isótopos .
O mais estáveis isótopos radioactivos são tecnécio-98 com uma semi-vida de 4,2 milhões ano ( Ma), tecnécio-97 (meia-vida: 2.6 Ma) e tecnécio-99 (meia-vida: 211 mil anos). Trinta outros radioisótopos foram caracterizados com números de massa que variam de 85 a 118. A maioria destes tem uma meia-vida de menos de uma hora; as excepções são tecnécio-93 (semi-vida de 2,73 horas), tecnécio-94 (meia-vida: 4,88 horas), tecnécio-95 (meia-vida: 20 horas), e tecnécio-96 (semivida: 4,3 dias ).
O primário modo de decaimento de isótopos mais leves que o tecnécio-98 (98 Tc) é captura de elétrons, dando molibdênio (Z = 42). Para isótopos mais pesados, o principal modo é a emissão beta (a emissão de um electrão ou positrões), dando ruténio (Z = 44), com a excepção de que o tecnécio-100 pode decair tanto por emissão beta e por captura de electrões.
Tecnécio também tem numerosos isómeros nucleares, que são isótopos com uma ou mais nucleons animado. Tecnécio-97m (97m Tc; 'm' significa metastability) é a mais estável, com uma meia-vida de 91 dias (0,0965 MeV). Isto é seguido por tecnécio-95m (semi-vida: 61 dias, de 0,03 MeV), e tecnécio-99m (semi-vida: 6,01 hora, 0,142 MeV). Tecnécio-99m emite apenas raios gama e decai para tecnécio-99.
Tecnécio-99 (99 Tc) é um dos principais produtos da fissão do urânio-235 (235 L), tornando-se o isótopo mais comum e mais facilmente disponível de tecnécio. Um grama de tecnécio-99 produz 6,2 x 10 8 desintegrações por segundo (isto é, 0,62 g Bq / g).
Ocorrência e produção

Somente vestígios mínimos ocorrem naturalmente no Terra crosta como um espontâneo produtos de cisão em minérios de urânio. Um quilo de urânio contém cerca de 1 nanograma (10 -9 g) de tecnécio. Alguns gigantes vermelhas estrelas com os tipos espectrais S-, m-, e N contêm uma linha de absorção no seu espectro indica a presença de tecnécio. Estes-gigantes vermelhas são conhecidas informalmente como Estrelas de tecnécio.
Produto de resíduos de fissão
Em contraste com a sua ocorrência natural raro, grandes quantidades de tecnécio-99 são produzidas a cada ano a partir de barras de combustível irradiado, que contêm vários produtos de fissão. A cisão de um grama de urânio-235 em reactores nucleares produz 27 mg de tecnécio-99, dando uma tecnécio fissão rendimento do produto de 6,1%. Outro isótopos físseis também produzir rendimentos similares de tecnécio, tais como 4,9% a partir de urânio 233 e 6,21% a partir de plutônio-239. Sobre 49.000 t Bq (78 toneladas métricas) de tecnécio é estimada para ter sido produzido em reatores nucleares, entre 1983 e 1994, o que é, de longe, a principal fonte de tecnécio terrestre. Apenas uma fracção da produção é utilizado comercialmente.
Tecnécio-99 é produzido pela fissão nuclear de ambos urânio-235 e plutônio-239. Portanto, ela está presente em resíduos radioactivos e na precipitação nuclear de fissão bomba explosões. Sua decadência, medido em becquerel por quantidade de combustível irradiado, é dominante após cerca de 10 abril - 10 junho anos após a criação do lixo nuclear. De 1945 a 1994, um número estimado de 160 T Bq (cerca de 250 kg) de tecnécio-99 foi lançado no meio ambiente por atmosférico testes nucleares. A quantidade de tecnécio-99 a partir de reatores nucleares liberado no meio ambiente até 1986 é da ordem de 1.000 TBq (cerca de 1600 kg), principalmente por reprocessamento do combustível nuclear; a maior parte deste foi descarregada para o mar. Métodos de reprocessamento têm reduzido as emissões desde então, mas a partir de 2005 o lançamento primário de tecnécio-99 para o meio ambiente é pela Central de Sellafield, que divulgou uma estimativa de 550 TBq (cerca de 900 kg) 1.995-1.999 no Mar da Irlanda . A partir de 2000 o montante foi limitado pelo regulamento a 90 TBq (cerca de 140 kg) por ano. A descarga de tecnécio para o mar resultou em alguns frutos do mar contendo quantidades minúsculas de este elemento. Por exemplo, Lagosta Europeu e peixes de oeste Cumbria conter cerca de 1 Bq / kg de tecnécio.
Produtos de cisão para uso comercial
O isótopo metastável de tecnécio-99m é continuamente produzido como um produtos de cisão da fissão do urânio ou plutónio em reatores nucleares. Porque o combustível utilizado é deixada em repouso durante vários anos antes de reprocessamento, todos molibdénio-99 e tecnécio-99m vai ter deteriorado por o tempo que os produtos de cisão são separados dos grandes actinídeos em convencional reprocessamento nuclear. O líquido deixou após a extração de plutônio-urânio ( PUREX) contém uma elevada concentração de tecnécio como TcO -
4, mas quase tudo isso é tecnécio-99, não tecnécio-99m.
A grande maioria do tecnécio-99m utilizado no trabalho médico é produzido por irradiação dedicado altamente enriquecido o urânio em um reator, a extração de molibdênio-99 dos alvos em instalações de reprocessamento, e recuperando no centro de diagnóstico a-tecnécio-99m, que é produzida mediante decadência do molibdênio-99. Molibdénio-99 sob a forma de molibdato de MoO 2-
4 é adsorvido sobre alumina ácido (Al 2 O 3) em um blindado Coluna de cromatografia dentro de um gerador de tecnécio-99m ("vaca tecnécio", também ocasionalmente chamado de "vaca molibdênio"). Molibdénio-99 tem uma meia-vida de 67 horas, portanto, de curta duração, tecnécio-99m (semi-vida: 6 horas), que resulta da sua deterioração, está constantemente a ser produzidas. O solúvel pertechnetate TcO -
4 pode ser, em seguida, extraiu-se quimicamente por eluição utilizando um solução salina.
Ao irradiar um alvo de urânio altamente enriquecido para produzir molibdénio-99, não há necessidade para os passos químicos complexos que seria necessária para separar molibdénio a partir de uma mistura de produtos de cisão. A desvantagem deste processo é que ele requer alvos contendo urânio-235, que estão sujeitas às precauções de materiais físseis de segurança.
Quase dois terços da oferta mundial vem de dois reatores; o National Research Reactor Universal no Chalk River Laboratories em Ontário, Canadá, e do Reactor de alto fluxo em Nuclear Research and Consultancy Group em Petten, Países Baixos. Todos os principais reatores tecnécio-99m produtoras foram construídas na década de 1960 e estão perto do fim de sua vida útil. Os dois novos canadense Experimento reatores multipropósito Física Aplicada Malha planejada e construída para produzir 200% da demanda de tecnécio-99m aliviado todos os outros produtores de construir seus próprios reatores. Com o cancelamento dos reatores já testadas em 2008 o fornecimento futuro de tecnécio-99m tornou-se muito problemático.
No entanto, o reactor de Chalk River foi desligado para manutenção desde agosto de 2009, com uma reabertura esperado em abril de 2010, e do reactor de Petten teve uma parada programada de manutenção de 6 meses começando na sexta, 19 de fevereiro de 2010. Com milhões de procedimentos que dependem de tecnécio-99m cada ano, a baixa oferta deixou uma lacuna, deixando alguns médicos para reverter para técnicas que não são utilizados por 20 anos. Um pouco dissipar esta questão é um anúncio do polonês Maria reator de pesquisa que eles têm desenvolvido uma técnica para isolar tecnécio. O reator em Chalk River Laboratory reaberto em agosto de 2010 e do reactor de Petten reaberto Setembro de 2010.
Eliminação de resíduos
A meia-vida longa de tecnécio-99 e a sua capacidade para formar um aniónicos espécies faz com que seja uma das principais preocupações para a eliminação de longo prazo de resíduos radioactivos. Muitos dos processos concebidos para remover produtos de cisão em instalações de reprocessamento visam catiónicos como espécies de césio (por exemplo, césio-137) e estrôncio (por exemplo, estrôncio-90). Daí o pertecnetato é capaz de escapar através destes processos de tratamento. Opções de descarte atuais favorecem enterro no continental, rock geologicamente estável. O principal perigo com tal curso é que os resíduos é susceptível de entrar em contacto com a água, o que pode lixiviar contaminação radioactiva para o ambiente. O pertecnetato e aniónico iodeto de não adsorver bem sobre as superfícies dos minerais, de modo que eles são susceptíveis de ser lavados. Por comparação plutónio , urânio , e césio são muito mais capaz de se ligar às partículas do solo. Tecnécio também poderia ser imobilizado por alguns ambientes, tais como sedimentos do fundo do lago, devido à atividade microbiana; Por esta razão, a química ambiental de tecnécio é uma área activa de investigação.
Um método de disposição alternativa, transmutação, foi demonstrada em CERN para tecnécio-99. Este processo de transmutação é um em que o tecnécio (Tc-99 como um alvo de metal) é bombardeado com neutrões para formar o de curta duração tecnécio-100 (semi-vida = 16 segundos) que decai por decaimento beta de rutênio -100. Se a recuperação de rutênio utilizável é um objetivo, é necessário um alvo de tecnécio extremamente puro; se pequenos traços do actinídeos menores, como o amerício e cúrio estão presentes no alvo, que são susceptíveis de sofrer fissão e formar mais produtos de cisão que aumentam a radioactividade do alvo irradiado. A formação de ruténio-106 (semi-vida de 374 dias) a partir da 'fissão fresco "é susceptível de aumentar a actividade do metal ruténio final, que, em seguida, requerem um maior tempo de arrefecimento após a irradiação antes de o ruténio podem ser usados.
A separação real de tecnécio-99 de combustível nuclear irradiado é um processo longo. Durante reprocessamento de combustível, ele aparece no líquido de resíduos, o que é altamente radioativo. Após sentar-se por vários anos, a radioactividade cai para um ponto onde a extracção de isótopos de longa duração, incluindo tecnécio-99, torna-se viável. Vários processos de extracção químicos são então utilizados, produzindo tecnécio-99 de metal de elevada pureza.
Ativação com nêutrons
Molibdénio-99 pode ser formado pelo neutrões activação de molibdénio-98. Outros isótopos de tecnécio não são produzidos em quantidades significativas por fissão; quando necessário, eles são fabricados por irradiação neutrónica de isótopos parentais (por exemplo, tecnécio-97 pode ser feita por irradiação neutrónica de ruténio-96).
Os aceleradores de partículas
A viabilidade da produção de tecnécio-99m com o bombardeio de 22 MeV-próton de um alvo de molibdênio-100 em ciclotrões médicos após a 99m reacção 100 Mo (p, 2n) Tc foi demonstrado em 1971. As recentes escassez de médicos tecnécio-99m reacendeu o interesse em sua produção pelo bombardeio de prótons de isotopicamente enriquecido (> 99,5%) de molibdênio-100 alvos. Outras partículas técnicas de produção de isótopos baseada em acelerador têm sido investigados para obter molibdênio-99 de molibdênio-100 via (n, 2n) ou (γ, n) reações.
Aplicações
Medicina nuclear e biologia
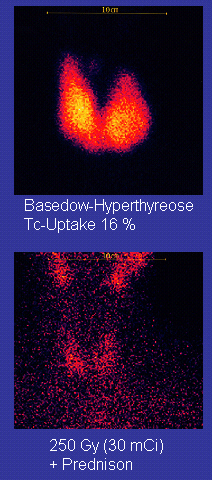
Tecnécio-99m ("m" indica que este é um isómero nuclear metaestável) é usado em isótopo radioactivo exames médicos, por exemplo como um marcador radioativo que equipamento médico pode detectar no corpo humano. É bem adequado para o papel porque emite prontamente detectável 140 keV raios gama, e a sua meia-vida é de 6,01 horas (o que significa que cerca de 94% de ele decai para tecnécio-99 em 24 horas). Há pelo menos 31 utilizada radiofármacos com base em tecnécio-99m para imagiologia e estudos funcionais do cérebro, miocárdio, tiróide, pulmões, fígado, vesícula biliar, rins , esqueleto, sangue , e tumores.
O isótopo de tecnécio-95m de vida mais longa, com uma meia-vida de 61 dias, é usado como um marcador radioactivo para estudar o movimento de tecnécio no ambiente e em sistemas de plantas e animais.
Industrial e química
Tecnécio-99 decai quase inteiramente por decaimento beta, que emite partículas beta com energias de baixo consistentes e sem raios gama de acompanhamento. Além disso, a sua meia-vida longa significa que esta emissão diminui muito lentamente com o tempo. Ele também pode ser extraído para um grau de pureza química e isotópica alta de resíduos radioactivos. Por estas razões, é um Instituto Nacional de Padrões e Tecnologia (NIST) emissor beta padrão, e é, portanto, utilizados para a calibração do equipamento. Tecnécio-99 também foi proposto para utilização em dispositivos optoelectrónicos e nanoescala baterias nucleares.
Como rénio e paládio , tecnécio pode servir como um catalisador . Para algumas reacções, por exemplo, a desidrogenação de álcool isopropílico, é um catalisador muito mais eficaz do que, quer o rénio ou o paládio. No entanto, a sua radioactividade é um grande problema em encontrar aplicações catalíticas seguras.
Quando o aço é imerso em água, adicionando uma pequena concentração (55 ppm) de pertecnetato de potássio (VII) para a água protege o aço contra a corrosão, mesmo que a temperatura é aumentada para 250 ° C. Por esta razão, pertecnetato tem sido utilizado como um possível anódica à corrosão inibidor de aço, embora a radioactividade do tecnécio coloca problemas que limitam esta aplicação para sistemas auto-contido. Enquanto (por exemplo) CrO 2-
4 pode também inibir a corrosão, que requer uma concentração dez vezes mais alta. Numa experiência, uma amostra de aço de carbono foi mantida em uma solução aquosa de pertecnetato de 20 anos e foi ainda não corroído. O mecanismo pelo qual o pertecnetato impede a corrosão não é bem compreendido, mas parece envolver a formação reversível de uma fina camada superficial. Uma teoria sustenta que o pertecnetato reage com a superfície do aço para formar uma camada de tecnécio dióxido de que impede a continuação da corrosão; o mesmo efeito explica como pó de ferro pode ser utilizado para remover água de pertecnetato. ( O carvão activado pode também ser usada para o mesmo efeito.) O efeito desaparece rapidamente se a concentração de pertecnetato cai abaixo da concentração mínima ou, se uma concentração demasiado elevada de outros iões é adicionado.
Como observado, a natureza de tecnécio radioactivo (3 H Bq por litro nas concentrações requeridas) torna esta proteção contra corrosão impraticável em quase todas as situações. No entanto, protecção contra a corrosão por iões pertecnetato foi proposto (mas nunca adoptada) para uso em reatores de água fervente.
Precauções
Tecnécio não desempenha nenhum papel biológico natural e não é normalmente encontrado no corpo humano. Tecnécio é produzida em quantidade por fissão nuclear, e se espalha mais facilmente do que muitos radionuclídeos. Parece ter baixa toxicidade química. Por exemplo, não houve mudança significativa na fórmula sangue, pesos corporais e dos órgãos, e o consumo de alimentos pode ser detectado por ratos que ingeriram até 15 ug de tecnécio-99 por grama de alimento durante várias semanas. A toxicidade radiológica de tecnécio (por unidade de massa) é uma função do composto, do tipo de radiação para o isótopo em questão, e uma meia-vida do isótopo.
Todos os isótopos de tecnécio devem ser manuseados com cuidado. O isótopo mais comum, tecnécio-99, é um fraco emissor beta; tal radiação é interrompida pelas paredes de vidro de laboratório. O perigo principal quando se trabalha com tecnécio é a inalação do pó; tal contaminação radioativa nos pulmões pode representar um risco significativo de câncer. Para a maioria dos trabalhos, manipulação cuidadosa em um exaustor é suficiente; um caixa de luva não é necessário.

