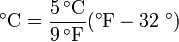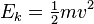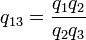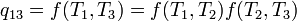Temperatura
Sobre este escolas selecção Wikipedia
Esta seleção é feita para as escolas de caridade infantil leia mais . Você quer saber sobre o patrocínio? Veja www.sponsorachild.org.uk
A temperatura é uma física propriedade de um sistema que está na base das noções comuns de quente e frio; algo que está mais quente tem geralmente a uma maior temperatura. Especificamente, a temperatura é uma medida da energia cinética de uma amostra de matéria. A temperatura é uma das principais parâmetros de termodinâmica . Na escala microscópica, a temperatura é definida como a energia média de movimentos de uma única partícula microscópicas no sistema de per grau de liberdade. Na escala macroscópica, a temperatura é a propriedade física singular que determina a direcção do fluxo de calor entre dois objectos colocados em contacto térmico. Se não ocorrer um fluxo de calor, os dois objectos têm a mesma temperatura; outra forma de calor flui do objeto mais quente para o objecto mais frio. Estes dois princípios básicos são demonstrados no lei zero e segunda lei da termodinâmica, respectivamente. Para um sólido, estas propostas microscópicas são principalmente as vibrações dos seus átomos de cerca de seus locais no sólido. Para um monatomic gás ideal, os movimentos microscópicos são os movimentos de translação das partículas de gás constituintes. Para um gás multiatomic, e vibracional o movimento de rotação deve ser incluído também.
A temperatura é medida com termómetros que pode ser calibrado para uma variedade de escalas de temperatura. Na maior parte do mundo (exceto para o Estados Unidos , Jamaica , e em alguns outros países), o grau Celsius escala é usado para a maioria dos fins de medição de temperatura. Todo o mundo científico (os EUA incluído) mede a temperatura utilizando a escala Celsius e temperatura termodinâmica usando o kelvin escala, que é apenas a escala Celsius deslocado para baixo, de modo que 0 K = -273,15 ° C, ou zero absoluto . Muitos campos de engenharia em os EUA, especialmente os de alta tecnologia, também usam as escalas Celsius e graus kelvin. No entanto, os Estados Unidos são o último grande país em que o escala de temperatura grau Fahrenheit é usado pela maioria dos leigos, da indústria, popular, meteorologia , e do governo. Outros campos de engenharia em os EUA também dependem da Escala Rankine (a escala Fahrenheit deslocado) ao trabalhar em disciplinas termodinâmicos-relacionados, tais como combustão.
Visão global
Intuitivamente, a temperatura é uma medida de como algo quente ou frio é, embora a forma mais imediata em que podemos medir isso, por sentir-lo, não é confiável, resultando no fenômeno da sentida a temperatura do ar, que pode ser diferente em diferentes graus de temperatura real. Ao nível molecular, a temperatura é o resultado do movimento de partículas que compõem uma substância. O aumento da temperatura como a energia desse movimento aumenta. O movimento pode ser o movimento de translação da partícula, ou a energia interna da partícula devido à vibração molecular ou a excitação de um electrão nível de energia. Embora o equipamento muito especializado de laboratório é necessária para detectar directamente os movimentos térmicos traducionais, colisões térmicas por átomos ou moléculas com pequenas partículas suspensas num fluido produz Movimento Browniano que pode ser visto com um microscópio convencional. Os movimentos térmicos de átomos são muito rápidos e temperaturas próximas do zero absoluto são obrigados a observá-los diretamente. Por exemplo, quando os cientistas no NIST conseguiu uma temperatura fria recorde de 700 nK (1 nK = 10 -9 K), em 1994, eles usaram treliça equipamento de laser óptico para adiabaticamente legal de césio átomos. Eles, então, desligado os lasers de aprisionamento de átomos e das velocidades medidas diretamente de 7 mm por segundo, a fim de calcular a sua temperatura.
As moléculas , tais como O2, têm mais graus de liberdade do que os átomos individuais: podem ter movimentos rotacionais e vibracionais, bem como movimento de translação. Um aumento na temperatura irá fazer com que a energia média para aumentar a translação. Isso também fará com que a energia associada com modos de vibração e rotação para aumentar. Assim, uma gás diatômico, com graus adicionais de liberdade de rotação e vibração, vai exigir um maior consumo de energia para alterar a temperatura por um determinado período, ou seja, terá uma maior capacidade de calor de um gás monoatómico.
O processo de arrefecimento envolve a remoção de energia a partir de um sistema. Quando não há mais energia capaz de ser removido, o sistema é dito ser a zero absoluto , que é o ponto sobre a (absoluta) escala de temperatura termodinâmico onde todo o movimento cinético nas partículas de matéria compreendendo cessa e que estão em repouso em completa a (não "clássico" da mecânica quântica sentido). Por definição, o zero absoluto é precisamente uma temperatura de 0 graus Kelvin (-273,15 ° C ou -459,67 ° F).
Detalhes
| Variáveis conjugadas da termodinâmica | |
|---|---|
| Pressão | Volume |
| ( Estresse) | ( Strain) |
| Temperatura | Entropy |
| Potencial químico | Número de partículas |
As propriedades formais de acompanhamento da temperatura a partir da sua definição matemática (ver abaixo a definição lei zero eo segundo definição da lei) e são estudadas em termodinâmica e mecânica estatística .
Ao contrário de outras grandezas termodinâmicas, tais como entropia e de calor , cujo definições microscópica são válidos mesmo longe do equilíbrio termodinâmico, a temperatura sendo uma energia média por partícula só pode ser definido no estado de equilíbrio termodinâmico, ou em equilíbrio termodinâmico menos locais (ver em baixo).
Como um sistema recebe calor, a sua temperatura sobe; Do mesmo modo, uma perda de calor a partir do sistema tende para diminuir a sua temperatura (no - incomum - excepção de temperatura negativo; ver abaixo).
Quando dois sistemas estão à mesma temperatura, não ocorre a transferência de calor entre eles. Quando uma diferença de temperatura existe, calor tendem a mover-se a partir do sistema -Temperatura mais elevada para o sistema -Temperatura inferior, até que eles estão em equilíbrio térmico. Esta transferência de calor pode ocorrer através condução, convecção ou radioterapia ou uma combinação de ambos (ver calor para discussão adicional dos vários mecanismos de transferência de calor) e alguns íons podem variar.
A temperatura também está relacionada com a quantidade de energia interna e entalpia de um sistema: quanto maior for a temperatura de um sistema, maior será a sua energia interna e entalpia.
A temperatura é um propriedade intensiva de um sistema, o que significa que não dependem do tamanho do sistema, a quantidade ou o tipo de material no sistema, o mesmo que para o pressão e densidade . Em contraste, a massa , o volume , e entropia são propriedades extensivas, e dependerá da quantidade de material no sistema.
O papel da temperatura na natureza

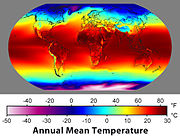
A temperatura desempenha um papel importante em quase todos os campos da ciência, incluindo a física, química e biologia.
Muitas propriedades físicas dos materiais, incluindo a fase ( sólido , líquido , gasoso ou de plasma ), a densidade , a solubilidade , pressão de vapor, e condutividade eléctrica depender da temperatura. A temperatura também desempenha um papel importante na determinação da taxa e extensão à qual as reacções químicas ocorram. Esta é uma das razões por que o corpo humano possui vários mecanismos elaborados para manter a temperatura a 37 ° C, desde que as temperaturas apenas alguns graus mais elevada pode resultar em reacções prejudiciais, com sérias consequências. A temperatura também controla o tipo e quantidade de radiação térmica emitida a partir de uma superfície. Uma aplicação deste efeito é o lâmpada incandescente de luz, em que um de tungsténio filamento é electricamente aquecido para uma temperatura à qual quantidades significativas de visível a luz é emitida.
Temperatura dependência da velocidade do som no ar c, de densidade do ar e ρ impedância acústica Z vs. temperatura ° C
| Impacto da temperatura na velocidade do som, a densidade do ar e da impedância acústica | |||
| T em ° C | c em m / s | ρ em kg / m | Z em N-s / m |
| -10 | 325.4 | 1.341 | 436,5 |
| -5 | 328,5 | 1.316 | 432,4 |
| 0 | 331.5 | 1.293 | 428,3 |
| 5 | 334.5 | 1.269 | 424.5 |
| 10 | 337,5 | 1.247 | 420,7 |
| 15 | 340,5 | 1.225 | 417,0 |
| 20 | 343,4 | 1.204 | 413.5 |
| 25 | 346,3 | 1.184 | 410,0 |
| 30 | 349.2 | 1.164 | 406,6 |
Medição de temperatura
A medição da temperatura usando moderna científica termômetros e escalas de temperatura remonta pelo menos até o início do século 18, quando Gabriel Fahrenheit adaptado um termômetro (mudar para o mercúrio ) e uma escala de ambos desenvolvidos pela Ole Christensen Rømer. Escala de Fahrenheit ainda está em uso, ao lado do Celsius escala eo kelvin escala.
Unidades de temperatura
A unidade básica de temperatura (símbolo: T) na Sistema Internacional de Unidades (SI) é o kelvin (símbolo: K). O kelvin e Celsius (centígrados) escamas são, por acordo internacional, definida por dois pontos: zero absoluto , e a ponto triplo da Viena Padrão Médio Ocean Water (água especialmente preparada com uma mistura especificada de isótopos de hidrogênio e oxigênio). Zero absoluto é definido como sendo precisamente 0 K e -273,15 ° C. O zero absoluto é o lugar onde tudo movimento cinético nas partículas que compreendem matéria cessa e eles estão em repouso completo no "clássico" (não quântica mecânica sentido). No zero absoluto, a matéria não contém energia térmica. Além disso, o ponto triplo da água é definida como sendo precisamente 273,16 K e de 0,01 ° C. Essa definição faz três coisas: 1) que corrige a magnitude da unidade kelvin como sendo precisamente uma parte em 273,16 partes a diferença entre zero absoluto e do ponto triplo da água; 2) que estabelece que um kelvin tem precisamente a mesma magnitude que um incremento de um grau na Celsius escala; e 3) que estabelece a diferença entre os pontos nulos as duas escalas "como sendo precisamente 273,15 kelvins (0 K = -273,15 ° C e 273,16 K = 0,01 ° C). As fórmulas para estas unidades de conversão que definem a temperatura para outras escalas podem ser encontradas em Fórmulas de conversão de temperatura.
No campo da física do plasma , por causa das altas temperaturas encontradas ea eletromagnética natureza dos fenômenos envolvidos, é habitual para expressar temperatura eletronvolts (eV) ou kiloelectronvolts (keV), em que 1 eV = 11.604 K. No estudo de QCD importa se reúne rotineiramente temperaturas da ordem de algumas centenas MeV, o equivalente a cerca de 10 12 K.
Para aplicações diárias, é muitas vezes conveniente usar-se a graus Celsius escala, em que 0 ° C corresponde à temperatura à qual a água congela e 100 ° C corresponde ao ponto de ebulição da água ao nível do mar. Nesta escala uma diferença de temperatura de 1 grau é o mesmo que a diferença de temperatura de 1 K, de modo que a escala é essencialmente a mesma que a escala Kelvin, mas compensado pela temperatura na qual a água congela (273,15 K). Assim, a seguinte equação pode ser usada para converter de graus Celsius para graus Kelvin.
No Estados Unidos , o Escala Fahrenheit é amplamente utilizado. Nesta escala, o ponto de congelação da água corresponde a 32 ° C e o ponto de ebulição de 212 ° F. A fórmula seguinte pode ser usada para converter de Fahrenheit para Celsius:
Ver fórmulas de conversão de temperatura para as conversões entre a maioria das escalas de temperatura.
Temperaturas negativas
Para alguns sistemas e definições específicas de temperatura, é possível obter um temperatura negativa. Um sistema com uma temperatura negativa não é mais frio do que o zero absoluto , mas sim que é, em certo sentido, mais quente do que temperatura infinito.
Comparação das escalas de temperatura
| Comente | Kelvin K | Celsius ° C | Fahrenheit ° F | Rankine ° Ra (R °) | Delisle ° D ¹ | Newton N ° | Réaumur ° R (° Ré, ° Re) ¹ | Rømer ° Rø (° R) ¹ |
|---|---|---|---|---|---|---|---|---|
| Do zero absoluto | 0 | -273,15 | -459,67 | 0 | 559,725 | -90,14 | -218,52 | -135,90 |
| Menor temperatura registrada naturais em terra ( Vostok, Antártica - 21 de julho de 1983) | 184 | -89 | -128 | 331 | 284 | -29 | -71 | -39 |
| Celsius / "cross-over" temperatura de Fahrenheit | 233,15 | -40 | -40 | 419,67 | 210 | -13,2 | -32 | -13.5 |
| Gelo mistura de Fahrenheit / sal | 255,37 | -17,78 | 0 | 459,67 | 176,67 | -5,87 | -14,22 | -1,83 |
| A água congela (na pressão normal) | 273,15 | 0 | 32 | 491,67 | 150 | 0 | 0 | 7,5 |
| Temperatura média da superfície da Terra | 288 | 15 | 59 | 519 | 128 | 5 | 12 | 15 |
| Média de temperatura do corpo humano ² | 310,0 ± 0,7 | 36,8 ± 0,7 | 98,2 ± 1,3 | 557,9 ± 1,3 | 94,8 ± 1,1 | 12,1 ± 0,2 | 29,4 ± 0,6 | 26,8 ± 0,4 |
| A mais alta temperatura da superfície gravada na Terra ( Al'aziziyah, Líbia - 13 de setembro de 1922) Mas que a leitura é consultado. | 331 | 58 | 136 | 596 | 63 | 19 | 46 | 38 |
| A água ferve (em pressão normal) | 373,15 | 100 | 212 | 672 | 0 | 33 | 80 | 60 |
| Gás chama | ~ 1773 | ~ 1500 | ~ 2732 | |||||
| Titanium derrete | 1941 | 1668 | 3034 | 3494 | -2352 | 550 | 1334 | 883 |
| O superfície do Sol | 5800 | 5526 | 9980 | 10440 | -8140 | 1823 | 4421 | 2909 |
1 A escala de temperatura está em desuso, e do mero interesse histórico.
2 Temperatura normal do corpo humano é de 36,8 ± 0,7 ° C, ou de 98,2 ± 1,3 ° C. O valor comumente dado 98.6 ° F é simplesmente a conversão exata do século XIX alemão padrão de 37 ° C. Uma vez que não listar uma faixa aceitável, poderia, portanto, ser dito ter excesso de precisão (inválida). Ver Temperatura de um humano saudável (temperatura corporal) para obter mais informações.
Alguns números deste quadro foram arredondados.
Fundamentação teórica da temperatura
Definição Zeroth-lei de temperatura
Enquanto a maioria das pessoas tem uma compreensão básica do conceito de temperatura, sua definição formal é bastante complicado. Antes de saltar para uma definição formal, vamos considerar o conceito de o equilíbrio térmico. Se dois sistemas com volumes fixos são reunidos em contato térmico, as mudanças provavelmente irá ter lugar nas propriedades de ambos os sistemas. Estas mudanças são causadas pela transferência de calor entre os sistemas. Um estado deve ser atingida em que não houver mais mudanças, para colocar os objetos em equilíbrio térmico.
Uma base para a definição de temperatura pode ser obtido a partir da lei zero da termodinâmica que afirma que se dois sistemas, A e B, estão em equilíbrio térmico e um terceiro sistema C está em equilíbrio térmico com o sistema A, em seguida, os sistemas de B e C também estará em equilíbrio térmico (de estar em equilíbrio térmico é um transitivo relação; Além disso, é uma relação de equivalência ). Este é um fato empírico, baseado na observação ao invés de teoria. Uma vez que A, B, e C são todos em equilíbrio térmico, é razoável dizer cada um destes sistemas de partilha um valor comum de alguma propriedade. Chamamos isso de temperatura propriedade.
Geralmente, não é conveniente colocar quaisquer dois sistemas arbitrários em contacto térmico para ver se eles estão em equilíbrio térmico e, portanto, têm a mesma temperatura. Além disso, seria apenas fornecer uma escala ordinal.
Portanto, é útil estabelecer uma escala de temperatura com base nas propriedades de algum sistema de referência. Em seguida, um dispositivo de medição pode ser calibrado com base nas propriedades do sistema de referência e utilizados para medir a temperatura de outros sistemas. Um tal sistema de referência é uma quantidade fixa do gás. O lei dos gases ideais indica que o produto da pressão e do volume (P · V) de um gás é directamente proporcional à temperatura:
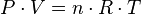 (1)
(1)
onde 'T é a temperatura, n é o número de moles de gás e R é a constante de gás. Assim, pode-se definir uma escala de temperatura com base na pressão e volume do gás correspondente: a temperatura em graus Kelvin, é a pressão em pascais de uma mole de gás de um recipiente de um metro cúbico, divididos por 8,31 ... Na prática , tal termómetro de gás não é muito conveniente, mas outros instrumentos de medição pode ser calibrado para esta escala.
É também interessante notar que a pressão, volume e o número de moles de uma substância são inerentemente maior do que ou igual a zero. Isto sugere que a temperatura também deve ser maior do que ou igual a zero. Como uma questão prática, não é possível usar um termómetro para medir a temperatura do gás de zero absoluto, uma vez que os gases tendem a condensar-se em um longo líquido antes de a temperatura atingir zero. É possível extrapolar quantos graus abaixo da temperatura actual do zero absoluto é da gama de temperatura em que a Equação 1 funciona.
A temperatura nos gases
Para um gás ideal a teoria cinética dos gases utiliza mecânica estatística para relacionar a temperatura para a energia cinética média dos átomos no sistema. Esta energia média é independente da massa de partículas, o que parece um contra-senso para muitas pessoas. Temperatura está relacionada apenas com a energia cinética média das partículas em um gás - cada partícula tem a sua própria energia que podem ou não correspondem à média; a distribuição de energias (e, portanto, velocidades) das partículas em qualquer gás são dadas pela Distribuição de Maxwell-Boltzmann. A temperatura de um gás ideal está relacionada com a sua energia cinética média através da equação:
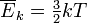 , Onde
, Onde 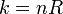 (N = número de moles, R = constante de gás ideal).
(N = número de moles, R = constante de gás ideal).
No caso de um gás monoatômico, a energia cinética é:
(Note-se que um cálculo da energia cinética de um objeto mais complicadas, tal como uma molécula, é ligeiramente mais envolvido. Adicional graus de liberdade são disponíveis, de modo a rotação molecular ou vibração devem ser incluídos.)
A segunda lei da termodinâmica afirma que quaisquer dois sistemas dadas quando interagindo uns com os outros mais tarde irá alcançar a mesma energia média por partícula (e, portanto, a mesma temperatura). Em uma mistura de partículas de várias massa, as partículas mais pesadas se moverá mais lentamente do que os homólogos mais leves, mas ainda terão a mesma energia média. Um néon átomo se move mais lentamente em relação a um hidrogênio molécula da mesma energia cinética; uma partícula de pólen se move em um lento Movimento browniano entre as moléculas de água em movimento rápido, etc. Uma ilustração visual deste de Oklahoma State University, faz o ponto mais claro. As partículas com massa diferente têm diferentes distribuições de velocidade, mas a energia cinética média é a mesma por causa da lei do gás ideal.
Temperatura do vácuo
É possível usar a lei zero definição de temperatura para atribuir a uma temperatura algo que normalmente não se associam com temperaturas, como um vácuo perfeito. Porque todos os objectos emitem radiação de corpo negro, um termômetro em um vácuo longe de irradiando termicamente fontes irá irradiar longe a sua própria energia térmica; diminuição da temperatura indefinidamente até que ele atinja a limite de energia do ponto zero. Nesse momento pode-se dizer para estar em equilíbrio com o vácuo e, por definição, à mesma temperatura. Se pudéssemos encontrar um gás que se comportou idealmente todo o caminho até o zero absoluto da teoria cinética dos gases diz-nos que iria atingir zero, a energia cinética por partícula, e, assim, alcançar a temperatura do zero absoluto. Assim, pela lei zero um perfeito, isolado a vácuo é a temperatura do zero absoluto. Note-se que, de modo a comportar-se de preferência, neste contexto, é necessário que os átomos do gás ter nenhuma energia do ponto zero. Ele vai sair não importa que isso não é possível porque a segunda definição lei da temperatura irá produzir o mesmo resultado para qualquer estado de vácuo único.
Mais realisticamente, não existe tal vácuo ideal. Por exemplo, um termómetro numa câmara de vácuo que é mantido a uma temperatura finito (por exemplo, câmara é no laboratório, à temperatura ambiente) irá equilibrar-se com a radiação térmica que recebe a partir da câmara e com o tempo atinge a temperatura da câmara. Se um termómetro orbitando a Terra é exposto a uma luz solar , em seguida, ele equilibra-se à temperatura à qual a energia recebida pelo termómetro do Sol é exactamente igual à potência irradiada para fora por radiação térmica do termómetro. Para um corpo negro esta temperatura de equilíbrio é de cerca de 281 K (8 ° C). A temperatura média da Terra (que é mantido pelo equilíbrio similar) está próximo a esta temperatura.
Um termômetro isolado da radiação solar (na sombra da Terra, por exemplo) ainda é exposta a radiação térmica da Terra -, portanto, irá mostrar alguma temperatura de equilíbrio em que ele recebe e irradia igual quantidade de energia. Se esse termômetro está perto da Terra, em seguida, sua temperatura de equilíbrio é de cerca de 236 K (-37 ° C), desde que a superfície da Terra é a 281 K.
Um termômetro longe do sistema solar ainda recebe radiação cósmica de fundo em microondas . Temperatura de equilíbrio de tais termómetro é de cerca de 2,725 K, que é a temperatura de um gás que constitui o corpo de fotões radiação de fundo preto no presente estado de expansão do universo. Esta temperatura é por vezes referida como a temperatura do espaço.
Definição de segunda lei da temperatura
Na seção anterior, a temperatura foi definida em termos da Lei Zero da termodinâmica. Também é possível definir a temperatura em termos da segunda lei da termodinâmica , que trata da entropia . A entropia é uma medida da desordem num sistema. A segunda lei estabelece que qualquer processo resultará em nenhuma mudança ou um aumento líquido na entropia do universo. Isso pode ser entendido em termos de probabilidade. Considere uma série de lançamentos de moeda. Um sistema perfeitamente ordenado seria aquele em que quer cada lance der cara ou a cada lance der coroa. Isto significa que para um conjunto perfeitamente ordenada de lançamentos de moeda, não é apenas um conjunto de lance resultados possíveis: o conjunto no qual 100% dos lançamentos vieram acima do mesmo.
Por outro lado, existem várias combinações que podem resultar em sistemas desordenados ou mistos, em que algumas fracções são cabeças e as caudas de descanso. Um sistema desordenada pode ser de 90% e 10% cabeças caudas, ou pode ser de 40% e 60% cabeças caudas, et cetera. À medida que o número de tosses moeda aumenta, o número de possíveis combinações correspondendo a imperfeitamente ordenada aumentos sistemas. Para um grande número de lançamentos de moeda, o número de combinações correspondendo a ~ 50% de cabeças e caudas ~ 50% e domina a obtenção de um resultado significativamente diferente de 50/50 torna-se extremamente improvável. Assim, o sistema avança para um estado natural de desordem máximo ou entropia.
Nós dissemos anteriormente que a temperatura controla o fluxo de calor entre dois sistemas e acabamos de mostrar que o universo, e que seria de esperar qualquer sistema natural, tende a progredir de forma a maximizar a entropia. Assim, seria de esperar que haja alguma relação entre temperatura e entropia. A fim de encontrar em primeiro lugar considerar a relação dessa relação de let entre calor, trabalho e temperatura. A motor de calor é um dispositivo para converter calor em trabalho mecânico e de análise do Máquina térmica de Carnot fornece as relações necessárias que buscamos. O trabalho de um motor de calor corresponde à diferença entre o calor introduzido no sistema a uma temperatura elevada, q H e o calor ejectado a baixa temperatura, q C. A eficiência do trabalho é dividido pelo calor introduzido no sistema ou:
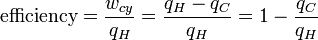 (2)
(2)
onde w cy é o trabalho feito por ciclo. Vemos que a eficiência depende apenas q C / q H. Porque q C e q H correspondem à transferência de calor nas temperaturas T e T C H, respectivamente, C q / q H deve ser uma função destas temperaturas:
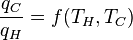 (3)
(3)
Teorema de Carnot estabelece que todos os motores reversíveis que operam entre os mesmos reservatórios de calor são igualmente eficientes. Assim, um motor de calor que opera entre T 1 e T 3 tem de ter a mesma eficiência que uma consiste em dois ciclos, um entre T 1 e T 2, e a segunda entre T 2 e T 3. Isto só pode ser o caso se:
o que implica:
Uma vez que a primeira função é independente de T 2, esta temperatura tem de cancelar no lado direito, ou seja, F (t 1, t 3) é da forma g (T 1) / g (T 3) (isto é, f (t 1, T 3) = f (t 1, t 2) f (t 2, t 3) = G (T 1) / g (T 2) · g (T 2) / g (T 3) = G (T 1) / g (T 3)), em que g é uma função de uma única temperatura. Agora podemos escolher uma escala de temperatura com a propriedade de que:
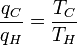 (4)
(4)
Substituindo a equação 4 de volta para a Equação 2 dá um relacionamento para a eficiência em termos de temperatura:
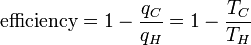 (5)
(5)
Note-se que para o t C = 0 K é a eficiência de 100% e que a eficiência torna-se maior do que 100% abaixo de 0 K. Como um rendimento superior a 100% viola a primeira lei da termodinâmica, este implica que 0 K é a temperatura mínima possível. Na verdade, a temperatura mais baixa já obtido em um sistema macroscópico foi de 20 nK, o que foi conseguido em 1995 no NIST. Subtraindo o lado direito da equação 5 da parte média e reorganizando dá:
onde o sinal negativo indica calor ejetado do sistema. Esta relação sugere a existência de uma função de estado, S, definido por:
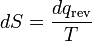 (6)
(6)
onde o subscrito indica um processo reversível. A alteração desta função de estado em torno de qualquer ciclo é igual a zero, como é necessário para qualquer função de estado. Esta função corresponde à da entropia do sistema, o que foi descrito anteriormente. Podemos reorganizar Equação 6 para obter uma nova definição de temperatura em termos de entropia e de calor:
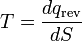 (7)
(7)
Para um sistema, em que a entropia S pode ser uma função S (E) da sua energia E, a temperatura T é dado por:
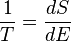 (8)
(8)
isto é. o reciproco da temperatura é a taxa de aumento de entropia no que diz respeito à energia.

![\ Mathrm {K = [^ \ circ C] \ left (\ frac {1 \, K} {1 \, ^ \ circ C} \ right) + 273,15 \, K}](../../images/134/13419.png)