
Estanho
Você sabia ...
Crianças SOS, uma instituição de caridade educação , organizou esta selecção. patrocínio SOS Criança é legal!
| Estanho | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
50 Sn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
prateado (à esquerda, beta) ou cinza (à direita, alfa)  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | estanho, Sn, 50 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / t ɪ n / | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | metais de transição pós- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 14, 5, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 118,710 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Kr ] 4d 10 5s 2 5p 2 2, 8, 18, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | em torno de 3500 aC | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | (Branco) 7,365 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | (Cinza) 5,769 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 6,99 g cm -3 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 505,08 K , 231,93 ° C, 449,47 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 2875 K, 2602 ° C, 4716 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | (Branco) 7,03 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | (Branco) 296,1 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | (Branco) 27,112 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 4, 3, 2, 1, -4 ( óxido anfotérico) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,96 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 708,6 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2: 1411,8 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 2943,0 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 139 ± 16:00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 217 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | tetragonal  branco | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| diamante cúbico cinza | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | (Cinza) diamagnetic, (branco) paramagnético | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (0 ° C) 115 Nco · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 66,8 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) de 22,0 pM · · K -1 m -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | ( RT) (laminado) 2730 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | 50 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 18 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | 58 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0.36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | ~ 350 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-31-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de estanho | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O estanho é um elemento químico com o símbolo Sn (para Latin : stannum) e número atômico 50. É um principal grupo de metal em grupo 14 da tabela periódica . Tin mostra semelhança química tanto vizinha grupo-14 elementos, germânio e conduzir e tem dois possíveis estados de oxidação +2, ea ligeiramente mais estável 4. O estanho é o elemento mais abundante 49 e tem, com 10 isótopos estáveis, o maior número de estáveis isótopos na tabela periódica. Tin é obtido principalmente a partir do mineral cassiterite, onde ocorre como dióxido de estanho, SnO 2.
Este prateado, maleável de metal pós-transição não é fácil oxidado em ar e é utilizada para revestir outros metais para evitar a corrosão . O primeiro liga, usado em grande escala desde 3000 aC, foi bronze, uma liga de estanho e cobre . Após 600 aC estanho metálico puro foi produzido. De estanho, que é uma liga de 85-90% de estanho sendo o restante constituído por cobre normalmente, antimónio e chumbo, foi usado para talheres da Idade do Bronze até o século 20. Nos tempos modernos, o estanho é utilizado em muitas ligas, especialmente de estanho / chumbo macio soldas, contendo tipicamente 60% ou mais de estanho. Outra grande aplicação para o estanho é resistente à corrosão tin chapeamento de aço. Devido à sua baixa toxicidade, estanhado de metal é também usado para embalagens de alimentos, que dá o nome de latas, que são feitos principalmente de aço.
Características
Propriedades físicas

O estanho é um maleável, dúctil e altamente cristalino branco-prateado de metal . Quando uma barra de estanho é quebrada, um ruído de crepitação conhecido como estanho grito pode ser ouvido devido ao geminação de cristais. Tin funde a uma baixa temperatura de cerca de 232 ° C (449,6 ° F), o que é ainda mais reduzido para 177,3 ° C (351 ° F) para as partículas de 11 nm.
β-estanho (na forma metálica, ou estanho branco), que é estável à temperatura ambiente e acima, é maleável. Em contraste, α-estanho (forma não metálico, ou estanho cinzento), o que é estável abaixo de 13,2 ° C (56 ° F), é quebradiço. α-estanho tem uma diamante cúbico estrutura cristalina, semelhante a diamante , silício ou germânio . α-lata não tem propriedades metálicas em todos, porque seus átomos formam uma estrutura covalente onde os elétrons não podem circular livremente. É um material em pó maçante-cinza sem usos comuns, com excepção de alguns especializados semicondutores aplicações. Estes dois alótropos , α-β-estanho e estanho, são mais comumente conhecidos como tin tin cinza e branco, respectivamente. Mais duas formas alotrópicas, γ e σ, existe a temperaturas acima de 161 ° C (322 ° F) e pressões acima de várias GPa. Em condições de frio, β-lata tende a transformar-se espontaneamente em α-estanho, um fenômeno conhecido como " estanho de pragas ". Embora a temperatura de transformação α-β é, nominalmente, 13,2 ° C, as impurezas (por exemplo, Al, Zn, etc.) diminuir a temperatura de transição bem abaixo de 0 ° C (32 ° F), e após a adição de Sb ou Bi o a transformação não pode ocorrer de todo, aumentando a durabilidade da lata.
Graus comerciais de estanho (99,8%) resistir transformação devido ao efeito inibidor das pequenas quantidades de bismuto, antimónio, chumbo e prata presentes como impurezas. Elementos de liga, tais como o cobre, antimónio, bismuto, cádmio e prata aumentar a sua dureza. Tin tende bastante facilidade para formar, fases intermetálicas frágeis duros, que são muitas vezes indesejável. Não forma ampla gama de soluções sólidas em outros metais em geral, e existem poucos elementos que têm solubilidade sólida apreciável em lata. Simples sistemas eutéticos, no entanto, ocorrer com bismuto , gálio , chumbo , tálio e zinco .
Estanho torna-se um supercondutor abaixo 3,72 K . Na verdade, de estanho foi um dos primeiros supercondutores a ser estudado; o Efeito Meissner, uma das características de supercondutores, foi descoberto pela primeira vez em supercondutores cristais de estanho.
Propriedades químicas
Tin resiste à corrosão de água mas pode ser atacado por ácidos e álcalis. Estanho pode ser altamente polido e é usado como um revestimento protector para outros metais. Neste caso, a formação de uma camada de óxido de protecção é utilizado para evitar a oxidação adicional. Formulários Esta camada de óxido de estanho e outras ligas de estanho. Tin atua como um catalisador quando o oxigênio está em solução, acelerando o ataque químico.
Isótopos
O estanho é o elemento com o maior número de isótopos estáveis , dez; Estes incluem todos aqueles com massas atómicas entre 112 e 124, com a excepção de 113, 121 e 123. Destes, os mais abundantes são 120 Sn (em cerca de um terço de todos os estanho), 118 Sn, 116 Sn e, enquanto o menos abundante é 115 Sn. Os isótopos que possuem mesmo números de massa não têm spin nuclear enquanto os ímpares têm um spin de +1/2. Tin, com os seus três isótopos comuns Sn 115, 117 e 119 Sn Sn, está entre os elementos mais fáceis de detectar e analisar por espectroscopia de RMN , e sua Os desvios químicos são referenciados contra SNME 4.
Esta grande número de isótopos estáveis é pensado para ser um resultado directo de estanho possuindo um número atómico de 50, que é um " número mágico "em física nuclear. Há 28 isótopos instáveis adicionais que são conhecidos, abrangendo todos os restantes com massas atómicas entre 99 e 137. Além de 126 Sn, que tem uma semi-vida de 230 mil anos, todos os isótopos radioactivos têm uma meia-vida de menos de um ano. A radioativo 100 Sn é um dos poucos nuclidos que possuem um " duplamente mágica "núcleo e foi descoberto há relativamente pouco tempo, em 1994. Outros 30 metaestáveis isómeros foram caracterizados por isótopos entre 111 e 131, o mais estável do que o ser 121m Sn, com uma semi-vida de 43,9 anos.
Etimologia
A palavra Inglês "lata" é Germânica; palavras relacionadas são encontradas em outro germânico idiomas- alemão Zinn, Tenn sueco, holandês estanho, etc. -mas não em outros ramos da Indo-Europeu, exceto por meio de empréstimos (por exemplo, Tinne irlandês). Sua origem é desconhecida.
O Latin nome stannum originalmente significava uma liga de prata e chumbo, e passou a significar 'tin' no BCE-da palavra latina início do século quarto para ele foi plumbum candidum 'branco de chumbo ". Stannum aparentemente veio de uma Stagnum anterior (ou seja, o mesma substância), a origem do Romance and Termos celtas para 'lata'. A origem de stannum / Stagnum é desconhecida; pode ser pré- Indo-Europeia. A Meyers Konversationslexikon especula sobre o contrário, que é derivado de stannum Cornish stean, e é prova de que Cornwall no primeiro séculos AD era a principal fonte de estanho.
História

Extração de estanho e uso pode ser datada de inícios da Idade do Bronze por volta de 3000 aC, quando foi observado que cobre formado por objetos polymetallic minérios com diferentes teores de metais tinham diferentes propriedades físicas. Os primeiros objectos de bronze de estanho tinha arsénio ou conteúdo de menos do que 2% e, portanto, acredita-se ser o resultado de não intencional liga devido a rastrear conteúdo de metal no minério de cobre. A adição de um segundo metal de cobre aumenta a sua dureza, baixa a temperatura de fusão, e melhora a processo de fundição, produzindo uma fusão mais líquido que resfria a, um metal menos esponjoso mais denso. Esta foi uma importante inovação que permitiu as formas muito mais complexos expressos em fechado moldes da Idade do Bronze. Objetos de bronze arsenical aparecem em primeiro lugar no Oriente Próximo onde o arsênico é comumente encontrada em associação com minério de cobre, mas o riscos para a saúde foram rapidamente percebeu ea busca de fontes de minérios de estanho muito menos perigosos começou no início da Idade do Bronze. Isto criou a demanda por rara lata de metal e formaram um comércio rede que ligava as fontes distantes de estanho para os mercados da Idade do Bronze culturas .
Cassiterita (SnO 2), a forma de óxido de estanho de estanho, era mais provável que a fonte original de estanho nos tempos antigos. Outras formas de minérios de estanho são menos abundantes sulfuretos, tais como stannite que requerem uma mais envolvidos processo de fundição. Cassiterite frequentemente se acumula nas canais aluviais como depósitos placer devido ao fato de que é mais difícil, mais pesado e mais quimicamente resistentes do que o granito em que ele normalmente faz. Estes depósitos podem ser facilmente visto nas margens de rios como cassiterita é geralmente preto, roxo ou outra forma de cor escura, um recurso explorado pelos primeiros Idade do Bronze garimpeiros . É provável que os primeiros depósitos foram aluvião na natureza, e talvez explorado pelos mesmos métodos usados para panning ouro em depósitos placer.
Compostos e química
Na grande maioria dos seus compostos, estanho tem o estado de oxidação II ou IV.
Compostos inorgânicos
Compostos de iodetos são conhecidos por ambos os estados de oxidação. Para Sn (IV), todos os quatro halogenetos são bem conhecidos: SnF 4, SnCl4, SNBR 4, e SNI 4. Os três membros mais pesados são compostos moleculares voláteis, enquanto que o tetrafluoreto é polimérica. Todos os quatro halogenetos são conhecidos para Sn (II) também: SnF 2, SnCl2 , SNBR 2, e SNI 2. Todos os sólidos são poliméricos. Destas oito compostos, apenas os iodetos são coloridos.
Cloreto de estanho (II) (também conhecido como cloreto estanoso) é o halogeneto de estanho mais importante no sentido comercial. Ilustrando as rotas para tais compostos, o cloro reage com a lata de metal para dar SnCl4 enquanto que a reacção de ácido clorídrico e de estanho dá SnCl2 e gás hidrogénio. Alternativamente SnCl 4 e Sn combinam-se para cloreto de estanho por meio de um processo chamado comproporcionação:
- SnCl4 + Sn → 2 SnCl2
Tin pode formar muitos óxidos, sulfetos, e outros derivados calcogenetos. O dióxido de SnO 2 (cassiterite) formas de estanho quando é aquecida na presença de ar . SnO 2 é anfotérico, o que significa que ela se dissolve em ambas soluções acídicas e básicas. Há também estanatos com a estrutura [Sn (OH) 6] 2-, como K 2 [Sn (OH) 6], embora o ácido livre de estanho H 2 [Sn (OH) 6] é desconhecido. O sulfuretos de estanho existem em ambos os 2 e os 4 estados de oxidação: estanho (II) e sulfureto estanho (IV), sulfureto ( ouro mosaico).
Hidretos
Estanano (SnH 4), onde é de estanho no estado de oxidação +4, é instável. Hidretos de organo-estanho são, no entanto bem conhecido, por exemplo, hidreto de tributil-estanho (Sn (C 4 H 9) 3 H). Estes radicais de libertação composto transiente tributil estanho, raros exemplos de compostos de estanho (III).
Compostos organoestânicos
Compostos orgânicos de estanho, às vezes chamados estananos, são compostos químicos com títulos tin-carbono. De entre os compostos de estanho, os derivados orgânicos são os comercialmente mais útil. Alguns compostos de organo-estanho são extremamente tóxicos e têm sido utilizados como biocidas. O primeiro composto de organo-estanho deve ser relatado foi diiodeto diethyltin ((C 2 H 5) 2 SNI 2), relatado por Edward Frankland em 1849.
A maioria dos compostos de organo-estanho são líquidos incolores ou sólidos que são estáveis ao ar e à água. Eles adotam geometria tetraédrica. Compostos Tetraalkyl- tetraaryltin e podem ser preparados usando Reagentes de Grignard:
- SnCl 4 + 4 RMgBr → R 4 Sn + 4 MgBrCl
Os haleto de alquilo mistos, que são mais comum e mais importante do que os derivados comercialmente tetraorgano, são preparados pela redistribuição reações:
- SnCl4 + R4 Sn → 2 SnCl2 R2
Compostos orgânicos de estanho bivalente são incomuns, embora mais comum do que bivalente relacionado organogermanium e compostos orgânicos de silício. A maior estabilização apreciado por Sn (II) é atribuído ao " . efeito par inerte "Organoestânicos compostos (II) incluem ambos os stannylenes (fórmula: R 2 Sn, como visto para singuleto carbenos) e distannylenes (R4 Sn 2), que são mais ou menos equivalentes aos alcenos . Ambas as classes exibem reacções invulgares.
Ocorrência


O estanho é gerado através do longo S-processo em estrelas de baixa a média de massa (com massas de 0,6-10 vezes a do Sol ). Ela surge via decaimento beta de isótopos pesados de índio .
O estanho é o elemento mais abundante 49 na Terra 's crosta , o que representa 2 ppm em comparação com 75 ppm para o zinco, 50 ppm para o cobre, e 14 ppm para o chumbo.
O estanho não ocorrer como o elemento nativo, mas deve ser extraído de diversos materiais. Cassiterite (SnO 2) é a única fonte de estanho comercialmente importante, embora pequenas quantidades de estanho são recuperados a partir de complexo sulfuretos, tais como stannite, cilindrita, franckeite, canfieldite, e teallite. Os minerais com estanho são quase sempre associada com granito rocha, geralmente a um nível de 1% de teor de óxido de estanho.
Devido à gravidade específica mais elevada de dióxido de estanho, cerca de 80% de estanho é extraído a partir de depósitos secundários encontrados jusante dos veios primários. O estanho é frequentemente recuperada a partir de grânulos lavados jusante no passado e depositado nos vales ou sob mar. As formas mais econômicas de estanho mineração são através dragagem, os métodos hidráulicos ou mineração a céu aberto. A maioria do estanho do mundo é produzida a partir de depósitos placer, que podem conter tão pouco quanto 0,015% de estanho.
| País | Reservas |
|---|---|
| | 1500000 |
| | 250.000 |
| | 310.000 |
| | 800.000 |
| | 590.000 |
| | 400.000 |
| 350.000 | |
| | 170.000 |
| | 180.000 |
| Outro | 180.000 |
| Total | 4800000 |
Cerca de 253 mil toneladas de estanho foram minadas em 2011, principalmente na China (110 mil t), Indonésia (51.000 t), Peru (34,6 mil t), Bolívia (20.700 t) e no Brasil (12.000 t). As estimativas de produção de estanho têm historicamente variado com a dinâmica de viabilidade econômica e no desenvolvimento de tecnologias de exploração mineira, mas estima-se que, a taxas atuais de consumo e tecnologias, a Terra vai ficar sem estanho que pode ser extraído em 40 anos. No entanto estanho Lester Brown sugeriu poderia correr para fora dentro de 20 anos com base em uma extrapolação extremamente conservadora de crescimento de 2% ao ano.
| Ano | Milhões de toneladas |
|---|---|
| 1965 | 4265 |
| 1970 | 3930 |
| 1975 | 9060 |
| 1980 | 9100 |
| 1985 | 3060 |
| 1990 | 7100 |
| 2000 | 7100 |
| 2010 | 5200 |
A sucata, de estanho é também uma importante fonte de metal. A recuperação de estanho através da produção secundária, ou reciclagem de sucata de lata, está aumentando rapidamente. Considerando que os Estados Unidos nem extraído desde 1993, nem fundidas estanho desde 1989, foi o maior produtor secundário, a reciclagem de cerca de 14.000 toneladas em 2006.
Novos depósitos estão a ser reportados no sul da Mongólia , e, em 2009, novos depósitos de estanho foram descobertos na Colômbia, América do Sul, pela Seminole Grupo CI Colômbia, SAS.
Produção
O estanho é produzido pela redução carbotérmica de o óxido de minério com carbono ou coque. Tanto forno e reverberatory forno eléctrico pode ser usado.
Mineração e fundição
Indústria

As dez maiores empresas produziram mais de estanho do mundo em 2007. Não está claro qual destas empresas incluem estanho fundido a partir da mina em Bisie, República Democrática do Congo, que é controlado por uma milícia rebelde e produz 15.000 toneladas. A maioria de estanho do mundo é comercializado no London Metal Exchange (LME), a partir de 8 países, menos de 17 marcas.
| Companhia | Governo | 2006 | 2007 | % Variação |
|---|---|---|---|---|
| Yunnan Tin | China | 52.339 | 61.129 | 16,7 |
| PT Timah | Indonésia | 44.689 | 58.325 | 30,5 |
| Minsur | Peru | 40.977 | 35.940 | -12.3 |
| Malaio | China | 52.339 | 61.129 | 16,7 |
| Malaysia Smelting Corp | Malásia | 22.850 | 25.471 | 11.5 |
| THAISARCO | Tailândia | 27.828 | 19.826 | -28,8 |
| Yunnan Chengfeng | China | 21.765 | 18.000 | -17.8 |
| Liuzhou China Tin | China | 13.499 | 13.193 | -2.3 |
| EM Vinto | Bolívia | 11.804 | 9448 | -20.0 |
| Sino Gold Group | China | 4696 | 8000 | 70,9 |
Preço e intercâmbios
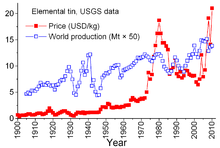
Tin é único entre outros bens minerais por parte dos "acordos" complexas entre países produtores e países consumidores que datam de 1921. Os acordos anteriores tendiam a ser um pouco informal e esporádico; que levou ao "Acordo First International Tin" em 1956, o primeiro de uma série continuamente numerado que, essencialmente, entrou em colapso em 1985. Através desta série de acordos, os Conselho Tin Internacional (ITC) teve um efeito considerável sobre os preços de estanho. A ITC apoiou o preço do estanho durante períodos de preços baixos comprando da lata para o seu arsenal de buffer e foi capaz de conter o preço durante os períodos de preços elevados com a venda de estanho do estoque. Esta foi uma abordagem anti-livre mercado ao, de modo a garantir um fluxo suficiente de estanho para os países consumidores e um lucro decente para os países produtores. No entanto, o estoque de buffer não foi suficientemente grande, e durante a maior parte desses 29 anos preços do estanho aumentou, por vezes, drasticamente, especialmente de 1973 a 1980, quando a inflação galopante atormentado muitas economias mundiais.
Durante o final dos anos 1970 e início de 1980, a lata de arsenais Governo dos EUA estava em um modo de venda agressiva, em parte para aproveitar as historicamente elevados preços do estanho. A recessão acentuada de 1981-82 provou ser bastante dura sobre a indústria do estanho. Tin consumo diminuiu drasticamente. A ITC foi capaz de evitar quedas íngremes verdadeiramente através de compra acelerado para o seu arsenal de tampão; essa atividade exigia a ITC para emprestar extensivamente de bancos e empresas de comércio de metal para aumentar seus recursos. A ITC continuou a contrair empréstimos até o final de 1985, quando atingiu seu limite de crédito. Imediatamente, um grande "crise de estanho" seguido - estanho foi retiradas de negociação da Bolsa de Metais de Londres por cerca de 3 anos, a ITC dissolvida logo depois, eo preço do estanho, agora em um ambiente de livre mercado, caiu drasticamente para US $ 4 por libra e manteve-se em torno deste nível através da década de 1990. Ele voltou a aumentar em 2010 devido à recuperação do consumo após a crise econômica de 2008-09 mundo, repovoamento e continuou crescimento do consumo nas economias em desenvolvimento do mundo.
London Metal Exchange (LME) é o principal site de comércio de estanho. Outros mercados de contratos de estanho são Kuala Lumpur Tin Mercado (KLTM) e Indonésia Tin Exchange (INATIN).
Aplicações

Em 2006, cerca de metade de estanho produzido foi utilizado na solda. O restante foi dividido entre revestimento de latão, produtos químicos de estanho, latão e bronze, e usos de nicho.
Solda

Estanho tem sido utilizado como um solda sob a forma de uma liga de chumbo, estanho representando 5 a 70% w / w. Tin forma uma mistura eutética com chumbo contendo 63% de estanho e 37% de chumbo. Tais soldas são usados principalmente para soldas para unir tubos ou circuitos elétricos. Uma vez que a União Europeia Waste Electrical and Electronic Equipment directiva (Directiva WEEE) e Restrição de Substâncias Perigosas directiva entrou em vigor em 1 de Julho de 2006, a utilização de chumbo em tais ligas diminuiu. Substituindo chumbo tem muitos problemas, incluindo um ponto de fusão mais elevado, e a formação de filamentos de estanho causando problemas elétricos. Tin pragas podem ocorrer em soldas sem chumbo, levando à perda da junta soldada. Ligas de substituição estão a ser rapidamente encontrados, embora os problemas de integridade das juntas permanecem.
Tin chapeamento
Títulos Tin prontamente a ferro e é usado para o revestimento de chumbo ou de zinco e aço para evitar a corrosão. Recipientes de aço estanhado são amplamente utilizados para conservação de alimentos, e isto constitui uma grande parte do mercado para o estanho metálico. Uma vasilha de folha de flandres para a conservação de alimentos foi fabricado pela primeira vez em Londres, em 1812. Os falantes de Inglês Britânico chamá-los de "latas", enquanto falantes de Inglês Americano chamá-los " latas "ou" latas ". Um uso, portanto, derivado do termo de calão" tinnie "ou" metálico "significa" pode de cerveja ". O assobio de lata é assim chamado porque ele foi o primeiro produzido em massa em aço galvanizado.
Ligas especializadas

Estanho em combinação com outros elementos forma uma grande variedade de ligas úteis. O estanho é o mais geralmente em liga com cobre. Pewter é 85-99% de estanho; Rolamento de metal tem uma elevada percentagem de estanho também. O bronze é principalmente de cobre (12% de estanho), enquanto que a adição de fósforo dá bronze de fósforo. Sino do metal também é uma liga de cobre e estanho, contendo 22% de estanho. Tin tem também, por vezes, sido utilizado na cunhagem; por exemplo, que uma vez formada uma única figura percentagem das moedas de um centavo americanas e canadenses. Porque o cobre é muitas vezes a principal do metal em tais moedas e zinco às vezes está presente, bem, estas poderiam ser tecnicamente chamado de bronze e / ou latão ligas.

O nióbio composto -tin Nb 3 Sn é comercialmente usado para produzir fios de ímãs supercondutores, devido ao material de alta temperatura crítica (18 K) e campo magnético crítico (25 T). Um magneto supercondutor pesando apenas um par de quilos é capaz de produzir campos magnéticos comparáveis a um convencional eletroímã pesando toneladas.
Uma adição de uma pequena percentagem de estanho é normalmente usado em ligas de zircônio para o revestimento do combustível nuclear.
A maioria dos tubos de metal em um órgão de tubo são feitos de várias quantidades de uma liga de estanho / chumbo, com 50% / 50%, sendo o mais comum. A quantidade de estanho no tubo define o tom do tubo, desde estanho é o mais tonally ressonante de todos os metais. Quando uma liga estanho / chumbo esfria, o chumbo esfria um pouco mais rápido e produz um efeito manchado ou manchado. Esta liga de metal é referido metal como manchado. As principais vantagens da utilização de estanho para tubos incluem sua aparência, sua trabalhabilidade e resistência à corrosão.
Outras aplicações

Estanho perfurados, também chamado de estanho perfurada, é uma técnica artesanal originário da Europa Central para a criação de utensílios domésticos que são funcionais e decorativas. Projetos de perfuração decorativas existem em uma grande variedade, com base na geografia ou criações pessoais do artesão. Lanternas de estanho perfurados são a aplicação mais comum dessa técnica artesanal. A luz de uma vela que brilha através do desenho trespassado cria um padrão de luz decorativa no quarto onde ele se senta. Lanternas de estanho perfurados e outros artigos de estanho perfurados foram criadas no Novo Mundo a partir do primeiro assentamento europeu. Um exemplo bem conhecido é o tipo de farol de Revere, em homenagem Paul Revere.
Antes da era moderna, em algumas áreas dos Alpes, uma cabra ou chifre de carneiro seria afiada e um painel de estanho iria ser perfurado usando o alfabeto e os números de um a nove. Esta ferramenta de aprendizagem era conhecido apropriadamente como "chifre". Reproduções modernas estão decorados com motivos tais como corações e tulipas.
Na América, cofres torta e cofres alimentos entrou em uso nos dias antes de refrigeração. Estes foram armários de madeira de vários estilos e tamanhos - tanto de chão ou armários pendurados destinadas a desencorajar os parasitas e insetos e para manter a poeira de produtos alimentares perecíveis. Estes gabinetes tinham inserções nas portas de folha de flandres e às vezes nos lados, perfurado pelo proprietário, marceneiro ou um latoeiro em diferentes projetos para permitir a circulação de ar. Reproduções modernas destes artigos continuam a ser populares na América do Norte.
Vidro da janela é mais frequentemente feita por flutuante fundido de vidro em cima de estanho fundido (criando vidro float), a fim de produzir uma superfície plana. Isso é chamado de " Processo Pilkington ".
Tin também é usado como um eletrodo negativo em baterias avançadas de iões de lítio. Sua aplicação é um pouco limitado pelo fato de que algumas superfícies de estanho catalisar a decomposição de eletrólitos à base de carbonato usados em baterias Li-ion.
Estanho (II), o fluoreto é adicionado a alguns produtos de cuidados dentários como fluoreto estanoso (SnF 2). De estanho (II) de fluoreto pode ser misturado com abrasivos de cálcio enquanto que o mais comum fluoreto de sódio gradualmente torna-se biologicamente inactiva combinados com compostos de cálcio. Também tem sido demonstrado ser mais eficaz do que fluoreto de sódio no controle gengivite.
Compostos organoestânicos
De todos os compostos químicos de estanho, compostos de organo-estanho são mais utilizados. Produção industrial em todo o mundo provavelmente excede 50.000 toneladas.
Estabilizadores de PVC
A principal aplicação comercial de compostos de organo-estanho é na estabilização de Plásticos de PVC. Na ausência de tais estabilizadores, PVC degradaria de outra forma rapidamente sob o calor, a luz eo oxigênio atmosférico, para dar descoloridos, produtos frágeis. Tin scavenges lábil iões cloreto (Cl -), que de outro modo iniciam a perda de HCl a partir do material plástico. Compostos de estanho típicos são os derivados de ácidos carboxílicos de dicloreto de dibutil-estanho, tais como o di laurato.
Biocidas
Compostos de organo-estanho pode ter uma toxicidade relativamente elevada, o que é vantajoso e tanto problemático. Eles têm sido utilizados para a sua efeitos biocidas em / as fungicidas, pesticidas, algicidas, conservantes de madeira, e agentes anti-incrustantes. Óxido de tributil-estanho é usado como um preservativo de madeira. Tributilestanho foi utilizada como aditivo para tinta navio para evitar o crescimento de organismos marinhos sobre navios, com utilização declínio após compostos organoestânicos foram reconhecidos como poluentes orgânicos persistentes com uma toxicidade extremamente alta para alguns organismos marinhos, como por exemplo o pústula do cão. A UE proibiu a utilização de compostos organoestânicos em 2003, enquanto as preocupações sobre a toxicidade desses compostos para a vida marinha e seus efeitos sobre a reprodução eo crescimento de algumas espécies marinhas, (alguns relatórios descrevem efeitos biológicos à vida marinha a uma concentração de 1 nanogramas por litro) levaram a uma proibição mundial pela Organização Marítima Internacional. Muitas nações agora restringir a utilização de compostos organoestânicos para navios com mais de 25 metros de comprimento.
Química orgânica
Alguns estanho Os reagentes são úteis em química orgânica . Na maior aplicação, cloreto estanoso é um agente de redução comum para a conversão de nitro e grupos oxima para aminas . O Compostos organo casais reacção Stille com orgânico ou halogenetos pseudo.
Baterias Li-ion
Formas de estanho várias fases inter-metálicos com metal de lítio e que o torna um material potencialmente atraente. Expansão volumétrica Grande de estanho em cima de liga com lítio e instabilidade da interface do eletrólito Tin-orgânico a potenciais eletroquímicos de baixo são os maiores desafios em empregá-la em células comerciais. O problema foi parcialmente resolvido pela Sony. Composto inter-metálico Tin com Cobalt, misturado com carbono, foi implementado pela Sony em suas células Nexelion lançado no final de 2000 de. A composição dos materiais activos é perto de Sn 0,3 0,4 C 0,3 Co. Uma pesquisa recente mostrou que apenas algumas facetas cristalinas de tetragonal (beta) Sn são responsáveis pela atividade eletroquímica indesejável.
Precauções
Casos de intoxicação de lata de metal, seus óxidos, e seus sais são "quase desconhecido". Por outro lado, certos compostos organoestânicos são quase tão tóxico como cianeto.

