
Valence (química)
Você sabia ...
Esta seleção wikipedia foi escolhido por voluntários que ajudam Crianças SOS da Wikipedia para este Seleção Wikipedia para as escolas. Crianças SOS é a maior instituição de caridade do mundo dando órfãos e crianças abandonadas a chance da vida familiar.
Em química , valência, também conhecida como número de valência ou de valência, é uma medida do número de ligações formadas por um átomo de um determinado elemento. "Valência" pode ser definido como o número de valência liga um dado átomo é formada, ou podem formar, com um ou mais outros átomos. Para a maioria dos elementos o número de ligações pode variar. O Definição da IUPAC limita valência para o número máximo de átomos univalentes que podem combinar com o átomo, que é o número máximo de ligações de valência que é possível para o elemento de dado.
A valência de um elemento depende do número de elétrons de valência que podem estar envolvidos na formação de ligações de valência. Um univalente (monovalente) átomo, ião ou grupo tem uma valência de um e, assim, podem formar um ligação covalente. A bivalente entidade molecular tem uma valência de dois e pode formar duas ligações sigma ou um ligação sigma mais um ligação pi. Os grupos alquilo e os iões hidroxilo são exemplos univalentes; ligandos oxo são divalentes.
Durante o último século, o conceito de valência evoluiu para uma série de abordagens para descrever a ligação química, inclusive Estruturas de Lewis (1916), ligação de valência (1927), orbitais moleculares (1928), valência eletrônica shell teoria par repulsão (1958) e todos os métodos avançados de química quântica .
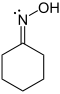 | Em cyclohexanon oxima (imagem esquerda), o azoto átomo tem três ligações de valência e por a primeira definição que tem uma valência de três. O nitrogênio tem cinco electrões de valência e por definição da IUPAC que tem uma valência de cinco, porque pode formar máximas cinco ligações de valência, tal como o óxido em N-metil-1-phenylmethanimine . Em cyclohexanonoxime, nitrogênio tem o estado de oxidação -1 e oxigênio -2. |
História
O etimologia da palavra "valência" remonta a 1425, o que significa "extrair, preparação", do latim valentia "força, capacidade," eo significado química referindo-se ao "poder da combinação de um elemento" é gravado a partir de 1884, do alemão Valenz .
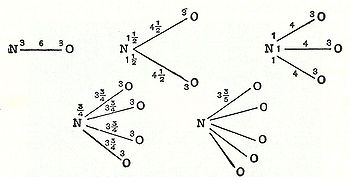
Em 1789, William Higgins publicado pontos de vista sobre o que chamou de combinações de partículas "final", antecipando o conceito de ligações de valência. Se, por exemplo, de acordo com a Higgins, a força entre a partícula final de oxigénio e a partícula final de azoto foram de 6, em seguida, a intensidade da força seria dividida em conformidade, e de forma semelhante para as outras combinações de partículas finais (ver ilustração) .
O início exato, no entanto, da teoria das valências químicos pode ser atribuída a um papel 1852 por Edward Frankland, em que ele combinou as teorias mais antigas do radicais livres e "teoria do tipo" com pensamentos sobre afinidade química para mostrar que certos elementos têm a tendência de se combinar com outros elementos para formar compostos contendo 3, ou seja, nos três grupos de átomos (por exemplo, NO 3, NH 3, NI 3, etc.), ou 5, ou seja, nos cinco grupos de átomos (por exemplo, NO 5, NH 4 O, 5 PO, etc), os equivalentes de elementos ligados. É desta forma, de acordo com Frankland, que as suas afinidades são melhor satisfeitas. Seguindo estes exemplos e postulados, Frankland declara como óbvio é que:
| " | Uma tendência ou lei prevalece (aqui), e que, não importa o que os personagens dos átomos unindo seja, o poder de combinação do elemento de atração, se me é permitida a expressão, é sempre satisfeita pelo mesmo número desses átomos . | " |
Este "poder combinar" foi mais tarde chamado quantivalence ou valência (e valência por químicos americanos).
Covalence
O conceito de covalência foi desenvolvido no meio do século XIX, em uma tentativa para racionalizar as fórmulas de diferentes compostos químicos . Em 1919, Irving Langmuir, tomou emprestado o termo para explicar Gilbert N. Lewis átomo de modelo cúbico, afirmando que "o número de pares de electrões que qualquer dado átomo partes com os átomos adjacentes é chamado a covalência do átomo que. " O co-prefixo significa "juntos", de modo que uma ligação co-valente significa que os átomos compartilhar valência. Assim, se um átomo, por exemplo, teve uma valência +1, o que significa que tem um elétron de valência para além do escudo completo, e outro uma valência -1, o que significa que requer um elétron para completar sua camada externa (faltando um elétron), então uma ligação entre esses dois átomos resultaria porque seriam complementando ou compartilhar seu fora de tendências equilíbrio valência. Posteriormente, agora é mais comum falar de ligações covalentes, em vez de "valência", que caiu em desuso no maior nível de trabalho com os avanços na teoria da ligação química, mas ainda é amplamente utilizado em estudos elementares onde fornece uma introdução heurística para o assunto.
Valências comuns
Para elementos na principais grupos da tabela periódica , a valência podem variar entre 1-7, mas geralmente estes elementos formam um certo número de ligações de valência entre um e quatro. O número de ligações formadas por um determinado elemento foi originalmente pensado para ser uma propriedade química fixa. Na verdade, na maioria dos casos isso não é verdade. Por exemplo, o fósforo , muitas vezes tem uma valência de três, mas também pode ter outras valências.
No entanto, diversos elementos têm uma valência comum relacionado com a sua posição na tabela periódica, seguindo o regra do octeto. Elementos nas principais grupos 1 (metais alcalinos) e 17 (halogênios) comumente têm uma valência de 1; elementos em grupos de dois (metais alcalino-terrosos) e 16 (Calcogênios) valência 2; elementos em 13 grupos (grupo de boro) e 15 (grupo de azoto) valência 3; elementos em grupo 14 (grupo de carbono) valência 4.
Valence contra estado de oxidação
Por causa da ambiguidade do termo de valência, hoje em dia outras notações são utilizadas na prática. Ao lado do sistema de números de oxidação tal como utilizado no Da nomenclatura compostos de coordenação, e a notação lambda, como utilizados no IUPAC Nomenclatura de química inorgânica, " estado de oxidação "é uma indicação mais clara do estado eletrônico dos átomos em uma molécula.
O " estado de oxidação "de um átomo de uma molécula dá o número de electrões de valência que ganhou ou perdeu. Em contraste com o número de valência, o estado de oxidação pode ser positiva (por um átomo de electropositiva) ou negativo (para uma átomo electronegativo).
Os elementos de um estado de oxidação elevado pode ter uma valência maior que quatro. Por exemplo, em percloratos, cloro tem sete ligações de valência e ruténio , no estado de oxidação em 8 rutênio (VIII) tetróxido, tem até oito ligações de valência.
Definição "Número máximo de obrigações"
O União Internacional de Química Pura e Aplicada (IUPAC) fez várias tentativas para se chegar a uma definição inequívoca de valência. A versão atual, aprovada em 1994 ,:
- O número máximo de átomos de univalentes (originalmente átomos de hidrogénio ou de cloro), que pode combinar com um átomo do elemento em questão, ou com um seu fragmento, ou para o qual um átomo de este elemento pode ser substituído.
Hidrogénio e cloro foram originalmente usados como exemplos de átomos univalentes, devido à sua natureza para formar apenas uma ligação simples. O hidrogênio tem apenas um elétron de valência e podem formar apenas uma ligação com um átomo que tem uma incompleta escudo exterior. O cloro tem sete elétrons de valência e podem formar uma única ligação com um átomo que doa um elétron de valência para completar casca exterior de cloro. No entanto, o cloro também pode ter estados de oxidação 1-7 e pode formar mais de um vínculo com a doação de elétrons de valência.
Embora o hidrogénio tem apenas um electrão de valência, que podem formar ligações com mais do que um átomo de hipervalentes títulos. No ião bifluoreto ([HF 2] -), por exemplo, forma-se um centro-três vínculo de quatro elétrons com dois átomos de flúor: ![[\ F \ frac {\ quad} {\ quad} H \ {} ^ - \ F \ quad \ longleftrightarrow \ quad F ^ -! \ {} \ H \ frac {\ quad} {\ quad} F \]](../../images/1118/111899.png)
Outro exemplo é a Três centro-bond de dois elétrons em diborano (B 2 H 6).
Exemplos
(Valências de acordo com o número de definição de ligações de valência e conformar estados de oxidação)
| COMPOSTO | FORMULA | VALENCE | Estado de oxidação |
|---|---|---|---|
| Cloreto de hidrogénio | HCl | H = 1 = 1 Cl | H = 1 + Cl = -1 |
| Cloro | Cl 2 | Cl Cl = 1 = 1 | Cl = 1 + Cl = -1 |
| Perclorato * | HClO 4 | H = 1 = 7 Cl 2 O = | H = + 1 + 7 = Cl O = -2 |
| Hidreto de sódio | NaH | Na = H = 1 1 | Na = + 1 = H -1 |
| Óxido ferroso ** | FeO | Fe = 2 O = 2 | Fe = + H2O = -2 |
| Óxido férrico ** | Fe 2 O 3 | Fe = 3 = O 2 | Fe + 3 = O = -2 |
* O íon perclorato univalent (ClO 4 -) tem valência 1.
** Óxido de ferro aparece numa estrutura de cristal, de modo que nenhuma molécula típica pode ser identificado.
Em óxido de ferro, Fe tem o número de oxidação II, em óxido de ferro, o número de oxidação III.
Valências dos elementos
Valências máximo para a maior parte dos elementos são com base no fluoreto ou fluoroanion mais elevado conhecido. Note-se que valência de hidrogénio e flúor são dois. Astatine é previsível que tenha uma valência de sete, mas não é conhecido por ter compostos com uma valência superior a um.
Valências máximos dos elementos | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupo → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| ↓ Período | ||||||||||||||||||||
| 1 | 1 H | 2 Ele | ||||||||||||||||||
| 2 | 3 Li | 4 Ser | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 Como | 34 Se | 35 Br | 36 Kr | ||
| 5 | 37 Rb | 38 Sr | 39 Y |
40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 CD | 49 Em | 50 Sn | 51 Sb | 52 Te | 53 EU | 54 Xe | ||
| 6 | 55 Cs | 56 Ba | * | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg |
81 Tl | 82 Pb | 83 Bi | 84 Po | 85 Em | 86 Rn | ||
| 7 | 87 Fr | 88 Ra | ** | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Uut | 114 Fl | 115 UUP | 116 Lv | 117 Uus | 118 UUO | ||
| * Lanthanides | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tuberculose | 66 Dy | 67 Ho |
68 Er | 69 Tm | 70 Yb | 71 Lu | |||||
| ** Actinídeos | 89 CA | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Sou | 96 Cm |
97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 Nenhuma | 103 Lr | |||||
| Valências máximas são baseadas no Lista de estados de oxidação dos elementos | ||||||||||||||||||||
Valências máximos de elementos químicos | |||||||||||||
|
| ||||||||||||

