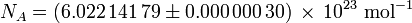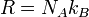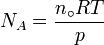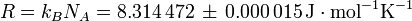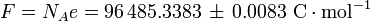Constante de Avogadro
Antecedentes de las escuelas de Wikipedia
SOS Children produjo este sitio web para las escuelas, así como este sitio web video sobre África . Visite el sitio web de Aldeas Infantiles SOS en http://www.soschildren.org/
La constante de Avogadro (símbolos: L, N A), también llamado el número de Avogadro es el número de "entidades" (generalmente, átomos o moléculas) en uno mol, es decir, el número de carbono-12 átomos de cada 12 gramos (0.012 kg ) de no unido carbono-12 en su estado fundamental. La mejor estimación actual de este número es:
El valor del número se indicó por primera Johann Josef Loschmidt, que en 1865, calcula el número de partículas en un centímetro cúbico de gas en condiciones estándar. El término Constante Loschmidt se aplica, pues, más correctamente para este último valor, que puede decirse que es proporcional al número de Avogadro. Sin embargo, en lengua alemana literatura, "Loschmidt constante" se utiliza para referirse tanto a este uso, así como el número de entidades en un lunar.
Historia y etimología
La constante de Avogadro debe su nombre a principios del siglo XIX italiano científico Amedeo Avogadro, que se acredita (1811) de ser el primero en darse cuenta de que el volumen de un gas (en sentido estricto, de un gas ideal) es proporcional al número de átomos o moléculas . El químico francés Jean Baptiste Perrin en 1909 propuso nombrar a la constante en honor de Avogadro. Los libros de texto de química americanos recogieron en la década de 1930, seguido de los libros de textos a partir de la década de 1950.
Loschmidt: Midiendo el número de Avogadro
Avogadro nunca intentó medir la constante: el valor numérico se calcula primero por el austriaco físico Johann Josef Loschmidt en 1865 con el la teoría cinética de los gases. En los países de habla alemana, la constante se refiere a veces como la Loschmidt constante o número de Loschmidt pero lo Loschmidt realmente medida es el número de partículas por unidad de volumen de una, gas ideal, es decir, la densidad del número de partículas en un gas ideal. Así, el término Loschmidt constante es más apropiado para el número de partículas por unidad de gas, Símbolo: n o:
igual a (2,686 ± 7,774 0,000 0,047) x 10 25 m -3 a 273,15 K y 101.325 kPa con k B de la Constante de Boltzmann, T la temperatura y el p presión.
Esta constante se relaciona con la constante de Avogadro por la relación:
con k B de la Constante de Boltzmann, y R la constante de los gases, por lo tanto
Sin embargo, en alemán literatura científica, el término Loschmidt constante se utiliza de manera ambigua - a menudo se refiere a lo que ha llegado a ser conocido como el número de Avogadro. Sin embargo, Boltzmann había utilizado por primera vez el término para el sentido en que Loschmidt había medido - el número de partículas en una unidad de volumen de gas. Por lo tanto, su uso en referencia al número de Avogadro relacionados lleva a la confusión y por lo general está en desuso. Por la misma razón, a veces el número de Avogadro se denota como L en lugar de N A en textos alemanes.
Normalización del lunar
Antes de 1960, había en conflicto definiciones de la mole, y por tanto del número de Avogadro (como era conocido en ese entonces), basado en 16 gramos de oxígeno: los físicos generalmente utilizados oxígeno-16, mientras que los químicos generalmente utilizan la "natural" de relación isotópica.
El cambio, en 1960, a 12 gramos de carbono-12 como base terminado esta disputa y tenía otras ventajas. En este momento, el número de Avogadro se definió como el número de átomos en 12 gramos de carbono-12, que es como una cantidad adimensional, mientras que un mol se define como un número de Avogadro de átomos, moléculas u otras entidades.
Cuando el topo entró en el Sistema Internacional de Unidades (SI), en 1971, se intercambiaron las definiciones.
En 1971, un lunar se definió como el número de átomos en 12 gramos de carbono-12, con su propia dimensión, a saber, "cantidad de sustancia". El número de Avogadro se convirtió en un constante física con la unidad de moles recíprocas (mol -1).
Aplicación
La constante de Avogadro se puede aplicar a cualquier sustancia. Se corresponde con el número de átomos o moléculas necesarias para compensar una masa igual a la sustancia de atómica o masa molecular , en gramos. Por ejemplo, la masa atómica de hierro es 55.847 g / mol, por lo que N A átomos de hierro (es decir, un mol de átomos de hierro) tener una masa de 55.847 g. Por el contrario, 55,847 g de hierro contiene N A los átomos de hierro. La constante de Avogadro también entra en la definición de la unidad de masa atómica unificada, u:
Relaciones físicas adicionales
Debido a su papel como un factor de escala, el número de Avogadro proporciona el vínculo entre un número de constantes físicas útiles cuando se mueve entre el escala atómica y la escala macroscópica. Por ejemplo, proporciona la relación entre:
- la de gas constante R y el Boltzmann k constante B:
- en J mol -1 K -1
- la Constante de Faraday F y la e carga elemental:
- en C mol -1
Medición de la constante de Avogadro

Una serie de métodos se puede utilizar para medir la constante de Avogadro. Un método moderno es calcular la constante de Avogadro de la densidad (ρ) de un cristal, la masa atómica relativa (M), y la longitud de celda unidad (a) determina a partir de cristalografía de rayos x. Valores muy precisas de estas cantidades de silicio se han medido en el Instituto Nacional de Estándares y Tecnología (NIST) y se utiliza para obtener el valor de la constante de Avogadro:
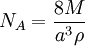 .
.
- basado en silicio.