
Punto de ebullicion
Antecedentes
Esta selección Escuelas fue originalmente elegido por SOS para las escuelas en el mundo en desarrollo que no tienen acceso a Internet. Está disponible como una descarga intranet. SOS Children ha cuidado de niños en África durante cuarenta años. ¿Puedes ayudar a su trabajo en África ?
El punto de ebullición de un líquido es la temperatura a la que la la presión de vapor del líquido es igual a la presión ambiental que rodea el líquido. Un líquido en un ambiente de vacío tiene un punto de ebullición menor que cuando el líquido está en presión atmosférica. Y un líquido en un entorno de alta presión tiene un punto de ebullición más alto que cuando el líquido está a presión atmosférica. En otras palabras, todos los líquidos tienen un número infinito de puntos de ebullición.
El punto de ebullición normal (también llamado el punto de ebullición atmosférico o el punto de ebullición a presión atmosférica) de un líquido es el caso especial en el que la presión de vapor del líquido es igual a la presión atmosférica definida a nivel del mar, 1 atmósfera. A esa temperatura, la presión de vapor del líquido se vuelve suficiente para superar la presión atmosférica y levantar el líquido para formar burbujas dentro de la masa del líquido. El punto de ebullición estándar es ahora (a partir de 1982) definido por IUPAC como la temperatura a la que se produce de ebullición a una presión de 1 bar.
La calor de vaporización es la cantidad de calor necesaria para convertir o vaporizar un líquido saturado (es decir, un líquido en su punto de ebullición) en un vapor.
Los líquidos pueden cambiar a un vapor a temperaturas por debajo de sus puntos de ebullición a través del proceso de evaporación. La evaporación es un fenómeno de superficie en el que las moléculas encuentran cerca de la superficie de escape de vapor / líquido en la fase de vapor. Por otro lado, la ebullición es un proceso en el que las moléculas en cualquier lugar de la fuga de líquido, resultando en la formación de burbujas de vapor dentro del líquido.
Temperatura de saturación y presión
Un líquido saturado contiene tanta energía térmica como pueda sin hervir (o por el contrario un vapor saturado contiene menor cantidad de energía térmica que se pueda sin condensación).
Temperatura de saturación significa punto de ebullición. La temperatura de saturación es la temperatura para una presión de saturación correspondiente a la cual un líquido hierve en su vapor fase . El líquido puede decirse que está saturado con energía térmica. Cualquier adición de los resultados de energía térmica en un cambio de fase.
Si el presión en un sistema permanece constante ( isobárica), un vapor a la temperatura de saturación comenzará a condensarse en su fase líquida como energía térmica ( calor ) se retira. Del mismo modo, un líquido a la temperatura de saturación y presión hervirá en su fase de vapor a medida que se aplica energía térmica adicional.
El punto de ebullición corresponde a la temperatura a la cual la presión de vapor del líquido es igual a la presión del medio ambiente circundante. Por lo tanto, el punto de ebullición depende de la presión. Por lo general, los puntos de ebullición se publican con respecto a la presión atmosférica (101.325 kilopascales o 1 atm). En las elevaciones más altas, donde la presión atmosférica es mucho más bajo, el punto de ebullición es también menor. El punto de ebullición se incrementa con el aumento de la presión hasta el punto crítico, donde las propiedades de gas y líquidos se vuelven idénticos. El punto de ebullición no se puede aumentar más allá del punto crítico. Del mismo modo, el punto de ebullición disminuye con la disminución de presión hasta que la se alcanza el punto triple. El punto de ebullición no puede reducirse por debajo del punto triple.
Si se conoce el calor de vaporización y la presión de vapor de un líquido a una cierta temperatura, el punto de ebullición normal se puede calcular mediante el uso de la Ecuación de Clausius-Clapeyron así:
![T_B = \ Bigg (\ frac {\, R \ [\, \ ln (P_0) - \ ln (101.325) \,]} {\ Delta H_ {vap}} + \ frac {1} {T_0} \ Bigg ) ^ {- 1}](../../images/154/15428.png)
| donde: | |
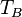 | = El punto de ebullición normal, K |
|---|---|
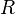 | = La constante de los gases ideales, 8.314 J · K -1 mol -1 |
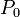 | = Es la presión de vapor a una temperatura dada, kPa |
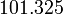 | = Presión atmosférica, kPa |
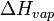 | = El calor de vaporización del líquido, J / mol |
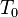 | = La temperatura dada, K |
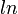 | = El logaritmo natural a la base e |
Presión de saturación es la presión para una temperatura de saturación correspondiente a la cual un líquido hierve en su fase de vapor. Presión de saturación y la temperatura de saturación tienen una relación directa: a medida que aumenta la presión de saturación de modo es la temperatura de saturación.
Si la temperatura en una sistema permanece constante (una sistema isotérmico), vapor a presión de saturación y la temperatura comenzará a condensar en su fase líquida a medida que aumenta la presión del sistema. Del mismo modo, un líquido a presión de saturación y la temperatura tenderá a Flash en su fase de vapor como se reduce la presión del sistema.
El punto de ebullición del agua es de 100 ° C (212 ° F) a la presión normal. En la cima de Monte Everest la presión es de aproximadamente 260 mbar (26,39 kPa) por lo que el punto de ebullición del agua es de 69 ° C . (156,2 ° F).
Para los puristas, el punto de ebullición normal del agua es 99,97 grados Celsius a una presión de 1 atm (es decir, 101,325 kPa). Hasta 1982 este fue también el punto de ebullición normal del agua, pero el IUPAC recomienda ahora una presión estándar de 1 bar (100 kPa). A esta presión ligeramente reducida, el punto de ebullición normal del agua es de 99,61 grados Celsius.
Relación entre el punto de ebullición normal y la presión de vapor de los líquidos
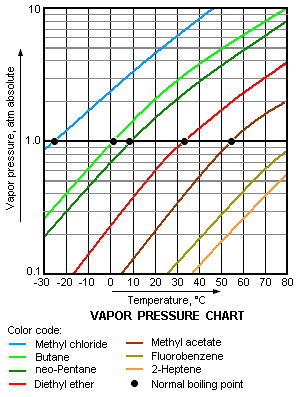
Cuanto mayor sea la presión de vapor de un líquido a una temperatura dada, menor es el punto de ebullición normal (es decir, el punto de ebullición a presión atmosférica) del líquido.
El gráfico de la presión de vapor a la derecha tiene gráficas de las presiones de vapor frente a temperaturas para una variedad de líquidos. Como se puede ver en el gráfico, los líquidos con las presiones de vapor más altas tienen los puntos de ebullición normal más baja.
Por ejemplo, a cualquier temperatura dada, el propano tiene la presión de vapor más alta de cualquiera de los líquidos en el gráfico. También tiene el punto más bajo de ebullición normal (-43,7 ° C), que es donde la curva de presión de vapor de propano (la línea púrpura) se cruza con la línea de presión horizontal de una atmósfera ( atm) de presión de vapor absoluta.
En términos de interacciones intermoleculares, el punto de ebullición representa el punto en el que el líquido moléculas poseen suficiente energía térmica para superar las diversas atracciones intermoleculares vinculantes las moléculas en el líquido (por ejemplo. atracción dipolo-dipolo, instantáneo-dipolo-dipolo inducido atracciones, y enlaces de hidrógeno). Por lo tanto el punto de ebullición es también un indicador de la fuerza de estas fuerzas de atracción.
Propiedades de otros elementos
El elemento con el punto de ebullición más bajo es el helio . Tanto los puntos de ebullición de renio y tungsteno exceden 5.000 K en presión estándar. Debido a la dificultad experimental de medir con precisión las temperaturas extremas sin sesgo, hay alguna discrepancia en la literatura en cuanto a si tungsteno o renio tiene el punto de ebullición más alto.

