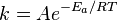Energía de activación
Antecedentes
SOS Children han producido una selección de artículos de Wikipedia para escuelas desde 2005. ¿Quieres saber sobre el patrocinio? Ver www.sponsorachild.org.uk

En la química , la energía de activación es un término introducido en 1889 por el científico sueco Svante Arrhenius que se define como la energía mínima que debe ser de entrada a un sistema químico, que contiene reactivos potenciales, para que una reacción química que se produzca. La energía de activación también puede ser definida como la energía mínima necesaria para iniciar una reacción química. La energía de activación de una reacción por lo general se denota por A y E da en unidades de kilojulios por mol.
La energía de activación puede ser pensado como la altura de la barrera de potencial (a veces llamada la barrera de energía) que separa dos mínimos de energía potencial (de los reactivos y productos de una reacción). Para una reacción química para proceder a una tasa razonable, debe existir un número apreciable de moléculas con energía igual o mayor que la energía de activación.
En un nivel más avanzado, el término de energía de activación de Arrhenius a partir de la ecuación de Arrhenius se considera mejor como un parámetro determinado experimentalmente que indica la sensibilidad de la velocidad de reacción a la temperatura. Hay dos objeciones a la asociación de esta energía de activación con la barrera del umbral para una reacción elemental. En primer lugar, es a menudo poco clara en cuanto a si o no reacción no proceder en un solo paso; barreras de umbral que se promedian a lo largo de todas las etapas elementales tienen poco valor teórico. En segundo lugar, incluso si la reacción que se está estudiando es elemental, un espectro de colisiones individuales contribuye a calificar constantes obtenidas a granel ('') de bulbo experimentos que implican miles de millones de moléculas, con muchos diferentes geometrías y ángulos de colisión reactivo, diferente de la traducción y (posiblemente) vibracionales energías - todos los cuales pueden conducir a diferentes velocidades de reacción microscópico.
Energía de activación negativa
En algunos casos, las tasas de reacción disminuyen al aumentar la temperatura. Cuando después de una relación de aproximadamente exponencial de modo que la constante de velocidad todavía puede estar en forma para una expresión de Arrhenius, esto resulta en un valor negativo de E a. Reacciones elementales que exhiben estas energías de activación negativos son típicamente reacciones acceso minusválidos, en el que el procedimiento de reacción se basa en la captura de las moléculas en un pozo de potencial. El aumento de la temperatura conduce a una probabilidad reducida de las moléculas que chocan captura de uno al otro (con más colisiones mirando que no conduce a la reacción como el impulso superior lleva las partículas que chocan fuera del pozo de potencial), expresado como una reacción sección transversal que disminuye al aumentar la temperatura. Tal situación ya no conduce a interpretaciones dirigir como la altura de un punto de potencial.
La independencia de la temperatura y de la relación con la ecuación de Arrhenius
La Ecuación de Arrhenius da la base cuantitativa de la relación entre la energía de activación y la velocidad a la que un producto de reacción. De la ecuación de Arrhenius, la energía de activación se puede expresar como
donde A es el factor de frecuencia para la reacción, R es lo universal constante de los gases, T es la temperatura (en grados Kelvin ), y k es la coeficiente de velocidad de reacción. Si bien esta ecuación sugiere que la energía de activación depende de la temperatura, en los regímenes en los que la ecuación de Arrhenius es válida esta es cancelada por la dependencia de temperatura de k. Por lo tanto, un E puede evaluarse a partir del coeficiente de velocidad de reacción a cualquier temperatura (dentro de la validez de la ecuación de Arrhenius).
Catálisis

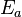 ) Y entalpía de formación (Δ H) con y sin un catalizador, representa frente a la coordenada de reacción. La posición de energía más alta (la posición del pico) representa el estado de transición. Con el catalizador, la energía requerida para entrar en estado de transición disminuye, disminuyendo así la energía necesaria para iniciar la reacción.
) Y entalpía de formación (Δ H) con y sin un catalizador, representa frente a la coordenada de reacción. La posición de energía más alta (la posición del pico) representa el estado de transición. Con el catalizador, la energía requerida para entrar en estado de transición disminuye, disminuyendo así la energía necesaria para iniciar la reacción. Una sustancia que modifica el estado de transición para reducir la energía de activación se denomina un catalizador ; un biológica catalizador se denomina una enzima. Es importante tener en cuenta que un catalizador aumenta la velocidad de reacción sin ser consumida por el mismo. Además, mientras que el catalizador reduce la energía de activación, no cambia las energías de los reactivos o productos originales. Más bien, la energía reactiva y la energía de los productos siguen siendo los mismos y sólo la energía de activación se altera (bajadas).
Relación con energía libre de Gibbs
En el Ecuación de Arrhenius, la energía de activación plazo (E a) se utiliza para describir la energía requerida para alcanzar la estado de transición. Asimismo, el Ecuación de Eyring es una ecuación similar que también describe la velocidad de una reacción. En lugar de utilizar también un E, sin embargo, la ecuación de Eyring utiliza el concepto de energía libre de Gibbs y el símbolo * 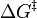 para denotar la energía de la estado de transición.
para denotar la energía de la estado de transición.