
Química
Antecedentes de las escuelas de Wikipedia
Este contenido de Wikipedia ha sido seleccionada por SOS para su utilización en las escuelas de todo el mundo. Antes de decidir sobre el patrocinio de un niño, ¿por qué no aprender sobre diferentes obras de caridad de patrocinio primero ?


La química (del Kēme egipcio (chem), significado "Tierra") es la ciencia referida a la composición, estructura y propiedades de la materia , así como los cambios que experimenta durante reacciones químicas . Históricamente la química moderna se desarrolló fuera de la alquimia después de la revolución química (1773). La química es una ciencia física relacionada con estudios de diversos átomos , moléculas , cristales y otros agregados de la materia si en el aislamiento o la combinación, que incorporan los conceptos de energía y de entropía en relación con la espontaneidad de procesos químicos.
Las disciplinas dentro de la química son agrupadas tradicionalmente por el tipo de materia que es estudiada o la clase de estudio. Éstos incluyen la química inorgánica , el estudio de la inorgánica materia; la química orgánica , el estudio de la orgánica materia; la bioquímica , el estudio de sustancias que se encuentran en organismos biológicos ; química física, los energéticos estudios relacionados de sistemas químicos en macro, escalas moleculares y submolecular; química analítica , el análisis de las muestras materiales para ganar una comprensión de su composición química y estructura. Muchas más disciplinas especializadas han emergido en los últimos años, por ejemplo, neuroquímica el estudio químico del sistema nervioso (véase las subdisciplinas ).
Visión de conjunto
La química es el estudio científico de la interacción de sustancias químicas que se constituyen de átomos o los componentes subatómicas que componen los átomos: protones , electrones y neutrones . Los átomos se combinan para producir moléculas o cristales . La química puede ser llamado " la ciencia central "porque conecta el otro ciencias naturales, tales como la astronomía , la física , ciencia de los materiales , la biología y la geología .
La génesis de la química se puede remontar a ciertas prácticas, conocidas como alquimia , que había sido practicado durante varios milenios en las diversas partes del mundo, particularmente el Oriente Medio.
La estructura de objetos que utilizamos comúnmente y las propiedades de la materia que normalmente interactuamos, son una consecuencia de las propiedades de las sustancias químicas y sus interacciones. Por ejemplo, el acero es más duro que el hierro porque sus átomos están unidos entre sí de una forma más rígida red cristalina; la madera quema o experimenta un rápido la oxidación, ya que puede reaccionar espontáneamente con oxígeno en una reacción química por encima de una cierta temperatura ; azúcar y la sal se disuelven en agua porque sus propiedades moleculares / iónicas son tales que la disolución se prefiere en las condiciones ambientales.
Las transformaciones que se estudian en química son un resultado de la interacción entre diversas sustancias químicas o entre la materia y la energía . La química tradicional implica el estudio de interacciones entre sustancias en una química laboratorio usando diversas formas de cristalería de laboratorio.

Una reacción química es una transformación de algunas sustancias en una o más de otras sustancias. Puede ser representada simbólicamente con una ecuación química. El número de átomos a la izquierda y la derecha en la ecuación para una transformación química es lo más a menudo iguales. La naturaleza de las reacciones químicas que una sustancia puede experimentar y los cambios de energía que pueden acompañarla son obligados por ciertas reglas básicas, conocidas como leyes químicas.
Energía y entropía consideraciones son invariable importantes en casi todos los estudios químicos. Las sustancias químicas se clasifican en términos de su estructura, fase así como su composiciones químicas. Pueden ser analizadas usando las herramientas del análisis químico , eg espectroscopia y cromatografía .
La química es una parte integral de la ciencia plan de estudios tanto en el la escuela secundaria, así como el nivel de universidad temprano. En estos niveles, a menudo se llama "química general", que es una introducción a una amplia variedad de conceptos fundamentales que permitan al estudiante adquirir las herramientas y las habilidades útiles en los niveles avanzados, en los que la química esté estudiada invariable en cualquiera de sus diferentes sub- disciplinas. Los científicos, que participan en la industria química la investigación se conoce como los químicos. La mayoría de los químicos se especializan en una o más subdisciplinas.
Historia
La génesis de la química se puede remontar al fenómeno extensamente observado de quemar eso llevó a la metalurgia - el arte y la ciencia de procesar los minerales para conseguir los metales (por ejemplo, la metalurgia en la India antigua). La avaricia para el oro llevado al descubrimiento del proceso para su purificación, a pesar de que, los principios subyacentes no se comprenden bien - que se pensaba que era una transformación en lugar de purificación. Muchos escolares en esos días la pensaron razonable creer que existen los medios para transformar más baratos (base) los metales en oro. Esto llevó a la alquimia, y la búsqueda de la La piedra filosofal, que fue creída para traer alrededor de tal transformación por simple contacto.
Algunos consideran musulmanes medievales para ser los primeros químicos, que introdujeron precisa observación y controlada la experimentación en el campo, y descubrió numerosas sustancias químicas. Los químicos musulmanes más influyentes eran Geber (m. 815), al-Kindi (m. 873), al-Razi (m. 925), y al-Biruni (m. 1048). Las obras de Geber se fueran conociendo más en Europa a través Latina traducciones por un pseudo-Geber en siglo 14 España , que también escribió algunos de sus propios libros bajo el seudónimo de "Geber". La contribución de Alquimistas y de metalúrgicos indios en el desarrollo de la química era también muy significativa.
La aparición de la química en Europa se debió principalmente a la incidencia recurrente de la plaga y marchita allí durante la llamada Edad Oscura. Esto dio lugar a una necesidad de medicamentos. Se pensaba que existe una medicina universal llamado el Elixir de la Vida que puede curar todas las enfermedades, pero al igual que la piedra filosofal, nunca fue encontrado.
Para algunos médicos, la alquimia era una búsqueda intelectual, con el tiempo, consiguió mejor en ella. Paracelso (1493-1541), por ejemplo, rechazó la teoría elemental 4 y con solamente una comprensión vaga de sus sustancias químicas y medicinas, formada un híbrido de la alquimia y ciencia en cuál debía ser llamado iatroquímica. Del mismo modo, las influencias de filósofos tales como sir Francis Bacon (1561-1626) y René Descartes (1596-1650), que exigieron más rigor en matemáticas y en la eliminación de prejuicio de observaciones científicas, llevó a una revolución científica. En química, esto comenzó con Roberto Boyle (1627-1691), que subió con una ecuaciones conocidas como la Ley de Boyle sobre las características del estado gaseoso. Química de hecho la mayoría de edad cuando Antoine Lavoisier (1743-1794), desarrolló la teoría de Conservación de la masa en 1783; y el desarrollo de la Teoría Atómica por John Dalton hacia 1800. La ley de conservación de la masa dio lugar a la reformulación de la química basada en esta ley y la teoría del oxígeno de la combustión, que se basaba en gran medida en el trabajo de Lavoisier. Contribuciones fundamentales de Lavoisier a la química eran un resultado de un esfuerzo consciente para caber todos los experimentos en el marco de una sola teoría. Él estableció el uso constante del equilibrio químico, utilizó el oxígeno para derrocar al teoría del flogisto, y desarrolló un nuevo sistema de nomenclatura química e hizo la contribución a la sistema métrico moderna. Lavoisier también trabajó para traducir la lengua arcaica y técnica de la química algo que podría ser facilmente comprensible por las masas en gran parte incultas, lo que lleva a un aumento del interés público en la química. Todos estos avances en química llevaron a qué se llama generalmente la revolución química. Las contribuciones de Lavoisier llevaron a qué ahora se llama la química moderna - la química que se estudia en instituciones educativas de todo el mundo. Es debido a estas y otras contribuciones que Antoine Lavoisier a menudo se celebra como el " Padre de la química moderna ". El descubrimiento posterior de Friedrich Wöhler que muchas sustancias naturales, compuestos orgánicos , de hecho, se pueden sintetizar en una química laboratorio también ayudó a la química moderna para madurarse de su infancia.
La descubrimientos de los elementos químicos tiene una larga historia desde los días de alquimia y que culminó con la creación de la tabla periódica de los elementos químicos de Dmitri Mendeleev (1834-1907) y descubrimientos posteriores de algunos elementos sintéticos.
Etimología
La palabra química proviene del estudio anterior de la alquimia, que es básicamente la búsqueda de hacer oro a partir de materiales de barro. En cuanto al origen de la palabra "alquimia" la pregunta es discutible uno; ciertamente se remonta a los griegos, y algunos, siguiendo E. Wallis Budge, también han afirmado egipcios orígenes. Alquimia, en general, se deriva de la antigua Alkemie francés del árabe al-Kimia - "el arte de la transformación". Los árabes tomaron prestada la palabra "Kimia" de los griegos cuando conquistaron Alejandría en el año 642 AD. Un esquema provisional es como sigue:
- Alquimia egipcia [3.000 BCE - 400 BCE], formular teorías tempranas "elemento" tales como la Ogdoad.
- Alquimia griega [332 aC - 642 CE], el rey griego Alexander el grande conquista Egipto y funda Alexandría, teniendo la biblioteca más grande del mundo, donde los eruditos y sabios recolectan para estudiar.
- Alquimia árabe [642 CE - 1200], los árabes se apoderan Alejandría; Jabir es el químico principal
- Alquimia europea [1300 - presente], Pseudo-Geber se basa en la química árabe
- Química [1661], Boyle escribe a su texto clásico de la química Químico Escéptico
- Química [1787], Lavoisier escribe sus elementos clásicos de la Química
- Química [1803], Dalton publica su teoría atómica
Así, llamaron un alquimista un "químico" en discurso popular, y más adelante el sufijo "relais" fue añadido a esto para describir el arte del químico como "química".
Definiciones
En retrospectiva, la definición de la química parece cambiar invariable por década, pues los nuevos descubrimientos y teorías añaden a la funcionalidad de la ciencia. Se muestra a continuación son algunas de las definiciones estándar usadas por los diversos químicos conocidos:
- Alquimia (330) - el estudio de la composición de las aguas, movimiento, crecimiento, personificando, liberando, extrayendo las bebidas espirituosas de cuerpos y enlazando las bebidas espirituosas dentro de los cuerpos ( Zósimo).
- La Química (1661) - el tema de los principios materiales de cuerpos de la mezcla ( Boyle ).
- La Química (1663) - un arte científico, por lo que uno aprende disolver cuerpos, y extrae de ellos las diversas sustancias en su composición, y cómo unirlas otra vez, y las exalta a una perfección más alta ( Glaser).
- Química (1730) - el arte de la mezcla de resolución, compuesto, o de cuerpos globales en sus principios; y de componer tales cuerpos de esos principios ( Stahl).
- Química (1837) - la ciencia referida a las leyes y los efectos de las fuerzas moleculares ( Dumas).
- Química (1947) - la ciencia de sustancias: su estructura, sus propiedades, y las reacciones que las cambian en otras sustancias ( Pauling ).
- Química (1998) - el estudio de la materia y los cambios que experimenta ( Chang).
Conceptos básicos
Varios conceptos son esenciales para el estudio de la química, algunos de ellos son:
Átomo
Un átomo es la unidad básica de un elemento. Es una colección de materia que consiste en un núcleo cargado positivamente (el núcleo atómico ) que contiene los protones y los neutrones , y que mantiene un número de electrones para equilibrar la carga positiva en el núcleo. El átomo es también la entidad más pequeña que se puede considerar para conservar algunas de las propiedades químicas del elemento, tales como electronegatividad, potencial de ionización, preferido estado de oxidación (s), número de coordinación, y tipos preferidos de enlaces para formar (eg, metálico , iónico , covalente).
Elemento
El concepto de elemento químico está relacionada con la de la sustancia química. Un elemento químico se caracteriza por un número particular de protones en los núcleos de sus átomos. Este número se conoce como el número atómico del elemento. Por ejemplo, todos los átomos con 6 protones en sus núcleos son átomos del elemento químico de carbono , y todos los átomos con 92 protones en sus núcleos son átomos del elemento de uranio . Sin embargo, varios isótopos , pueden existir de un elemento, que difieren uno de otro en el número de neutrones presentes en el núcleo.
La presentación más conveniente de los elementos químicos en la tabla periódica de los elementos químicos, que agrupa elementos por número atómico. Debido a su disposición ingeniosa, grupos, o columnas, y períodos, o filas de elementos en la tabla cualquier parte varias propiedades químicas, o seguir una cierta tendencia en características tales como radio atómico, electronegatividad, etc. Listas de los elementos por nombre , por símbolo, y por número atómico también están disponibles.
Compuesto
Un compuesto es una sustancia con una relación particular de átomos de determinados elementos químicos que determina su composición, y en particular organización que determina las propiedades químicas. Por ejemplo, el agua es un compuesto que contiene hidrógeno y oxígeno en la proporción de dos a uno, con el oxígeno entre los átomos de hidrógeno, y un ángulo de 104.5 ° entre ellos. Los compuestos se forman y interconvertir por reacciones químicas .
Sustancia
Una sustancia química es una clase de materia con un definitivo composición y un conjunto de propiedades. Estrictamente hablando, una mezcla de compuestos, elementos o compuestos y elementos no es una sustancia química, pero puede ser llamado una sustancia química. La mayor parte de las sustancias que encontramos en nuestra vida diaria son una especie de mezcla, por ejemplo, aire , aleaciones, biomasa, etc.
La nomenclatura de sustancias es una parte crítica de la lengua de la química. Generalmente se refiere a un sistema para nombrar compuestos químicos . Más temprano en la historia de las sustancias química estaba el nombre dado por su descubridor, que llevó a menudo a cierta confusión y dificultad. Sin embargo, hoy en día el sistema de IUPAC de nomenclatura química permite que los químicos especifiquen por nombre compuestos específicos entre la infinita variedad de posibles productos químicos. La nomenclatura estándar de sustancias químicas es fijada por el Unión Internacional de Química Pura y Aplicada (IUPAC). Hay sistemas bien definidos en el lugar para nombrar especie química. Los compuestos orgánicos se nombran según el sistema de nomenclatura orgánica. Los compuestos inorgánicos se nombran de acuerdo a la sistema de nomenclatura inorgánica. Además, el Chemical Abstracts Service ha ideado un método para la sustancia química índice. En este esquema cada sustancia química es identificable por un número numérico conocido como Número de registro CAS.
Molécula
Una molécula es la porción indivisible más pequeña, al lado de un átomo, de un pura sustancia química que tiene su conjunto único de propiedades químicas, es decir, su potencial para experimentar cierto conjunto de reacciones químicas con otras sustancias. Las moléculas pueden existir como unidades eléctricamente neutrales a diferencia de los iones . Las moléculas son típicamente un conjunto de átomos unidos por enlaces covalentes, tales que la estructura es eléctricamente neutral y todos los electrones de valencia están emparejados con otros electrones en enlaces o en pares solitarios.
Uno de la característica principal de una molécula es su geometría a menudo llamada su estructura. Si bien la estructura de moléculas atómicas diatómicas, triatómicas o tetra puede ser trivial, (lineal, angular piramidal etc.) la estructura de las moléculas poliatómicas, que se constituyen de más de seis átomos (de varios elementos) puede ser crucial para su naturaleza química.
Topo
Un mol es la cantidad de un sustancia que contiene tantas entidades elementales (átomos, moléculas o iones) como átomos hay en 0,012 kilogramos (o 12 gramos) de carbono-12, donde los 12 carbono-átomos se mantienen sin consolidar, en reposo y en su estado fundamental. Este número se conoce como la constante de Avogadro , y se determina empíricamente. El valor aceptado actualmente es 6.02214179 (30) × 10 23 mol -1 (2007 CODATA). Es muy parecido a la expresión "una docena ", ya que es un número absoluto (no teniendo ninguna unidad) y puede describir cualquier tipo de objeto elemental, aunque el uso del topo se limite generalmente a la medida de subatómico, atómico y molecular estructuras.
El número de moles de una sustancia en un litro de una solución se conoce como su molaridad. Molaridad es la unidad común usada para expresar la concentración de una solución en fisica quimica.
Los iones y sales
Un ion es una especie cargada, un átomo o una molécula, que ha perdido o ganado uno o más electrones. Carga positiva cationes (por ejemplo, sodio cationes Na +) y con carga negativa aniones (por ejemplo, cloruro Cl -) puede formar una red cristalina de neutro sales (por ejemplo cloruro de sodio NaCl). Ejemplos de iones poliatómicos que no se dividan durante reacciones ácido-base son el hidróxido (OH -) y fosfato (PO 4 3-).
Los iones en la fase gaseosa se conocen a menudo como plasma .
Fase
Además de las propiedades químicas específicas que distinguen diferentes clasificaciones químicas pueden existir productos químicos en varias fases. En su mayor parte, las clasificaciones químicas son independientes de estas clasificaciones de fase a granel; Sin embargo, más fases exóticas son incompatibles con ciertas propiedades químicas. Una fase es una conjunto de estados de un sistema químico que tienen propiedades estructurales a granel similares, sobre una gama de condiciones, tales como presión o temperatura . Propiedades físicas, tales como la densidad y índice de refracción tienden a caer dentro de valores característicos de la fase. La fase de la materia se define por la transición de fase, que es cuando la energía puesta o sacada del sistema entra en la reordenación de la estructura del sistema, en vez de cambiar las condiciones a granel.
A veces, la distinción entre las fases puede ser continua en vez de tener un límite discreto, en este caso la materia se considera para estar en una estado supercrítico. Cuando tres estados se encuentran basado en las condiciones, que se conoce como una punto triple y puesto que esto es invariante, es una manera conveniente de definir un conjunto de condiciones.
Los ejemplos más familiares de fases son sólidos , líquidos y los gases . Muchas sustancias exhiben fases sólidas múltiples. Por ejemplo, hay tres fases de sólido de hierro (alfa, gamma y delta) que varían basado en temperatura y presión. Una diferencia principal entre las fases sólidas es la estructura cristalina, o arreglo, de los átomos. Las fases menos familiares incluyen plasmas , Bose-Einstein y condensados fermiónicos y la paramagnético y fases ferromagnéticas de magnéticos materiales. Aunque la mayoría de las fases familiares se ocupan de los sistemas tridimensionales, es también posible definir análogos en sistemas bidimensionales, que ha recibido atención por su relevancia a los sistemas en biología .
Enlace químico
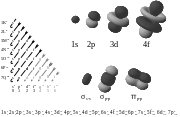
Un enlace químico es un concepto para la comprensión de cómo los átomos se pegan juntos en moléculas. Se puede visualizarse como la equilibrio de varios polos entre las cargas positivas en los núcleos y las cargas negativas que oscilan sobre ellas. Más que una simple atracción y repulsión, las energías y las distribuciones caracterizan la disponibilidad de un electrón para enlazar a otro átomo. Estos potenciales crean la interacciones que mantiene unidos los átomos en moléculas o cristales . En muchos compuestos simples, Enlace de valencia teoría, el modelo Valence Shell Electron repulsión de los pares ( RPECV), y el concepto de número de oxidación se puede utilizar para predecir la estructura molecular y la composición. Del mismo modo, las teorías de la física clásica se puede utilizar para predecir muchas estructuras iónicas. Con compuestos más complicados, tales como complejos metálicos, la teoría de enlace de valencia falla y enfoques alternativos, basada principalmente en los principios de la química cuántica , como la teoría de orbitales moleculares, son necesarios. Vea el diagrama en orbitarios electrónicos.
Reacción química
La reacción química es un concepto relacionado con la transformación de un sustancia química a través de su interacción con otra, o como resultado de su interacción con algunos forma de energía. Una reacción química puede ocurrir naturalmente o llevado a cabo en un laboratorio por los químicos en los buques especialmente diseñados que son a menudo cristalería de laboratorio. Puede dar lugar a la formación o la disociación de moléculas, es decir, moléculas que se rompen aparte para formar dos o más pequeñas moléculas, o reordenamiento de átomos dentro oa través de moléculas. Las reacciones químicas implican generalmente la fabricación o la rotura de los enlaces químicos . La oxidación, reducción, disociación, ácido-base neutralización y molecular reordenamiento son algunos de los tipos de reacciones químicas de uso común.
Una reacción química se puede representar simbólicamente a través de un ecuación química. Mientras que en una reacción química no nuclear el número y tipo de átomos en ambos lados de la ecuación son iguales, para una reacción nuclear esto es cierto sólo para las partículas nucleares a saber. protones y neutrones.
La secuencia de pasos en los cuales la reorganización de vínculos químicos pueda estar tomando lugar en el curso de una reacción química se llama su mecanismo. Una reacción química se puede prever para ocurrir en un número de pasos, cada uno de los cuales puede tener una velocidad diferente. Muchos intermedios de reacción con estabilidad variable se pueden prever durante el curso de una reacción. Se proponen mecanismos de reacción para explicar el cinética y la mezcla del producto relativo de una reacción. Muchos químicos físicos se especializan en la exploración y proponer los mecanismos de diversas reacciones químicas. Varias reglas empíricas, como la Reglas de Woodward-Hoffmann vienen a menudo práctico mientras que proponen un mecanismo para una reacción química.
Una definición más estricta es que "una reacción química es un proceso que resulta en la interconversión de especies químicas". Bajo esta definición, una reacción química puede ser un reacción elemental o una reacción paso a paso. Una advertencia adicional se hace, en que esta definición incluye casos en los interconversión de confórmeros es experimentalmente observable. Tales reacciones químicas perceptibles implican normalmente los sistemas de entidades moleculares según lo indicado por esta definición, pero a menudo es conceptualmente conveniente utilizar el término también para los cambios que implican las solas entidades moleculares (es decir "acontecimientos químicos microscópicos").
Energía
Una reacción química es invariablemente acompañada de un aumentar o disminución de la energía de las sustancias implicadas. Parte de la energía se transfiere entre el entorno y los reactivos de la reacción en forma de calor o ligero, así los productos de una reacción pueden tener más o menos energía que los reactivos. Una reacción se dice que es exotérmica si el estado final es más bajo en la escala de la energía que el estado inicial; en caso de reacciones endotérmicas la situación es lo contrario.
Las reacciones químicas no son invariable posibles a menos que los reactivo superen una barrera de energía conocida como la energía de activación . La velocidad de una reacción química (en la temperatura dada T) está relacionada con la energía de activación E, por el factor de la población de la Boltzmann 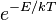 - Que es la probabilidad de molécula para tener energía mayor que o igual a E en la temperatura dada T. Esta dependencia exponencial de una velocidad de reacción de la temperatura se conoce como el Ecuación de Arrhenius. La energía de activación necesaria para una reacción química puede estar en la forma de calor, luz, electricidad o mecánica fuerza en la forma de ultrasonido.
- Que es la probabilidad de molécula para tener energía mayor que o igual a E en la temperatura dada T. Esta dependencia exponencial de una velocidad de reacción de la temperatura se conoce como el Ecuación de Arrhenius. La energía de activación necesaria para una reacción química puede estar en la forma de calor, luz, electricidad o mecánica fuerza en la forma de ultrasonido.
Un concepto relacionado energía libre, que incorpora consideraciones de la entropía también, es un medio muy útil para predecir la viabilidad de una reacción y determinar el estado de equilibrio de una reacción química, en termodinámica química. Una reacción es posible solamente si el cambio total en la energía libre de Gibbs es negativo, 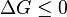 ; si es igual a cero la reacción química reputa en el equilibrio .
; si es igual a cero la reacción química reputa en el equilibrio .
Sólo hay unos estados posibles limitados de la energía para los electrones, los átomos y las moléculas. Éstos son determinados por las reglas de la mecánica cuántica , que requieren cuantización de la energía de un sistema encuadernado. Los átomos / las moléculas en un estado de energía más alto se dice que están entusiasmados. Las moléculas / átomos de la sustancia en un estado de energía emocionado son a menudo mucho más reactivos, que es favorable a las reacciones químicas.
La fase de una sustancia es determinada invariable por su energía y los de sus alrededores. Cuando las fuerzas intermoleculares de una sustancia son tales que la energía de los alrededores no es suficiente para superar ellos, se produce en una fase más ordenada como un líquido o sólido como es el caso con agua (H 2 O), un líquido a temperatura ambiente porque sus moléculas son limitadas por enlaces de hidrógeno. Mientras sulfuro de hidrógeno (H 2 S) es un gas a temperatura ambiente y presión estándar, ya que sus moléculas son limitadas por más débil interacciones dipolo-dipolo.
La transferencia de energía a partir de una sustancia química a otra depende del tamaño de la energía quanta emite desde una sola sustancia. Sin embargo, la energía térmica se transfiere fácilmente de casi cualquier sustancia a otra, principalmente debido a que los niveles de energía vibratoria y rotatoria en una sustancia están muy estrechamente colocados. Porque, los niveles de energía electrónicos no están tan estrechamente espaciados, la radiación electromagnética ultravioleta no se transfiere con igual felicidad, como es también el caso con energía eléctrica.
La existencia de niveles de energía característicos para diferentes sustancias químicas es útil para su identificación por el análisis de líneas espectrales de diferentes tipos de espectros utilizan a menudo en la espectroscopia por ejemplo en química IR, microondas, NMR, ESR etc. Esto se utiliza para identificar la composición de los objetos alejados - como estrellas y galaxias lejanas - mediante el análisis de su radiación (ver espectroscopía ).
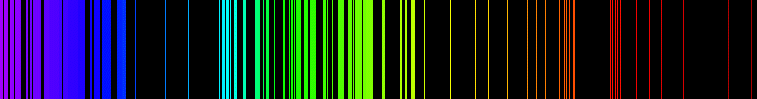
El término energía química se utiliza a menudo para indicar el potencial de una sustancia química para experimentar una transformación a través de una reacción química o transformar otras sustancias químicas.
Leyes químicas
Las reacciones químicas son gobernadas por ciertas leyes, que tienen conceptos fundamentales convertidos en química. Algunas de ellas son:
- Ley de conservación de la masa, según la física moderna es realmente la energía que se conserva, y que la energía y la masa son relacionados; un concepto que se convierte en importante química nuclear.
- Ley de conservación de la energía lleva a los conceptos importantes de equilibrio , la termodinámica , y cinética.
- Ley de composición definida, aunque en muchos sistemas (notablemente Biomacromolecules y minerales) los coeficientes tiendan a requerir grandes números, y se representa con frecuencia como fracción.
- Ley de las proporciones múltiples
- Ley de Hess
- Ley de Beer-Lambert
- La ley de difusión de Fick
- Ley de Raoult
- La ley de Henry
- La ley de Boyle (1662, relacionando la presión y volumen)
- La ley de Charles (1787, relacionando el volumen y la temperatura)
- Ley de Gay-Lussac (1809, relacionando la presión y temperatura)
- La ley de Avogadro
Subdisciplinas
Química se divide típicamente en varias subdisciplinas importantes. Hay también varios campos cruz-disciplinarios y especializados principales de la química.
- La química analítica es el análisis de las muestras materiales para ganar una comprensión de su composición química y estructura. Química analítica incorpora métodos experimentales normalizados en la química. Estos métodos se pueden utilizar en todas las subdisciplinas de la química, excepto química puramente teórica.
- Bioquímica es el estudio de las sustancias químicas , las reacciones químicas y química las interacciones que tienen lugar en que viven los organismos . Bioquímica y la química orgánica están estrechamente relacionados, como en la química médica o neuroquímica. Bioquímica también se asocia con la biología molecular y la genética .
- La química inorgánica es el estudio de las propiedades y reacciones de compuestos inorgánicos. La distinción entre las disciplinas orgánicas e inorgánicas no es absoluta y hay mucha coincidencia, más importante en la subdisciplina de la la química organometálica.
- Materiales química es la preparación, caracterización, y la comprensión de sustancias con una función útil. El campo es una nueva anchura del estudio en programas graduados, e integra elementos de todas las áreas clásicas de la química con un enfoque en temas fundamentales que son únicos a los materiales. Los sistemas primarios de estudio incluyen la química de las fases condensadas (sólidos, líquidos, polímeros) y interfaces entre diferentes fases.
- La química nuclear es el estudio de cómo las partículas subatómicas vienen juntas y hacen núcleos. Moderno La transmutación es un componente grande de la química nuclear, y la tabla de núclidos es un resultado importante y una herramienta para este campo.
- La química orgánica es el estudio de la estructura, propiedades, composición, mecanismos y reacciones de compuestos orgánicos . Un compuesto orgánico se define como cualquier compuesto basado en un esqueleto de carbono.
- La química física es el estudio de la base física y fundamental de sistemas y procesos químicos. En particular, la energética y las dinámicas de tales sistemas y procesos están de interés a los químicos físicos. Áreas de estudio importantes incluyen la termodinámica química, cinética química, electroquímica, mecánicos estadísticos , y la espectroscopia . La química física tiene coincidencia grande con la física molecular . La química física implica el uso de cálculo en la derivación de las ecuaciones. Por lo general se asocia con la química cuántica y la química teórica. La química física es una disciplina distinta de la la física química.
- La química teórica es el estudio de la química vía el razonamiento teórico fundamental (generalmente dentro de matemáticas o de la física ). En particular, la aplicación de la mecánica cuántica a la química se llama química cuántica . Desde el final de la Segunda Guerra Mundial , el desarrollo de ordenadores ha permitido un desarrollo sistemático de la química computacional , que es el arte de desarrollar y aplicar programas de ordenador para la resolución de problemas químicos. La química teórica tiene coincidencia grande con (teórico y experimental) la física de la materia condensada y la física molecular .
Otros campos incluyen Astroquímica, La química atmosférica, Ingeniería Química, Biología química, Chemo-informática, Electroquímica, Química ambiental, El flujo química, Geoquímica, La química verde, Historia de la química, ciencia de los materiales , Química matemática, La química médica, Biología Molecular, La nanotecnología, Enología, La química organometálica, Petroquímica, Farmacología , Fotoquímica, Fitoquímica, La química de polímeros, Química del estado sólido, Sonochemistry, Química supramolecular, Química de la superficie, Inmunoquímica y Termoquímica.
Industria química
La industria química representa una actividad económica importante. Los productores químicos del top 50 globales tenían en 2004 ventas de 587 mil millones de dólares estadounidenses , con un margen de beneficio del 8,1% y el gasto en investigación y desarrollo del 2,1% de las ventas químicas totales.
Las sociedades profesionales
- American Chemical Society
- Instituto Químico de Canadá
- Sociedad Química del Perú
- Unión Internacional de Química Pura y Aplicada
- Real Instituto Químico de Australia
- Real Sociedad de Química
- Sociedad de la Industria Química
- Asociación Mundial de Químicos Teóricos y Computacionales

