Absolutamente nada
Antecedentes
SOS Children han producido una selección de artículos de Wikipedia para escuelas desde 2005. Ver http://www.soschildren.org/sponsor-a-child para averiguar sobre el apadrinamiento de niños.
El cero absoluto es la más baja posible la temperatura en la que nada podría ser más frío, y sin calor de energía permanece en una sustancia. El cero absoluto es el punto en el que las moléculas no se mueven (en relación con el resto del cuerpo) más de lo que se requiere que por una mecánica cuántica efecto llamado energía de punto cero. Es un límite teórico y no se puede lograr.
Por acuerdo internacional, el cero absoluto se define como, precisamente, 0 K en el Kelvin escala, que es un (absoluta) temperatura termodinámica escala y -273,15 ° C en el Celsius escala (centígrados). El cero absoluto también es precisamente equivalente a 0 ° R en el Escala Rankine (también una escala de temperatura termodinámica), y -459,67 ° F en el Escala Fahrenheit. Aunque no es posible enfriar cualquier sustancia a 0 K, los científicos han hecho grandes avances en el logro de las temperaturas cercanas al cero absoluto, donde exhibe la materia efectos cuánticos tales como la superconductividad y superfluidez. De hecho, en 2000 la Universidad Tecnológica de Helsinki informó que alcanzan temperaturas de 100 pK (1 × 10 -10 K).
Historia
Uno de los primeros en hablar de la posibilidad de un "frío absoluto" en una escala tal fue Robert Boyle quien en sus 1.665 nuevos experimentos y observaciones que tocan Fría, declaró la disputa que es el frigidum primum es muy conocido entre los naturalistas, algunos contender por la tierra, otros para el agua, otros por el aire, y algunos de los modernos para nitro, pero todos parecían estar de acuerdo en que:
| " | Hay un poco de cuerpo u otro que es de su propia naturaleza supremamente frío y por la participación de los cuales todos los demás órganos obtengan esa calidad. | " |
Limite el 'grado de frío "
La cuestión de si existe un límite en el grado de frío posible, y, si es así, dónde se debe colocar el cero, fue atacado por primera vez por el físico francés Guillaume Amontons en 1702, en relación con sus mejoras en el termómetro de aire y en sus temperaturas de instrumentos fueron indicados por la altura a la que una columna de mercurio fue sostenido por una cierta masa de aire, el volumen o el "resorte" que por supuesto varía con el calor al que se expone. Por lo tanto, Amontons argumentaron que el cero de su termómetro sería la temperatura a la que el resorte del aire en ella se redujo a nada. En la escala que se utiliza, el punto de ebullición del agua se marcó a 73 y el punto de fusión del hielo a 51, de modo que el cero de su escala fue equivalente a aproximadamente -240 en la escala Celsius.
Esta notablemente aproximación cercana al valor moderno de -273,15 ° C para el cero del aire termómetro, se mejora aún más por Johann Heinrich Lambert, quien le dio el valor de -270 ° C y observó que esta temperatura puede ser considerado como el frío absoluto.
Los valores de este para que el cero absoluto no fueron, sin embargo, universalmente aceptadas sobre este período. Pierre-Simon Laplace y Antoine Lavoisier , en su tratado sobre el calor 1780, llegaron a valores que van de 1500 a 3000 por debajo del punto de congelación del agua, y pensó que en cualquier caso debe ser de al menos 600 a continuación. John Dalton en su Filosofía Química dio diez cálculo de este valor, y finalmente adoptó -3000 ° C como el cero natural de la temperatura.
Puesto que la temperatura es la medida de la energía cinética media en un sistema, es posible que algunas moléculas de alcanzar un estado de no energía cinética mientras que otros tienen más energía cinética de la energía medida. Dado que el promedio entre las mediciones inferiores y superiores nos dan la temperatura leemos, es muy posible que algunas moléculas para alcanzar cero Kelvin.
La obra de Lord Kelvin
Después JP Joule había determinado el equivalente mecánico del calor, Lord Kelvin abordó la cuestión desde un punto de vista totalmente diferente, y en 1848 ideó una escala de temperatura absoluta que era independiente de las propiedades de cualquier sustancia en concreto y se basa únicamente en lo fundamental leyes de la termodinámica. De ello se desprende de los principios sobre los que se construyó esta escala que su cero se colocó en -273.150 ° C, en casi exactamente el mismo punto que el cero del aire termómetro.
Información Adicional
Se puede demostrar a partir de las leyes de la termodinámica que el cero absoluto nunca se puede lograr artificialmente, aunque es posible alcanzar temperaturas cerca de ella mediante el uso de Sistemas de refrigeración criogénicos. Este es el mismo principio que asegura que no se máquina puede ser 100% eficiente.
A temperaturas muy bajas en las proximidades de cero absoluto, la materia exhibe muchas propiedades inusuales, incluyendo la superconductividad , superfluidez, y La condensación de Bose-Einstein. Con el fin de estudiar tales fenómenos, los científicos han trabajado para obtener temperaturas cada vez más bajas.
- En 1994, investigadores de la NIST alcanzó una temperatura fría el entonces récord de 700 nK (mil millonésimas de kelvin).
- En noviembre de 2000 se registraron temperaturas de espín nuclear por debajo de 100 pK para un experimento en el Universidad de Helsinki de Baja Temperatura Laboratorio de Tecnología. Sin embargo, esta fue la temperatura de un grado particular de la libertad de una propiedad cuántica llamada espín-no la temperatura termodinámica promedio general nuclear para todos los posibles grados de libertad.
- En febrero de 2003, el Nebulosa Boomerang se encontró que era -272,15 ° C; 1 K, el lugar más frío conocido fuera de un laboratorio. La nebulosa es 5.000 años luz de la Tierra y se encuentra en la constelación Centaurus.
Termodinámica cercanas al cero absoluto
A temperaturas cercanas a 0 K, movimiento casi todos molecular cesa y 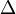 S = 0 para cualquier proceso adiabático. Las sustancias puras pueden (idealmente) formar perfectos cristales como T
S = 0 para cualquier proceso adiabático. Las sustancias puras pueden (idealmente) formar perfectos cristales como T 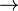 0. Max Planck forma fuerte de la 's tercera ley de la termodinámica establece la entropía de un cristal perfecto desvanece en el cero absoluto. Sin embargo, esto no puede ser cierto si el estado de menor energía es degenerado, o más de uno microestado. El original Teorema de Nernst calor hace que la demanda más débil y menos polémico que el cambio de entropía para cualquier proceso isotérmico aproxima a cero cuando T
0. Max Planck forma fuerte de la 's tercera ley de la termodinámica establece la entropía de un cristal perfecto desvanece en el cero absoluto. Sin embargo, esto no puede ser cierto si el estado de menor energía es degenerado, o más de uno microestado. El original Teorema de Nernst calor hace que la demanda más débil y menos polémico que el cambio de entropía para cualquier proceso isotérmico aproxima a cero cuando T 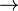 0
0
La implicación es que la entropía de un cristal perfecto, simplemente se acerca a un valor constante.
El postulado de Nernst identifica el isoterma T = 0 como coincidente con el adiabat S = 0, aunque otras isotermas y adiabáticas son distintos. Como no hay dos adiabáticas se cruzan, hay otra adiabática puede intersectar el T = 0 isoterma. En consecuencia hay un proceso adiabático iniciado a temperatura distinta de cero puede llevar a la temperatura cero. (≈ Callen, pp. 189-190)
Una afirmación aún más fuerte es que es imposible por cualquier procedimiento para reducir la temperatura de un sistema a cero en un número finito de operaciones. (≈ Guggenheim, p. 157)
Un cristal perfecto es aquel en el que el interno estructura de la red se extiende sin interrupción en todas las direcciones. El perfecto orden puede ser representado por traslación simetría a lo largo de tres (no generalmente ortogonal) ejes . Cada elemento de entramado de la estructura está en su lugar apropiado, si se trata de un solo átomo o una agrupación molecular. Para sustancias que tienen dos (o más) formas cristalinas estables, como el diamante y grafito de carbono , hay una especie de "degeneración química". La pregunta sigue siendo si ambos pueden tener entropía cero a T = 0, aunque cada uno está perfectamente ordenado.
Cristales perfectos nunca ocurren en la práctica; imperfecciones y materiales amorfos incluso enteras, simplemente son "congelados en" a bajas temperaturas, por lo que las transiciones a más no se produzcan estados estables.
Usando el Modelo de Debye, la el calor y la entropía de un cristal puro específica son proporcionales a T 3, mientras que la entalpía y potencial químico es proporcional a T 4. (Guggenheim, p. 111) Estas cantidades caer hacia sus T = 0 valores límite y el enfoque con cero pistas. Para los calores específicos, por lo menos, el valor límite en sí es definitivamente cero, como se ve confirmada por los experimentos por debajo de 10 K. Incluso el menos detallado Einstein modelo muestra esta curiosa caída de los calores específicos. De hecho, todos los calores específicos se desvanecen en el cero absoluto, no sólo los de los cristales. Asimismo para el coeficiente de expansión térmica. Las relaciones de Maxwell muestran que varias otras cantidades también se desvanecen. Estos fenómenos eran imprevisto.
Dado que la relación entre los cambios en la energía de Gibbs , la entalpía y la entropía es
Así, como T disminuye, Δ Δ G y H se aproximan entre sí (siempre que está delimitada Δ S). Experimentalmente, se ha encontrado que todos los procesos espontáneos (incluyendo reacciones químicas ) resultan en una disminución de G a medida que avanzan hacia equilbrium. Si Δ S y / o T son pequeñas, la condición Δ G <0 puede implicar que Δ H <0, lo que indicaría un reacción exotérmica que libera calor. Sin embargo, esto no es necesario; reacciones endotérmicas pueden proceder de forma espontánea si el término T Δ S es lo suficientemente grande.
Más que eso, las laderas de los derivados de temperatura de Δ G y Δ H convergen y son iguales a cero en T = 0, lo que asegura que Δ Δ G y H son casi los mismos en un intervalo considerable de las temperaturas, lo que justifica la aproximación empírica Principio de Thomsen y Berthelot, que dice que el estado de equilibrio a la que un sistema procede es la que se desarrolla la mayor cantidad de calor, es decir, un proceso real es la más exotérmica. (Callen, pp. 186-187)
Relación con Bose Einstein Condensados
La Bose-Einstein es una sustancia que se comporta muy inusual pero sólo a temperaturas extremadamente bajas, tal vez unas pocas millonésimas encima del cero absoluto. Es en este punto el leyes de la termodinámica se vuelven muy importantes.
Escalas de temperatura absolutas
Absoluto o temperatura termodinámica se mide convencionalmente en grados Kelvin ( Celsius -scaled incrementos), y cada vez más rara en el Escala Rankine ( Incrementos a escala Fahrenheit). Temperatura absoluta se determina de forma única hasta una constante multiplicativa que especifica el tamaño del "grado", por lo que las proporciones de dos temperaturas absolutas, T 2 / T 1, son los mismos en todas las escalas. La definición más transparente proviene de la clásica Distribución sobre energías, o de los análogos cuánticos Maxwell-Boltzmann: Estadística de Fermi-Dirac (partículas de medio entero spin) y Estadística de Bose-Einstein (partículas de espín entero), todos los cuales dan el número relativo de partículas como (decreciente) funciones exponenciales de energía más kT. En un nivel macroscópico, una definición puede darse en términos de la eficiencia de "reversible" motores de calor que opera entre depósitos térmicos más calientes y más frías.
Temperaturas negativas
Ciertos sistemas semi-aisladas, tales como un sistema de no interactúan gira en un campo magnético, puede alcanzar temperaturas negativas; sin embargo, no son en realidad más frío que el cero absoluto. Se pueden sin embargo considerarse como "más caliente que T = ∞", como energía fluirá desde un sistema de temperatura negativo a cualquier otro sistema con la temperatura positivo al contacto.