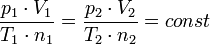La loi d'Avogadro
Saviez-vous ...
SOS Enfants, qui se déroule près de 200 sos écoles dans le monde en développement, a organisé cette sélection. enfants SOS est le plus grand don de charité du monde enfants orphelins et abandonnés la chance de la vie familiale.
La loi d'Avogadro (Hypothèse d'Avogadro, ou Principe d'Avogadro) est un loi des gaz nommé d'après Amedeo Avogadro, qui, en 1811 l'hypothèse que:
- Des volumes égaux de gaz parfaits ou parfaits, à la même température et à la pression, contiennent le même nombre de particules ou molécules.
Ainsi, le nombre de molécules spécifiques dans un volumique de gaz est indépendante de la taille ou de la masse des molécules de gaz lorsqu'elles se rapportent à un gaz idéal approximative. Il est très important de noter que nous appliquons un gaz parfait ou la définition des gaz parfaits (un gaz hypothétique constitué de particules identiques de volume nul, sans forces intermoléculaires, mais la capacité à échanger dynamique avec des molécules de gaz identiques) à un gaz réel comme l'hydrogène ou l'azote afin que nous puissions statistiquement rapprocher le comportement de gaz réel.
A titre d'exemple, des volumes égaux d'moléculaire de l'hydrogène et de l'azote ne contenir le même nombre de molécules, tant qu'ils sont à la même température et pression et observer le comportement de gaz idéal ou parfait. Alors que ce ne est pas le cas réel de monde, il est statistiquement très proche.
L'aspect mineur de la loi peut être déclaré mathématiquement comme:
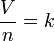 .
.
où:
- V est le volume du gaz.
- n est le nombre de taupes dans le gaz.
- k est une constante de proportionnalité.
Cependant, cette équation ci-dessus est seulement une trivial, qui est valable pour toutes les substances homogènes, y compris les liquides et les solides homogènes. Cette relation est facile de déduire; sa validité a supposé avant le travail d'Avogadro.
La conséquence la plus importante de la loi d'Avogadro est la suivante: La constante des gaz parfaits a la même valeur pour tous les gaz. Cela signifie que la constante
où:
- p est la pression du gaz
- T est la température du gaz
a la même valeur pour tous les gaz, indépendamment de la taille ou de la masse des molécules de gaz. Cette déclaration ne est pas triviale, et il incarne aperçu ingénieuse d'Avogadro dans la nature de gaz parfaits. Il a fallu des décennies pour prouver la loi d'Avogadro sur la base du théorie cinétique des gaz.
Une mole d'un gaz parfait occupe 22,4 litres (dm³) à STP, et occupe 24,45 litres au SATP (température ambiante et à la pression = 25 degrés C et 1 atm / 101,3 kPa). Ce volume est souvent désigné sous le nom volume molaire d'un gaz parfait. Gaz réels peuvent se écarter de cette valeur.
Le nombre de molécules dans une mole est appelé nombre d'Avogadro : environ 6,022 × 10 23 particules par mole.
La loi d'Avogadro, avec le combiné loi des gaz, constitue la loi des gaz parfaits.