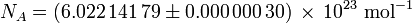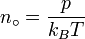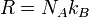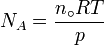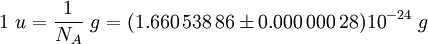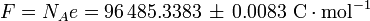Constante d'Avogadro
Contexte des écoles Wikipédia
SOS Enfants produite ce site pour les écoles ainsi que ce site de vidéo sur l'Afrique . Visitez le site Web d'enfants SOS au http://www.soschildren.org/
La constante d'Avogadro (symboles: L, N A), appelée aussi le nombre d'Avogadro est le nombre de «entités» (en général, des atomes ou molécules) dans une en mole, qui est, le nombre de carbone-12 atomes de 12 grammes (0,012 kg ) de carbone-12 non liée à l'état du sol. La meilleure estimation actuelle de ce nombre est:
La valeur du nombre a d'abord été signalée par Johann Josef Loschmidt, qui en 1865, a calculé le nombre de particules dans un centimètre cube de gaz dans des conditions standard. Le terme Loschmidt constant est donc plus correctement appliqué pour cette dernière valeur, qui peut être dit être proportionnelle au nombre d'Avogadro. Cependant, dans la langue allemande littérature, "Loschmidt constante" est utilisé pour désigner à la fois cet usage, ainsi que le nombre d'entités dans un grain de beauté.
Histoire et étymologie
La constante d'Avogadro est nommé d'après le début du XIXe siècle italien scientifique Amedeo Avogadro, qui est crédité (1811) d'être le premier à se rendre compte que le volume d'un gaz (strictement, d'une gaz idéal) est proportionnelle au nombre d' atomes ou de molécules . Le chimiste français Jean Perrin en 1909 a proposé de nommer la constante d'Avogadro en l'honneur. Manuels de chimie américains ramassèrent dans les années 1930, suivie par les manuels du secondaire à partir dans les années 1950.
Loschmidt: mesurer le nombre d'Avogadro
Avogadro n'a jamais tenté de mesurer la constante: la valeur numérique a été estimé par le premier autrichienne physicien Johann Josef Loschmidt en 1865 en utilisant le théorie cinétique des gaz. Dans les pays germanophones, la constante est parfois désigné sous le nom Loschmidt constante ou le numéro de Loschmidt, mais ce Loschmidt réellement mesurée est le nombre de particules par unité de volume d'un gaz parfait, à savoir la densité en nombre de particules dans un gaz parfait. Ainsi, le terme Loschmidt constante est plus approprié au nombre de particules par unité de gaz, Symbole: n o:
égal à (2,686 ± 7,774 0,000 0047) × 10 25 m -3 à 273,15 K et 101,325 avec k B kPa le Constante de Boltzmann, T la température et la p pression.
Cette constante est liée à la constante d'Avogadro par la relation:
avec k B la Constante de Boltzmann, et R le constante des gaz, donc
Cependant, dans allemand littérature scientifique, le terme Loschmidt constante est utilisé de façon ambiguë - il se réfère souvent à ce qui est venu pour être connu comme nombre d'Avogadro. Cependant, Boltzmann avait d'abord utilisé le terme pour le sens dans lequel Loschmidt avait mesuré elle - le nombre de particules dans un volume unitaire de gaz. Ainsi, son utilisation dans référant au nombre de Avogadro liés prête à confusion et est généralement déconseillée. Pour la même raison, le nombre d'Avogadro parfois est désignée par L par rapport à N A dans les textes allemands.
Normalisation de la taupe
Avant 1960, il y avait conflit définitions du taupe, et donc du nombre d'Avogadro (comme on l'appelait à l'époque), basé sur 16 grammes d'oxygène: les physiciens généralement utilisés oxygène-16 tandis chimistes utilisés généralement "naturellement" rapport isotopique.
Commutation, en 1960, à 12 grammes de carbone-12 de base terminé ce différend et a eu d'autres avantages. A ce moment, le nombre d'Avogadro a été définie comme le nombre d'atomes dans 12 g de carbone-12, qui est aussi un quantité sans dimension, tandis que la taupe a été définie comme une Avogadro nombre d'atomes, de molécules ou d'autres entités.
Lorsque la taupe est entré dans la Système international d'unités (SI), en 1971, les définitions ont été échangés.
En 1971, un grain de beauté a été défini comme le nombre d'atomes dans 12 grammes de carbone-12, avec sa propre dimension, «quantité de matière», à savoir. Le nombre d'Avogadro est devenu un constante physique avec l'unité de moles réciproques (mol -1).
Application
La constante d'Avogadro peut être appliquée à ne importe quelle substance. Il correspond au nombre d'atomes ou de molécules nécessaires pour constituer une masse égale à la substance de atomique ou moléculaire de masse , en grammes. Par exemple, la masse atomique du fer est 55,847 g / mol, de sorte N A atomes de fer (ce est à dire une mole d'atomes de fer) a une masse de 55,847 g. Inversement, 55,847 g de fer contient N A atomes de fer. La constante d'Avogadro entre également dans la définition de la unité de masse atomique unifiée, u:
Relations physiques supplémentaires
En raison de son rôle en tant que facteur d'échelle, le nombre d'Avogadro assure le lien entre un certain nombre de constantes physiques utiles lors du déplacement entre le échelle atomique et l'échelle macroscopique. Par exemple, elle fournit la relation entre:
- la R constante et le gaz Boltzmann k constante B:
- en J mol -1 K -1
- la Constante de Faraday F et le charge élémentaire e:
- en C mol -1
Mesure de la constante d'Avogadro

Un certain nombre de méthodes peuvent être utilisées pour mesurer la constante d'Avogadro. Une méthode moderne consiste à calculer la constante d'Avogadro à partir de la densité (ρ) d'un cristal, la masse atomique relative (M), et la longueur de cellule unitaire (a) déterminé à partir de cristallographie aux rayons X. Des valeurs très précises de ces quantités pour le silicium ont été mesurées à la National Institute of Standards and Technology (NIST) et utilisé pour obtenir la valeur de la constante d'Avogadro:
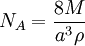 .
.
- à base de silicium.