
Espectroscopia de resonancia magnética nuclear
Antecedentes de las escuelas de Wikipedia
Voluntarios SOS ayudaron a elegir artículos e hicieron otro material curricular Haga clic aquí para obtener información sobre el apadrinamiento de niños.

Espectroscopia de resonancia magnética nuclear, más comúnmente conocida como espectroscopía de RMN, es una técnica de investigación que explota las magnéticos propiedades de ciertos núcleos atómicos . Se determina las propiedades físicas y químicas de los átomos o las moléculas en las que están contenidos. Se basa en el fenómeno de la resonancia magnética nuclear y puede proporcionar información detallada sobre la estructura, la dinámica, el estado de reacción, y el entorno químico de las moléculas.
Con mayor frecuencia, la espectroscopía de RMN se utiliza por los químicos y bioquímicos para investigar las propiedades de las moléculas orgánicas , aunque es aplicable a cualquier tipo de muestra que contiene núcleos que posee giro. Las muestras adecuadas van desde pequeños compuestos analizados con 1-dimensional protón o carbono-13 espectroscopía de RMN a grandes proteínas o ácidos nucleicos usando 3 o técnicas de 4 dimensiones. El impacto de la espectroscopia de RMN en las ciencias ha sido sustancial, debido a la variedad de información y la diversidad de las muestras, incluyendo soluciones y sólidos.
Técnicas básicas de RMN

Cuando se coloca en un campo magnético, núcleos activos en RMN (tales como 1 H o 13 C) absorben radiación electromagnética a una característica de frecuencia del isótopo . La frecuencia de resonancia, la energía de la absorción, y la intensidad de la señal son proporcionales a la fuerza del campo magnético. Por ejemplo, en un 21 Tesla de campo magnético, los protones resuenan a 900 MHz. Es común para referirse a un 21 T como un imán 900 MHz imán, aunque diferentes núcleos resuenan a una frecuencia diferente en esta intensidad de campo en proporción a su momentos magnéticos nucleares.
Desplazamiento químico
Una carga de hilado genera un campo magnético que resulta en un momento magnético proporcional a la vuelta. En presencia de un campo magnético externo, existen dos estados de espín (para un núcleo de espín 1/2): un giro y un giro hacia abajo, donde uno se alinea con el campo magnético y el otro se opone a ella. La diferencia de energía (AE) entre los dos estados de espín aumenta a medida que la intensidad del campo aumenta, pero esta diferencia es generalmente muy pequeña, lo que lleva a la necesidad de fuertes imanes RMN (1-20 T para instrumentos de RMN modernos). La irradiación de la muestra con la energía correspondiente a la separación exacta estado de espín de un conjunto específico de núcleos hará que la excitación de los establecidos de núcleos en el estado de menor energía para el estado de energía más alto.
Para espín 1/2 núcleos, la diferencia de energía entre los dos estados de espín en una intensidad de campo magnético dado son proporcionales a sus momentos magnéticos. Sin embargo, incluso si todos los protones tienen los mismos momentos magnéticos, no dar señales resonantes en los mismos valores de campo / frecuencia. Esta diferencia surge de los entornos electrónicos diferentes del protón. Tras la aplicación de un campo magnético externo, estos electrones se mueven en respuesta al campo y generan campos magnéticos locales que se oponen al campo aplicado mucho más fuerte. Este campo local, por lo tanto, "escudos" el protón del campo magnético aplicado, por lo tanto, que es necesario incrementar el fin de lograr la resonancia (absorción de energía de RF). Tales incrementos son muy pequeños, normalmente en partes por millón (ppm). La diferencia entre 2.3487T y 2.3488T trata por tanto de 42ppm. Sin embargo una escala de frecuencia se utiliza comúnmente para designar las señales de RMN, a pesar de que el espectrómetro puede operar mediante el barrido del campo magnético, y por lo tanto la 42 ppm es 4200 Hz para una frecuencia de referencia de 100 MHz (rf).
Sin embargo, dado que la ubicación de diferentes señales de RMN depende de la intensidad de campo magnético externo y la frecuencia de RF, las señales generalmente se reportan en relación con una señal de referencia, por lo general la de TMS ( tetrametilsilano). Además, ya que la distribución de señales de RMN es el campo dependiente, estas frecuencias se dividen por la frecuencia del espectrómetro. Sin embargo, ya estamos dividiendo Hz por MHz, el número resultante sería demasiado pequeño, y por lo que se multiplica por un millón. Por lo tanto, esta operación da un número localizador llamado el "desplazamiento químico" con unidades de partes por millón. Para detectar tales diferencias pequeña de frecuencia del campo magnético aplicado debe ser constante en todo el volumen de la muestra. Espectrómetros de RMN de alta resolución utilizan cuñas para ajustar la homogeneidad del campo magnético a partes por mil millones ( ppb) en un volumen de unos pocos centímetros cúbicos. En general, los desplazamientos químicos de los protones son altamente predecibles ya que los cambios están determinados principalmente por efectos de apantallamiento más simples (de densidad de electrones), pero los desplazamientos químicos para muchos núcleos más pesados son más fuertemente influenciados por otros factores, incluyendo estados excitados (contribución "paramagnético" a blindaje tensor).

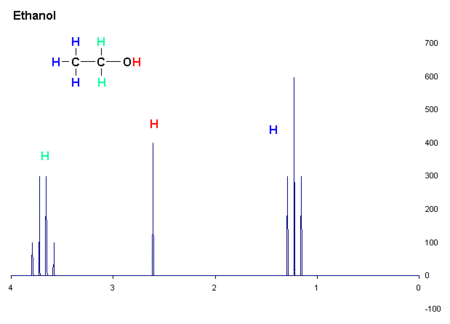
El desplazamiento químico proporciona información acerca de la estructura de la molécula. La conversión de los datos en bruto a esta información se llama asignación de espectro. Por ejemplo, para el espectro de 1H-RMN para el etanol (CH 3 CH 2 OH), cabría esperar que las señales en cada uno de tres desplazamientos químicos específicos: uno para el grupo C 3 H, uno para el grupo C H 2 y una para el grupo O H. Un grupo típico CH 3 tiene un desplazamiento de alrededor de 1 ppm, un CH 2 unido a un OH tiene un desplazamiento de alrededor de 4 ppm y un OH tiene un desplazamiento de alrededor de 2-3 ppm, dependiendo del disolvente utilizado.
En Espectroscopía de RMN paramagnética, las mediciones se realizaron sobre muestras paramagnéticas. El paramagnetismo da lugar a muy diversos desplazamientos químicos. En la espectroscopia 1H NMR, el rango de desplazamiento chemcial puede abarcar 500 ppm.
Debido al movimiento molecular a temperatura ambiente, los tres protones metílicos promedio a cabo durante el curso del experimento de RMN (que normalmente requiere unos pocos sra). Estos protones se convierten en degenerar y formar un pico en el mismo desplazamiento químico.
La forma y el área de los picos son indicadores de la estructura química también. En el ejemplo anterior-el espectro de protón de etanol-el pico CH 3 tiene tres veces el área como el pico OH. Del mismo modo el pico CH 2 sería dos veces el área del pico de OH pero sólo 2/3 del área del pico de CH 3.
Software permite el análisis de intensidad de la señal de los picos, que bajo condiciones de relajación óptima, se correlacionan con el número de protones de ese tipo. Análisis de intensidad de la señal se realiza mediante la integración proceso matemático -la que calcula el área bajo una curva. El analista debe integrar el pico y no medir su altura, porque los picos también tienen anchura -y por lo tanto su tamaño depende de su área no su altura. Sin embargo, se debe mencionar que el número de protones, o cualquier otro núcleo observado, es sólo proporcional a la intensidad, o la integral de la señal de RMN en los experimentos de RMN de una dimensión muy simples. En experimentos más elaborados, por ejemplo, experimentos utilizan normalmente para obtener -13 espectros de RMN de carbono, la integral de las señales depende de la velocidad de relajación del núcleo, y sus constantes escalares y de acoplamiento dipolar. Muy a menudo, estos factores son poco conocidas - por lo tanto, la integral de la señal de RMN es muy difícil de interpretar en más complicados experimentos de RMN.
J-acoplamiento
| Multiplicidad | Relación de intensidad |
|---|---|
| Singlete (s) | 1 |
| Doblete (d) | 1: 1 |
| Triplete (t) | 1: 2: 1 |
| Cuarteto (q) | 1: 3: 3: 1 |
| Quinteto | 1: 4: 6: 4: 1 |
| Sexteto | 1: 5: 10: 10: 5: 1 |
| Septeto | 1: 6: 15: 20: 15: 6: 1 |
Parte de la información más útil para la determinación de la estructura en un espectro de RMN unidimensional proviene de J-acoplamiento o acoplamiento escalar (un caso especial de acoplamiento spin-spin) entre los núcleos activos de RMN. Este acoplamiento surge de la interacción de diferentes estados de espín a través de los enlaces químicos de una molécula y los resultados en la división de señales de RMN. Estos patrones de división pueden ser simples o complejos y, asimismo, puede ser francamente interpretable o engañosa. Este acoplamiento proporciona una visión detallada de la conectividad de los átomos en una molécula.
El acoplamiento a n equivalente (spin ½) núcleos divide la señal en un n 1 multiplete con ratios de intensidad tras el triángulo de Pascal como se describe a la derecha. El acoplamiento de giros adicionales dará lugar a más desdoblamientos de cada componente del multiplete por ejemplo acoplamiento a dos giro diferente ½ núcleos con significativamente diferentes constantes de acoplamiento dará lugar a un doblete de dobletes (abreviatura: dd). Tenga en cuenta que el acoplamiento entre los núcleos que son químicamente equivalentes (es decir, tienen el mismo desplazamiento químico) no tiene efecto sobre los espectros de RMN y los acoplamientos entre los núcleos que son distantes (por lo general más de 3 bonos aparte para los protones en las moléculas flexibles) son por lo general demasiado pequeña para causar splittings observables. acoplamientos de largo alcance sobre menudo se pueden observar en más de tres enlaces cíclica y compuestos aromáticos, que conducen a patrones de desdoblamiento más complejo.
Por ejemplo, en el espectro de protones para el etanol ha descrito anteriormente, el grupo CH 3 se divide en un triplete con una relación de intensidad de 1: 2: 1 por los dos vecinos CH 2 protones. Del mismo modo, la CH 2 se divide en un cuarteto con una relación de intensidad de 1: 3: 3: 1 por los tres vecinos CH 3 protones. En principio, los dos CH 2 protones también se dividen de nuevo en un doblete para formar un doblete de cuartetos por el protón hidroxilo, pero el intercambio intermolecular del protón hidroxilo ácida a menudo resulta en una pérdida de acoplamiento de información.
El acoplamiento a cualquier giro ½ núcleos tales como el fósforo-31 o flúor-19 obras de esta manera (aunque las magnitudes de las constantes de acoplamiento puede ser muy diferente). Sin embargo, los patrones de desdoblamiento difieren de los descritos anteriormente para núcleos con spin mayor que ½ porque el número cuántico de espín tiene más de dos valores posibles. Por ejemplo, el acoplamiento de deuterio (un giro 1 núcleo) divide la señal en una relación 1: 1: 1 triplete porque el espín 1 tiene tres estados de espín. Del mismo modo, un núcleo de espín 3/2 divide una señal en un 1: 1: 1: 1 cuarteto y así sucesivamente.
Acoplamiento combinado con el desplazamiento químico (y la integración de los protones) nos dice no sólo sobre el entorno químico de los núcleos, sino también el número de vecinos núcleos activos de RMN dentro de la molécula. En los espectros más compleja con múltiples picos en los desplazamientos químicos similares o en los espectros de los núcleos distintos de hidrógeno, el acoplamiento es a menudo la única manera de distinguir los diferentes núcleos.
De segundo orden (o fuerte) acoplamiento
La descripción anterior supone que la constante de acoplamiento es pequeño en comparación con la diferencia en las frecuencias de RMN entre los espines no equivalentes. Si la separación de cambio disminuye (o el grado de acoplamiento aumenta), los patrones de intensidad multiplete están distorsionados primero, y luego se vuelven más complejas y menos fácilmente analizado (especialmente si más de dos giros están involucrados). Intensificación de algunos picos en un multiplete se consigue a expensas del resto, que a veces casi desaparece en el ruido de fondo, aunque el área integrada bajo los picos permanece constante. En la mayoría de RMN de campo alto, sin embargo, las distorsiones son generalmente modesta y las distorsiones característicos (para techos) pueden, de hecho, ayuda a identificar los picos relacionados.
Efectos de segundo orden disminuyen a medida que la diferencia de frecuencia entre multipletes aumenta, por lo que de alto campo (es decir, de alta frecuencia) pantalla espectros de RMN menos distorsión que los espectros de frecuencia más baja. Espectros temprano a las 60 MHz eran más propensos a la distorsión que los espectros de las máquinas posteriores típicamente funcionan en frecuencias de 200 MHz o superior.
Inequivalencia magnética
Efectos más sutiles, pueden ocurrir si químicamente giros equivalente (es decir, núcleos relacionados por simetría y así tener la misma frecuencia RMN) tienen diferentes relaciones de acoplamiento a giros externos. Tiradas que son químicamente equivalentes, pero no son indistinguibles (basado en sus relaciones de acoplamiento) se llaman magnéticamente no equivalentes. Por ejemplo, los 4 sitios de división H 1,2-diclorobenceno en dos pares químicamente equivalentes por simetría, pero un miembro individual de uno de los pares tiene diferentes acoplamientos a los giros que componen el otro par. Falta de equivalencia magnética puede conducir a espectros altamente complejo que sólo puede ser analizado por el modelado computacional. Estos efectos son más comunes en los espectros de RMN de los sistemas no flexibles aromáticos y otros, mientras que un promedio conformacional sobre enlaces CC en moléculas flexibles tiende a igualar los acoplamientos entre los protones en los carbonos adyacentes, reduciendo problemas con falta de equivalencia magnética.
Espectroscopía de correlación
Espectroscopia de correlación es uno de varios tipos de dos dimensiones de resonancia magnética nuclear (RMN) o 2D-NMR. Este tipo de experimento de RMN es mejor conocido por su siglas, ACOGEDOR. Otros tipos de dos dimensiones RMN incluyen J-espectroscopia, la espectroscopia de cambio (EXSY), Overhauser Nuclear efecto de espectroscopia (NOESY), espectroscopia de correlación total (TOCSY) y experimentos de correlación heteronucleares, como HSQC, HMQC, y HMBC. Los espectros de RMN de dos dimensiones proporcionan más información acerca de una molécula de espectros de RMN unidimensional y son especialmente útiles en la determinación de la estructura de una molécula , en particular para las moléculas que son demasiado complicados para trabajar con el uso de RMN unidimensional. El primer experimento de dos dimensiones, ACOGEDORA, fue propuesto por Jean Jeener, profesor de la Universidad Libre de Bruselas, en 1971. Este experimento se llevó a cabo posteriormente por Walter P. Aue, Enrico Bartholdi y Richard R. Ernst, que publicó su trabajo en 1976.
Resonancia magnética nuclear de estado sólido
Una variedad de circunstancias físicas no permiten moléculas a estudiar en solución, y al mismo tiempo no por otras técnicas espectroscópicas a un nivel atómico, tampoco. En los medios en fase sólida, tales como cristales, polvos microcristalinas, geles, soluciones anisótropas, etc., es, en particular, el acoplamiento dipolar y química anisotropía de desplazamiento que se convierten dominante para el comportamiento de los sistemas de espines nucleares. En espectroscopia de RMN en estado solución convencional, estas interacciones adicionales daría lugar a una ampliación significativa de las líneas espectrales. Una variedad de técnicas permite establecer condiciones de alta resolución, que puede, por lo menos para el 13 C espectros, ser comparables a los espectros de RMN en estado de solución.
Dos conceptos importantes para alta resolución espectroscopía de RMN de estado sólido son la limitación de la posible orientación molecular por la orientación de la muestra, y la reducción de las interacciones magnéticas nucleares anisotrópicas por la muestra de hilatura. De este último enfoque, que hace girar rápidamente alrededor de la ángulo mágico es un método muy prominente, cuando el sistema comprende girar media núcleos. Un número de técnicas intermedios, con muestras de alineación parcial o movilidad reducida, se está utilizando actualmente en la espectroscopia de RMN.
Aplicaciones en las que se producen efectos de RMN de estado sólido suelen estar relacionados con estructurar investigaciones sobre proteínas de membrana, fibrillas de proteína o todo tipo de polímeros, y el análisis químico en la química inorgánica, sino que también incluyen aplicaciones "exóticas" como las hojas de las plantas y pilas de combustible.
Espectroscopía de RMN biomolecular
Proteínas
Gran parte de la innovación en la espectroscopia de RMN ha sido en el campo de la proteína Espectroscopía de RMN, una técnica importante en biología estructural. Un objetivo común de estas investigaciones es obtener alta resolución de las estructuras en 3 dimensiones de la proteína, similar a lo que puede lograrse por Cristalografía de rayos X. En contraste con la cristalografía de rayos X, espectroscopía de RMN se limita generalmente a las proteínas más pequeñas que 35 kDa, aunque las estructuras más grandes han sido resueltos. Espectroscopía de RMN es a menudo la única manera de obtener información de alta resolución sobre parcial o totalmente proteínas intrínsecamente no estructurados. Ahora es una herramienta común para la determinación de Relaciones Conformación actividad donde la estructura antes y después de la interacción con, por ejemplo, un candidato a fármaco se compara con su actividad bioquímica conocida. Las proteínas son órdenes de magnitud más grandes que las moléculas orgánicas pequeñas discutidos anteriormente en este artículo, pero las técnicas básicas de RMN y algunos de la teoría de RMN también se aplica. Debido a la mucho mayor número de átomos presentes en una molécula de proteína en comparación con un pequeño compuesto orgánico, los espectros 1D básicos se convierten lleno con la superposición de señales a un punto donde el análisis de espectros directa se convierte en insostenible. Por lo tanto, los experimentos multidimensionales (2, 3 o 4D) se han ideado para hacer frente a este problema. Para facilitar estos experimentos, es deseable isotópicamente etiquetar la proteína con 13 C y 15 N predominante porque el isótopo natural 12 C RMN no es activo, mientras que el momento cuadrupolar nuclear de la que ocurre naturalmente predominante 14 N isótopo evita que la información de alta resolución para ser obtenido a partir de este isótopo de nitrógeno. El método más importante utilizado para la determinación de la estructura de proteínas utiliza Experimentos NOE para medir distancias entre pares de átomos dentro de la molécula. Posteriormente, las distancias obtenidas se utilizan para generar una estructura 3D de la molécula mediante la resolución de una problema de geometría de distancia.
Ácidos nucleicos
"Ácido nucleico RMN" es el uso de espectroscopía de RMN para obtener información sobre la estructura y la dinámica de poli ácidos nucleicos, tales como ADN o RNA. A partir de 2003, casi la mitad de todas las estructuras de ARN conocidos se había determinado por espectroscopia de RMN.
El ácido nucleico y la espectroscopía de RMN de proteínas son similares, pero existen diferencias. Los ácidos nucleicos que tienen un porcentaje menor de átomos de hidrógeno, que son los átomos generalmente observados en la espectroscopia de RMN, y porque ácido nucleico dobles hélices son rígidas y más o menos lineal, que no se pliegan sobre sí mismas para dar correlaciones "de largo alcance". Los tipos de RMN hace generalmente con los ácidos nucleicos son 1 H o RMN de protón, 13 C RMN, 15 N NMR, y 31 P NMR. Dos dimensiones métodos de RMN se utilizan casi siempre, como la espectroscopia de correlación (ACOGEDOR) y espectroscopia de transferencia total coherencia (TOCSY) para detectar acoplamientos nucleares a través de bonos, y efecto Overhauser nuclear espectroscopia (NOESY) para detectar acoplamientos entre núcleos que están cerca uno del otro en el espacio.
Los parámetros obtenidos del espectro, principalmente NOESY cruzadas y picos constantes de acoplamiento, se pueden utilizar para determinar las características estructurales locales, tales como ángulos de enlace glucosídico, ángulos diedros (utilizando el Ecuación Karplus), y fruncido azúcar conformaciones. Para la estructura a gran escala, estos parámetros locales deben ser complementados con otros supuestos estructurales o modelos, ya que los errores se suman como la doble hélice es atravesada, y al contrario que con las proteínas, la doble hélice no tiene un interior compacto y no se pliega hacia atrás sobre sí mismo. RMN también es útil para la investigación de geometrías no estándar tales como hélices dobladas, Watson y Crick no basepairing, y de apilamiento coaxial. Ha sido especialmente útil en el sondeo de la estructura de oligonucleótidos de ARN naturales, que tienden a adoptar conformaciones complejas, tales como tallo de bucles y pseudoknots. RMN también es útil para sondear la unión de moléculas de ácido nucleico a otras moléculas, tales como proteínas o drogas, al ver que las resonancias se desplazan tras la unión de la otra molécula.
Los hidratos de carbono
Espectroscopía de RMN de carbohidratos aborda cuestiones sobre la estructura y conformación de los hidratos de carbono .

