
Hidrógeno
Acerca de este escuelas selección Wikipedia
Esta selección Escuelas fue originalmente elegido por SOS para las escuelas en el mundo en desarrollo que no tienen acceso a Internet. Está disponible como una descarga intranet. Haga clic aquí para obtener información sobre el apadrinamiento de niños.
| Hidrógeno | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
1 H | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||
gas incoloro  Púrpura resplandor en su estado de plasma Las líneas espectrales de hidrógeno | |||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||
| Nombre, símbolo, número | hidrógeno, H, 1 | ||||||||||||||||||||||||
| Pronunciación | / h aɪ d r ə dʒ ə n / HY--drə jən | ||||||||||||||||||||||||
| Categoría Elemento | no metal | ||||||||||||||||||||||||
| Grupo, período, bloque | 1 , 1, s | ||||||||||||||||||||||||
| Peso atómico estándar | 1,008 (1) | ||||||||||||||||||||||||
| Configuración electrónica | 1s 1 1 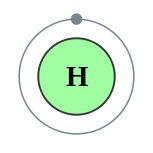 | ||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||
| Descubrimiento | Henry Cavendish (1766) | ||||||||||||||||||||||||
| Nombrado por | Antoine Lavoisier (1783) | ||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||
| Color | incoloro | ||||||||||||||||||||||||
| Fase | gas | ||||||||||||||||||||||||
| Densidad | (0 ° C, 101,325 kPa) 0,08988 g / L | ||||||||||||||||||||||||
| Líquido densidad en mp | 0,07 (0,0763 sólido) g · cm -3 | ||||||||||||||||||||||||
| Líquido densidad en pb | 0,07099 g · cm -3 | ||||||||||||||||||||||||
| Punto de fusion | 14.01 K , -259.14 ° C, -434.45 ° F | ||||||||||||||||||||||||
| Punto de ebullicion | 20.28 K, -252.87 ° C, -423.17 ° F | ||||||||||||||||||||||||
| Punto Triple | 13,8033 K (-259 ° C), 7,042 kPa | ||||||||||||||||||||||||
| Punto crítico | 32,97 K, 1.293 MPa | ||||||||||||||||||||||||
| Calor de fusión | (H 2) 0.117 kJ · mol -1 | ||||||||||||||||||||||||
| El calor de vaporización | (H 2) 0.904 kJ · mol -1 | ||||||||||||||||||||||||
| Capacidad calorífica molar | (H 2) 28.836 J · mol -1 · K -1 | ||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||
| Estados de oxidación | 1, -1 (Óxido anfótero) | ||||||||||||||||||||||||
| Electronegatividad | 2,20 (escala de Pauling) | ||||||||||||||||||||||||
| Energías de ionización | Primero: 1312,0 kJ · mol -1 | ||||||||||||||||||||||||
| Radio covalente | 31 ± 17:00 | ||||||||||||||||||||||||
| Van der Waals radio | 120 pm | ||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||
| Estructura cristalina | hexagonal  | ||||||||||||||||||||||||
| Ordenamiento magnético | diamagnético | ||||||||||||||||||||||||
| Conductividad térmica | 0,1805 W · m -1 · K -1 | ||||||||||||||||||||||||
| Velocidad del sonido | (Gas, 27 ° C) 1310 m · s -1 | ||||||||||||||||||||||||
| Número de registro del CAS | 1333-74-0 | ||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||
| Artículo principal: Los isótopos de hidrógeno | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
El hidrógeno es un elemento químico con símbolo H y número atómico 1. Con un peso atómico de 1.007 9 4 u (1.007 8 25 u por hidrógeno-1 ), el hidrógeno es el elemento más ligero y su forma monoatómico (H 1) es el más sustancia química abundante, constituyendo aproximadamente el 75% del universo de masa bariónica. No- remanentes estrellas se componen principalmente de hidrógeno en su plasma estado.
En temperatura y presión estándar, el hidrógeno es una incoloro, inodoro, insípido, no tóxico, no metálico, altamente combustible diatómico gas con la fórmula molecular H 2. De origen natural hidrógeno atómico es raro en la Tierra porque el hidrógeno forma fácilmente compuestos covalentes con la mayoría de los elementos no metálicos y está presente en la molécula de agua y en la mayoría de los compuestos orgánicos . El hidrógeno juega un papel particularmente importante en la química ácido-base con muchas reacciones de intercambio de protones entre moléculas solubles.
En compuestos iónicos, puede tomar una carga negativa (un anión conocido como hidruro y escrito como H -), o como una carga positiva H + especies. Este último catión se escribe como aunque compuesto de un protón desnudo, pero en realidad, cationes de hidrógeno en compuestos iónicos siempre ocurren como especies más complejas.
El más común de isótopos de hidrógeno es protium (nombre rara vez se utiliza, símbolo 1 H) con un único protón y ningún neutrones . Como es conocido el átomo más simple, el átomo de hidrógeno ha sido de uso teórico. Por ejemplo, como el único átomo neutro con una solución analítica a la Ecuación de Schrödinger, el estudio de la energética y la unión del átomo de hidrógeno juega un papel clave en el desarrollo de la mecánica cuántica .
El gas hidrógeno primero fue producido artificialmente a principios del siglo 16, a través de la mezcla de metales con ácidos fuertes. En 1766-1781, Henry Cavendish fue el primero en reconocer que el gas hidrógeno era una sustancia discreta, y que produce agua cuando se quema, una propiedad que más tarde le dio su nombre: en griego, significa hidrógeno "de agua antigua".
La producción industrial es principalmente del reformado con vapor de gas natural, y menos a menudo de más alto consumo energético los métodos de producción de hidrógeno como el electrólisis del agua. La mayor parte de hidrógeno se emplea cerca de su lugar de producción, con los dos usos más grande es el combustible fósil de procesamiento (por ejemplo, hidrocraqueo) y amoniaco producción, principalmente para el mercado de fertilizantes.
El hidrógeno es una preocupación en la metalurgia , ya que puede fragilizar muchos metales, lo que complica el diseño de tuberías y tanques de almacenamiento.
Propiedades
Combustión

El gas hidrógeno (dihidrógeno o hidrógeno molecular) es altamente inflamable y se quema en el aire a una gama muy amplia de concentraciones de entre 4% y 75% en volumen. La entalpía de combustión de hidrógeno es -286 kJ / mol:
- 2 H 2 (g) + O 2 (g) → 2 H 2 O (l) + 572 kJ (286 kJ / mol)
El hidrógeno gas forma mezclas explosivas con el aire si es 4-74% concentrado y con cloro si es 5-95% concentrado. Las mezclas estallan espontáneamente por chispa, calor o la luz solar. El hidrógeno temperatura de autoignición, la temperatura de ignición espontánea en el aire, es de 500 ° C (932 ° F). Llamas puras de hidrógeno-oxígeno emiten luz ultravioleta y la luz son casi invisibles a simple vista, como se ilustra por el penacho débil de la Transbordador espacial Motor principal en comparación con el penacho muy visible de un El transbordador espacial cohete sólido. La detección de una fuga de hidrógeno quema puede requerir una detector de llama; tales filtraciones pueden ser muy peligrosos. La destrucción de la aeronave Hindenburg fue un ejemplo infame de combustión de hidrógeno; la causa es objeto de debate, pero las llamas visibles fueron el resultado de una rica mezcla de hidrógeno con el oxígeno que produce una llama visible.
H 2 reacciona con cada elemento oxidante. El hidrógeno puede reaccionar de forma espontánea y violentamente a temperatura ambiente con cloro y flúor para formar los correspondientes haluros de hidrógeno, cloruro de hidrógeno y fluoruro de hidrógeno, que también son potencialmente peligrosos ácidos .
Los niveles de energía de electrones
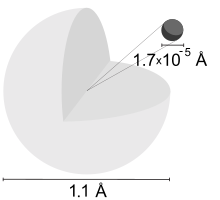
La estado fundamental nivel de energía del electrón en un átomo de hidrógeno es -13,6 eV, que es equivalente a una radiación ultravioleta de fotones de más o menos 92 longitud de onda nm.
Los niveles de energía de hidrógeno se pueden calcular con bastante precisión por medio de la Modelo atómico de Bohr, que conceptualiza el electrón como "órbita" del protón en analogía a la órbita del Sol de la Tierra Sin embargo, la fuerza electromagnética atrae electrones y protones entre sí, mientras que los planetas y objetos celestes se atraen entre sí por la gravedad . Debido a la discretización de momento angular postulado a principios de la mecánica cuántica de Bohr, el electrón en el modelo de Bohr sólo puede ocupar ciertas distancias permitido desde el protón, y por lo tanto sólo ciertas energías permitidas.
Una descripción más precisa del átomo de hidrógeno proviene de un tratamiento mecánico puramente cuántica que utiliza el Ecuación de Schrödinger o la Feynman Integral de caminos para calcular el densidad de probabilidad del electrón alrededor del protón. Los tratamientos más complicados permiten a los pequeños efectos de la relatividad especial y polarización del vacío. En el tratamiento de la mecánica cuántica, el electrón en un átomo de hidrógeno estado fundamental no tiene momento angular en absoluto- una ilustración de cuán diferente es la concepción "órbita planetaria" del movimiento de los electrones difiere de la realidad.
Formas moleculares elementales

Existen dos diferentes isómeros de rotación de las moléculas diatómicas de hidrógeno que se diferencian por la relación giro de sus núcleos. En el forma orthohydrogen, los espines de los dos protones son paralelas y forman un estado triplete con un número cuántico de espín molecular de 1 (½ + ½); en el forman parahidrógeno los giros son antiparalelas y forman una camiseta con un número cuántico de espín molecular de 0 (½-½). A temperatura y presión estándar, gas de hidrógeno contiene aproximadamente 25% de la forma para y 75% de la forma orto, también conocido como la "forma normal". La relación de equilibrio de orthohydrogen a parahidrógeno depende de la temperatura, pero debido a la forma orto es una estado excitado y tiene una energía más alta que la forma de párrafo, es inestable y no se puede purificar. A temperaturas muy bajas, el estado de equilibrio se compone casi exclusivamente de la forma párr. Las propiedades térmicas de líquidos y de fase gaseosa de parahidrógeno puro difieren significativamente de los de la forma normal debido a las diferencias en las capacidades caloríficas de rotación, como se discute con más detalle en Spin isómeros de hidrógeno. El / para distinción orto también se produce en otras moléculas que contienen hidrógeno o grupos funcionales, tales como el agua y metileno, pero es de poca importancia por sus propiedades térmicas.
La interconversión no catalizada entre para y orto H 2 aumenta con el aumento de la temperatura; H así condensado rápidamente 2 contiene grandes cantidades de la forma orto de alta energía que se convierte en la forma párr muy lentamente. La relación orto / para condensada en H 2 es una consideración importante en la preparación y el almacenamiento de hidrógeno líquido: la conversión del orto al párrafo es exotérmica y produce suficiente calor para evaporar parte del líquido de hidrógeno, lo que lleva a la pérdida de material licuado. Catalizadores para la interconversión orto-para, tales como óxido férrico, carbono, amianto platinado, metales de tierras raras, compuestos de uranio activados, óxido de cromo, o algunos compuestos de níquel, se utilizan durante el enfriamiento de hidrógeno.
Fases
- Hidrógeno comprimido
- El hidrógeno líquido
- Hidrógeno Slush
- Hidrógeno sólido
- Hidrógeno metálico
Compuestos
Covalente y compuestos orgánicos
Mientras H 2 no es muy reactivo en condiciones estándar, lo hace forman compuestos con la mayoría de los elementos. El hidrógeno puede formar compuestos con elementos que son más electronegativo, tales como halógenos (por ejemplo, F, Cl, Br, I), o de oxígeno ; en estos compuestos de hidrógeno adquiere una carga positiva parcial. Cuando unido a flúor , oxígeno , o nitrógeno , el hidrógeno puede participar en una forma de medio de resistencia de unión no covalente llamado el enlace de hidrógeno, que es crítica para la estabilidad de muchas moléculas biológicas. El hidrógeno también forma compuestos con elementos electronegativos menos, tales como los metales y metaloides, en la que se adquiere una carga negativa parcial. Estos compuestos son a menudo conocido como hidruros.
El hidrógeno forma una amplia gama de compuestos con carbono llamado hidrocarburos, y una gama aún más vasto con heteroátomos que, debido a su asociación con los seres vivos en general, están llamados compuestos orgánicos . El estudio de sus propiedades se conoce como química orgánica y su estudio en el contexto de que viven los organismos se conoce como la bioquímica . Según algunas definiciones, compuestos "orgánicos" sólo son necesarios para contener carbono. Sin embargo, la mayoría de ellos también contienen hidrógeno, y porque es el enlace carbono-hidrógeno que da a esta clase de compuestos la mayoría de sus características químicas particulares, se requieren enlaces carbono-hidrógeno en algunas definiciones de la palabra "orgánico" en química. Millones de hidrocarburos son conocidos, y están formados generalmente por rutas sintéticas complicadas, que rara vez implican hidrógeno elemental.
Hidruros
Los compuestos de hidrógeno se llaman a menudo hidruros, un término que se utiliza bastante flojo. El término "hidruro" sugiere que el átomo de H ha adquirido un carácter negativo o aniónico, denotado H -, y se utiliza cuando el hidrógeno forma un compuesto con una mayor elemento electropositivo. La existencia del anión hidruro, sugerida por Gilbert N. Lewis en 1916 para el grupo I y II hidruros salinos, fue demostrada por Moers en 1920 por la electrólisis del fundido hidruro de litio (LIH), produciendo una estequiometría de la cantidad de hidrógeno en el ánodo. Para hidruros distintos grupos I y II metales, el término es bastante engañosa, considerando la baja electronegatividad del hidrógeno. Una excepción en el grupo hidruros II es BeH 2, que es polimérico. En hidruro de litio y aluminio , el AlH -
4 anión lleva centros hydridic firmemente unidos al Al (III).
Aunque los hidruros pueden formarse con casi todos los elementos de los grupos principales, el número y la combinación de posibles compuestos varía mucho; por ejemplo, hay más de 100 hidruros borano binarios conocidos, pero sólo un hidruro de aluminio y binario. Binary indio hidruro aún no ha sido identificado, aunque existen complejos más grandes.
En la química inorgánica , hidruros también pueden servir como ligandos puente que unen dos centros metálicos en un complejo de coordinación. Esta función es particularmente común en grupo de 13 elementos, especialmente en boranos ( boro hidruros) y de aluminio complejos, así como en clúster carboranos.
Los protones y los ácidos
La oxidación de hidrógeno elimina su electrón y da H +, que no contiene electrones y un núcleo que generalmente se compone de un protón. Es por eso que H + es a menudo llamado un protón. Esta especie es fundamental para la discusión de los ácidos . Bajo la Bronsted-Lowry teoría, ácidos son donantes de protones, mientras que las bases son aceptores de protones.
Un protón desnudo, H +, no puede existir en solución o en cristales iónicos, a causa de su atracción imparable a otros átomos o moléculas con electrones. Excepto a las altas temperaturas asociadas con plasmas, tales protones no pueden ser retirados de la nubes de electrones de los átomos y las moléculas, y permanecerán unidos a ellos. Sin embargo, el término "protón" se usa en ocasiones como metafóricamente para referirse a carga positiva o catiónico hidrógeno unido a otras especies de esta manera, y como tal se denota "H +" sin que ello suponga que existen protones individuales libremente como especie .
Para evitar la implicación de los desnudos "protón solvatado" en solución, las soluciones acuosas ácidas a veces se considera que contienen una especie ficticios menos improbables, denominan el " ion hidronio "(H 3 O +). Sin embargo, incluso en este caso, se considera que tales cationes hidrógeno solvatados más realista físicamente a organizarse en grupos que forman las especies más cerca de 9 H O +
4. Otros iones de oxonio se encuentran cuando el agua está en solución con otros disolventes.
Aunque exótico en la Tierra, uno de los iones más comunes en el universo es el H +
3 de iones, conocido como hidrógeno molecular protonado o el catión trihidrógeno.
Isótopos


El hidrógeno tiene tres isótopos naturales, denota 1 H, 2 H y 3 H. Otros núcleos, altamente inestables (4 H a 7 H) han sido sintetizados en el laboratorio pero no observado en la naturaleza.
- 1 H es el isótopo más común de hidrógeno con una abundancia de más de 99,98%. Debido a que el núcleo de este isótopo se compone de un solo protón, se le da el descriptivo pero rara vez usado el nombre protium formal.
- 2 H, el otro isótopo del hidrógeno estable, es conocido como deuterio y contiene un protón y un neutrón en su núcleo. Esencialmente todos deuterio en el universo se cree que se han producido en el momento del Big Bang , y ha perdurado desde entonces. El deuterio no es radiactivo, y no representa un peligro de toxicidad significativa. Agua enriquecida en moléculas que incluyen deuterio en lugar de hidrógeno normal se llama agua pesada. Deuterio y sus compuestos se utilizan como una etiqueta no radiactivo en experimentos químicos y en disolventes para 1 H - espectroscopía de RMN . El agua pesada se utiliza como una moderador de neutrones y refrigerante para reactores nucleares. El deuterio es también un combustible potencial para comercial fusión nuclear.
- 3 H se conoce como tritio y contiene un protón y dos neutrones en su núcleo. Es radiactivos, decayendo en helio-3 a través desintegración beta con una vida media de 12,32 años. Es tan radiactivo que puede ser utilizado en pintura luminosa, por lo que es útil en cosas tales como relojes. El vidrio evita que la pequeña cantidad de radiación de salir. Pequeñas cantidades de tritio producen de forma natural debido a la interacción de los rayos cósmicos con los gases atmosféricos; tritio también se ha lanzado durante pruebas de armas nucleares. Se utiliza en reacciones de fusión nuclear, como un trazador en geoquímica de isótopos, y especializada en dispositivos de iluminación con alimentación propia. El tritio también se ha utilizado en experimentos químicos y biológicos de etiquetado como radioetiqueta.
El hidrógeno es el único elemento que tiene diferentes nombres para sus isótopos de uso común hoy en día. Durante el estudio temprano de la radiactividad, varios isótopos radiactivos pesados les dio su propio nombre, pero esos nombres ya no se utilizan, a excepción de deuterio y tritio. Los símbolos D y T (en lugar de 2 H y 3 H) se utilizan a veces para el deuterio y el tritio, pero el símbolo correspondiente para protium, P, ya está en uso para el fósforo y por lo tanto no está disponible para protium. En sus nomenclatura directrices, el Unión Internacional de Química Pura y Aplicada permite que cualquiera de D, T, H 2, H 3 y para ser utilizado, aunque se prefieren 2 y H 3 H.
Historia
Descubrimiento y uso
En 1671, Robert Boyle descubrió y describió la reacción entre el hierro limaduras y diluir ácidos , lo que resulta en la producción de gas hidrógeno. En 1766, Henry Cavendish fue el primero en reconocer gas de hidrógeno como una sustancia discreta, nombrando el gas a partir de una reacción de metal-ácido "aire inflamable". Se especula que el "aire inflamable" era de hecho idéntica a la sustancia hipotética llamada " flogisto "y también la constatación en 1781 que el gas produce agua cuando se quema. Por lo general se le da crédito por su descubrimiento como un elemento. En 1783, Antoine Lavoisier dio al elemento el nombre de hidrógeno (del griego que significa hidro ὕδρω genes de agua y γενῆς intencionados creador) cuando él y Laplace reproducida hallazgo de Cavendish que el agua se produce cuando se quema el hidrógeno.

Lavoisier produce hidrógeno por sus famosos experimentos sobre la conservación de la masa mediante la reacción de un flujo de vapor metálico con hierro a través de un tubo de hierro incandescente calentado en un incendio. La oxidación anaerobia de hierro por los protones de agua a alta temperatura se puede representar esquemáticamente por el conjunto de las siguientes reacciones:
- Fe + H2O → FeO + H 2
- 2 Fe + 3 H 2 O → Fe 2 O 3 + 3 H 2
- 3 Fe + 4 H 2 O → Fe 3 O 4 + 4 H 2
Muchos metales tales como zirconio se someten a una reacción similar con agua que conduce a la producción de hidrógeno.
El hidrógeno se licuado por primera vez por James Dewar en 1898 mediante el uso de refrigeración regenerativa y su invento, el frasco de vacío. Produjo hidrógeno sólido el próximo año. El deuterio se descubrió en diciembre de 1931 por Harold Urey, y tritio fue preparado en 1934 por Ernest Rutherford , Marcos Oliphant, y Paul Harteck. El agua pesada, que consta de deuterio en lugar de hidrógeno regular, fue descubierto por el grupo de Urey en 1932. François Isaac de Rivaz construyó el primer motor de combustión interna alimentado por una mezcla de hidrógeno y oxígeno en 1806. Edward Daniel Clarke inventó el soplete de gas de hidrógeno en 1819. El Lámpara de Döbereiner y centro de atención fueron inventados en 1823.
La primera lleno de hidrógeno globo fue inventado por Jacques Charles en 1783. El hidrógeno proporciona la elevación de la primera forma fiable de los viajes aéreos después de la invención 1852 del primer dirigible hidrógeno levantado por Henri Giffard. Conde alemán Ferdinand von Zeppelin promovió la idea de dirigibles rígidos levantadas por el hidrógeno que luego se llamó Zepelines; la primera de las cuales tenía su primer vuelo en 1900. vuelos programados regularmente se inició en 1910 y por el estallido de la Primera Guerra Mundial en agosto de 1914, que había llevado a 35.000 pasajeros sin un incidente grave. Dirigibles hidrógeno levantado fueron utilizados como plataformas de observación y bombarderos durante la guerra.
El primer cruce transatlántico sin escalas fue hecho por el dirigible británico R34 en 1919. El servicio regular de pasajeros se reanudó en la década de 1920 y el descubrimiento de helio reservas en Estados Unidos prometió una mayor seguridad, pero el gobierno de Estados Unidos se negó a vender el gas para este propósito. Por lo tanto, H 2 fue utilizado en el Dirigible Hindenburg, que fue destruida en un incendio en pleno vuelo sobre Nueva Jersey, el 6 de mayo de 1937. El incidente fue transmitido en vivo por la radio y la filmó. La ignición de fugas de hidrógeno está ampliamente asumido que la causa, pero las investigaciones posteriores se refirió a la ignición de la aluminizado revestimiento de tela por electricidad estática. Pero el daño a la reputación de hidrógeno como gas ascensional, ya estaba hecho.
En el mismo año la primera turbogenerador hidrógeno refrigerado entró en servicio con hidrógeno gaseoso como refrigerante en el rotor y el estator en 1937 en Dayton, Ohio, por la Dayton Power & Light Co, debido a la conductividad térmica del gas de hidrógeno este es el tipo más común en su campo hoy en día.
La pila de hidrógeno de níquel se utilizó por primera vez en 1977 a bordo de la tecnología de navegación de la Marina estadounidense satélite-2 (NTS-2). Por ejemplo, el ISS , Mars Odyssey y la Mars Global Surveyor están equipados con baterías de níquel-hidrógeno. En la parte oscura de su órbita, el telescopio espacial Hubble también es alimentado por baterías de níquel-hidrógeno, que finalmente fueron sustituidos en mayo de 2009 más de 19 años después de su lanzamiento, y 13 años más de su vida de diseño.
Papel en la teoría cuántica

Debido a su estructura atómica relativamente simple, que consiste sólo de un protón y un electrón, la átomo de hidrógeno, junto con el espectro de la luz producida a partir de ella o absorbida por ella, ha sido central en el desarrollo de la teoría de la atómica estructura. Además, la simplicidad correspondiente de la molécula de hidrógeno y el catión correspondiente H 2 + permitió comprensión más completa de la naturaleza del enlace químico , que se produjo poco después de que el tratamiento mecánico cuántico del átomo de hidrógeno se había desarrollado a mediados de la década de 1920.
Uno de los primeros efectos cuánticos a hacerse notar explícitamente (pero no entendieron en ese momento) era una observación Maxwell implica hidrógeno, medio siglo antes de la plena teoría mecánica cuántica llegó. Maxwell observó que el capacidad de calor específico de H 2 se aparta inexplicablemente de la de una gas diatómico debajo de la temperatura ambiente y se empieza a parecerse cada vez más que de un gas monoatómico a temperaturas criogénicas. Según la teoría cuántica, este comportamiento surge de la separación de los (cuantificados) los niveles de energía de rotación, que son particularmente amplia espaciados en H 2 debido a su baja masa. Estos niveles ampliamente espaciados inhiben igual partición de la energía térmica en movimiento de rotación en hidrógeno a bajas temperaturas. Los gases diatómicas compuestas de átomos más pesados no tienen tales niveles muy separados y no presentan el mismo efecto.
Presencia natural

El hidrógeno, como H atómico, es el más abundante elemento químico en el universo, lo que representa el 75% de la materia normal por masa y más del 90% en número de átomos (la mayoría de la masa del universo, sin embargo, no es en la forma de tipo químico-elemento de la materia, sino más bien se postula que se produzca como formas no detectados todavía-de masa tales como la materia oscura y la energía oscura). Este elemento se encuentra en gran abundancia en las estrellas y los gigantes gaseosos planetas. Las nubes moleculares de H 2 se asocian con la formación de estrellas. El hidrógeno juega un papel vital en la alimentación de estrellas a través de reacción protón-protón y Ciclo CNO fusión nuclear.
En todo el universo, el hidrógeno se encuentra principalmente en las atómicas y plasma estados cuyas propiedades son muy diferentes de hidrógeno molecular. Como plasma, electrones y protones de hidrógeno no están unidos entre sí, dando lugar a muy alta conductividad eléctrica y alta emisividad (que produce la luz del Sol y otras estrellas). Las partículas cargadas son altamente influenciados por los campos magnéticos y eléctricos. Por ejemplo, en el viento solar interactúan con la de la Tierra magnetosfera dando lugar a Corrientes y la Birkeland aurora. El hidrógeno se encuentra en el estado atómico neutral en el medio interestelar. La gran cantidad de hidrógeno neutro se encuentra en los sistemas Lyman-alfa amortiguadas se piensa que dominar la densidad bariónica cosmológica del Universo hasta desplazamiento al rojo z = 4.
En condiciones normales de la Tierra, existe hidrógeno elemental como gas diatómico, H 2 (para datos ver tabla). Sin embargo, el gas de hidrógeno es muy raro en la atmósfera de la Tierra (1 ppm en volumen) debido a su peso ligero, lo que le permite escapar de la gravedad de la Tierra con más facilidad que los gases más pesados. Sin embargo, el hidrógeno es el tercer elemento más abundante en la superficie de la Tierra, principalmente en la forma de compuestos químicos tales como hidrocarburos y agua. El gas hidrógeno es producido por algunas bacterias y algas y es un componente natural de flatos, como es el metano , en sí misma una fuente de hidrógeno de importancia creciente.
Una forma molecular llamada hidrógeno molecular protonado (H + 3) se encuentra en el medio interestelar, donde se genera por la ionización de hidrógeno molecular a partir de los rayos cósmicos. Este ion cargado también se ha observado en la atmósfera superior del planeta Júpiter . El ion es relativamente estable en el entorno del espacio exterior debido a la baja temperatura y densidad. H 3 + es uno de los iones más abundantes en el Universo, y desempeña un papel notable en la química del medio interestelar. Neutral triatómica hidrógeno H 3 sólo puede existir en una forma emocionada y es inestable. Por el contrario, el positivo ión molecular de hidrógeno (H 2 +) es una molécula rara en el universo.
Producción
H 2 se produce en los laboratorios de química y biología, a menudo como un subproducto de otras reacciones; en la industria para la hidrogenación de sustratos insaturados; y en la naturaleza como un medio de expulsión reducción de los equivalentes en las reacciones bioquímicas.
Laboratorio
En el laboratorio, H 2 se prepara normalmente mediante la reacción de diluido ácidos no oxidantes en algunos metales reactivos tales como zinc con Aparato de Kipp.
- Zn + 2 H + → Zn2 + + H 2
De aluminio también puede producir H 2 tras el tratamiento con bases:
- 2 Al + 6 H2O + 2 OH - → 2 Al (OH) -
4 + 3 H 2
La electrólisis del agua es un método simple de producir hidrógeno. Una corriente de bajo voltaje se ejecuta a través del agua, y las formas de oxígeno gaseoso en el ánodo mientras que las formas de hidrógeno gaseosos en el cátodo. Típicamente, el cátodo está hecho de platino u otro metal inerte cuando la producción de hidrógeno para el almacenamiento. Si, sin embargo, el gas es para ser quemados en el lugar, el oxígeno es deseable para ayudar a la combustión, y así ambos electrodos se haría a partir de metales inertes. (Hierro, por ejemplo, sería oxidar, y por lo tanto disminuir la cantidad de oxígeno que se desprende.) La eficiencia máxima teórica (electricidad utilizada vs. valor energético del hidrógeno producido) está en el intervalo 80-94%.
- 2 H2O (l) → 2 H 2 (g) + O2 (g)
En 2007, se descubrió que una aleación de aluminio y galio en forma de gránulos añadió a agua podría ser utilizado para generar hidrógeno. El proceso también crea alúmina , pero el galio caros, lo que impide la formación de una piel de óxido sobre los gránulos, se puede volver a utilizar. Esto tiene importantes implicaciones potenciales para la economía del hidrógeno, como el hidrógeno puede ser producido en el lugar y no tiene que ser transportado.
Industrial
El hidrógeno se puede preparar de varias maneras diferentes, pero económicamente los procesos más importantes implican la eliminación de hidrógeno a partir de hidrocarburos. Hidrógeno a granel comercial usualmente es producida por la reformado con vapor de gas natural . A altas temperaturas (1000-1400 K, 700-1100 ° C o 1300-2000 ° F), el vapor (vapor de agua) reacciona con metano para producir monóxido de carbono y H 2.
- CH 4 + H2O → CO + 3 H 2
Esta reacción es favorecida a bajas presiones, pero, no obstante, se lleva a cabo a altas presiones (2,0 MPa, 20 atm o 600 inHg). Esto se debe a alta presión H 2 es el producto más comercializable y Sistemas de purificación de adsorción por cambio de presión (PSA) funcionan mejor a presiones más altas. La mezcla de productos se conoce como " gas de síntesis ", ya que a menudo se utiliza directamente para la producción de metanol y compuestos relacionados. Hidrocarburos distintos del metano se pueden utilizar para producir gas de síntesis con relaciones variables de productos. Una de las muchas complicaciones a esta tecnología altamente optimizado es la formación de coque o de carbono:
- CH 4 → C + 2 H 2
En consecuencia, el reformado con vapor típicamente emplea un exceso de H 2 O. Hidrógeno adicional se puede recuperar a partir del vapor mediante el uso de monóxido de carbono a través de la reacción de desplazamiento del gas de agua, especialmente con una catalizador de óxido de hierro. Esta reacción es también una fuente industrial común de dióxido de carbono :
- CO + H2O → CO 2 + H 2
Otros métodos importantes para la producción de H 2 incluyen la oxidación parcial de hidrocarburos:
- 2 CH 4 + O 2 → 2 CO + 4 H 2
y la reacción del carbón, que puede servir como preludio a la reacción de desplazamiento arriba:
- C H 2 O + → CO + H2
El hidrógeno es a veces produce y se consume en el mismo proceso industrial, sin separarse. En el Haber proceso para la producción de amoníaco, el hidrógeno se genera a partir de gas natural. electrólisis de salmuera para producir cloro también produce hidrógeno como un coproducto.
Termoquímica
Hay más de 200 ciclos termoquímicos que pueden ser utilizados para división de agua, alrededor de una docena de estos ciclos, como el ciclo de óxido de hierro, ciclo (IV) óxido de cerio (III) óxido de cerio, ciclo de zinc-óxido de zinc, ciclo de azufre yodo, cobre-cloro ciclo y ciclo del azufre híbrido están bajo investigación y en la prueba de fase para producir hidrógeno y oxígeno a partir de agua y calor sin el uso de electricidad. Varios laboratorios (incluso en Francia, Alemania, Grecia, Japón y EE.UU.) están desarrollando métodos termoquímicos para producir hidrógeno a partir de energía solar y el agua.
Corrosión anaerobia
En condiciones anaeróbicas, hierro y aleaciones de acero se oxidan lentamente por los protones de agua de forma concomitante reducido en hidrógeno molecular (H 2). La la corrosión anaerobia de hierro conduce primero a la formación de hidróxido ferroso (óxido verde) y se puede describir mediante la siguiente reacción:
- Fe + 2 H 2 O → Fe (OH) 2 + H 2
A su vez, en condiciones anaeróbicas, la hidróxido ferroso (Fe (OH) 2) puede ser oxidado por los protones de agua para formar magnetita y el hidrógeno molecular. Este proceso se describe por el Reacción Schikorr:
- 3 Fe (OH) 3 O 4 + 2 2 → Fe H 2 O + H 2
- hidróxido ferroso → magnetita + agua + hidrógeno
La magnetita bien cristalizado (Fe 3 O 4) es termodinámicamente más estable que el hidróxido ferroso (Fe (OH) 2).
Este proceso ocurre durante la corrosión anaerobia de hierro y acero en libre de oxígeno las aguas subterráneas y en la reducción de los suelos por debajo de la mesa de agua.
Ocurrencia geológica: la reacción serpentinización
En ausencia de oxígeno atmosférico (O 2), en condiciones geológicas profundas que prevalecen lejos de atmósfera de la Tierra, el hidrógeno (H 2) se produce durante el proceso de serpentinización por la oxidación anaerobia de los protones del agua (H +) de la ferroso (Fe2 +) silicato presente en la red cristalina de la fayalita (Fe 2 SiO 4, el olivino hierro endmember). La reacción correspondiente que conduce a la formación de magnetita (Fe 3 O 4), cuarzo (SiO 2) e hidrógeno (H 2) es la siguiente:
- 3 Fe 2 SiO 4 + 2 H 2 O 2 → Fe 3 O 4 + 3 SiO2 + 3 H 2
- fayalita + agua → magnetita + cuarzo + hidrógeno
Esta reacción se asemeja mucho a la Schikorr observó reacción en la oxidación anaerobia de la hidróxido ferroso en contacto con el agua.
Formación en transformadores
De todos los gases formados en el poder de fallo transformadores, el hidrógeno es el más común y se genera bajo la mayoría de condiciones de fallo; por lo tanto, la formación de hidrógeno es una indicación temprana de graves problemas en el ciclo de vida del transformador.
Aplicaciones
El consumo en los procesos
Se necesitan grandes cantidades de H 2 en las industrias del petróleo y químicos. La mayor aplicación de H 2 es para el tratamiento ("mejora") de los combustibles fósiles, y en la producción de amoniaco . Los consumidores principales de H 2 en la planta petroquímica incluyen hidrodesalquilación, hidrodesulfuración, y hidrocraqueo. H 2 tiene varios otros usos importantes. H 2 se utiliza como un agente de hidrogenación, en particular en aumentar el nivel de saturación de grasas insaturadas y aceites (que se encuentra en artículos tales como la margarina), y en la producción de metanol . Igualmente, es la fuente de hidrógeno en la fabricación de ácido clorhídrico . H 2 también se utiliza como una agente del reductor metálico minerales.
El hidrógeno es altamente soluble en muchos tierras raras y metales de transición y es soluble tanto en nanocristalino y metales amorfos. El hidrógeno solubilidad de los metales está influenciada por distorsiones locales o impurezas en el red cristalina.Estas propiedades pueden ser útiles cuando el hidrógeno se purifica por paso a través calientesde paladiodiscos, pero la alta solubilidad del gas es un problema metalúrgico, contribuyendo a lafragilización de muchos metales, lo que complica el diseño de tuberías y tanques de almacenamiento.
Aparte de su uso como un reactivo, H 2 tiene amplias aplicaciones en la física y la ingeniería. Se utiliza como una gas de protección en soldadura métodos tales como la soldadura de hidrógeno atómico. H 2 se utiliza como el refrigerante rotor en generadores eléctricos en estaciones de energía, debido a que tiene la más alta conductividad térmica de cualquier gas. H líquido 2 se utiliza en la investigación criogénico, incluyendo la superconductividad estudios. Debido a que H 2 es más ligero que el aire, que tiene un poco más que 1 / 15 de la densidad del aire, una vez que se usa ampliamente como un gas de elevación en globos y dirigibles .
En las aplicaciones más recientes, el hidrógeno se utiliza puro o mezclado con nitrógeno (a veces llamado gas de formación) como gas indicador para la detección de fugas minutos. Las aplicaciones se pueden encontrar en las industrias automotriz, química, generación de energía, aeroespacial y de telecomunicaciones. El hidrógeno es un aditivo alimentario autorizado (E 949), que permite realizar pruebas de fugas paquete de alimentos, entre otras propiedades anti-oxidantes.
Isótopos raros de hidrógeno también cada uno tiene aplicaciones específicas.El deuterio se utiliza (hidrógeno-2) enaplicaciones de fisión nuclear como unmoderador para ralentizarlos neutrones, y en reacciones de fusión nuclear.compuestos de deuterio tener aplicaciones en la química y la biología en los estudios de reacciónefectos isotópicos.tritio (hidrógeno-3 ), producido enreactores nucleares, se utiliza en la producción debombas de hidrógeno, como una etiqueta isotópica en las ciencias biológicas, y como unafuente de radiación en pinturas luminosas.
La la temperatura del punto triple del hidrógeno equilibrio es un punto fijo que define en laescala de temperatura ITS-90 a 13,8033grados Kelvin.
Refrigerante
El hidrógeno se utiliza comúnmente en las centrales eléctricas como refrigerante en los generadores debido a una serie de propiedades favorables que son un resultado directo de sus moléculas diatómicas de luz. Estos incluyen baja densidad , de baja viscosidad, y la más alta calor específico y conductividad térmica de todos los gases.
Portador de energía
El hidrógeno no es una fuente de energía, excepto en el contexto hipotético de comerciales centrales de energía de fusión nuclear utilizando deuterio o tritio, una tecnología actualmente lejos de desarrollo. La energía del Sol proviene de la fusión nuclear del hidrógeno, pero este proceso es difícil de lograr de forma controlada en la Tierra. Hidrógeno elemental de fuentes solares, biológicas o eléctricas requieren más energía para hacer que se obtiene mediante la quema, por lo que en estos casos las funciones de hidrógeno como portador de energía, como una batería. El hidrógeno se puede obtener a partir de fuentes fósiles (tales como metano), pero estas fuentes son insostenibles.
La densidad de energía por unidad de volumen de ambos hidrógeno líquido y gas de hidrógeno comprimido a cualquier presión practicable es significativamente menor que la de las fuentes de combustible tradicionales, aunque la densidad de energía por unidad de combustible masa es mayor. Sin embargo, el hidrógeno elemental ha sido ampliamente discutido en el contexto de la energía, como un posible futuro portador de energía a escala de toda la economía. Por ejemplo, CO 2 secuestro seguido de la captura y almacenamiento de carbono podría llevarse a cabo en el punto de H 2 de producción a partir de combustibles fósiles. El hidrógeno utilizado en el transporte ardería relativamente limpia, con algunas NO X emisiones, pero sin emisiones de carbono. Sin embargo, los costos de infraestructura asociados con la conversión completa a una economía del hidrógeno serían sustanciales.
Industria de semiconductores
El hidrógeno se emplea para saturar ("") colgando enlaces rotos de silicio amorfo y carbono amorfo que ayuda a la estabilización de las propiedades del material. Es también un potencial donante de electrones en varios materiales, incluyendo óxido de ZnO, SnO $ 2 , CdO, MgO, ZrO $ 2 , HfO $ 2 , La 2 O 3 , Y 2 O 3 , TiO $ 2 , SrTiO 3 , Laalo 3 , SiO 2 , Al 2 O 3 , ZrSiO 4 , HfSiO 4 , y SrZrO 3 .
Reacciones biológicas
H 2 es un producto de algunos tipos de metabolismo anaeróbico y es producido por varios microorganismos, por lo general a través de reacciones catalizadas por hierro - o níquel -Con enzimas llamadas hidrogenasas. Estas enzimas catalizan la reversible reacción redox entre H 2 y su componente de dos protones y dos electrones. Creación de gas hidrógeno se produce en la transferencia de equivalentes reductores producidos durante piruvato fermentación al agua.
División del agua, en la que el agua se descompone en sus protones de componentes, los electrones y oxígeno, se produce en las reacciones ligeras en todos fotosintéticos organismos. Algunos de estos organismos, incluyendo el alga Chlamydomonas reinhardtii y cianobacterias, han evolucionado un segundo paso en las oscuras reacciones en las que los protones y los electrones se reduce para formar H 2 gas por hidrogenasas especializados en el cloroplasto. Se han realizado esfuerzos para modificar genéticamente hidrogenasas cianobacterias para sintetizar eficientemente H 2 gas incluso en presencia de oxígeno. También se han emprendido esfuerzos con modificado genéticamente alga en un biorreactor.
Seguridad y precauciones
El hidrógeno plantea una serie de riesgos para la seguridad de las personas, de los posibles detonaciones y los incendios cuando se mezcla con el aire de ser un asfixiante en su puro oxígeno forma exento. Además, el hidrógeno líquido es un fluido criogénico y presenta peligros (tales como congelación) asociados con líquidos muy fríos. El hidrógeno se disuelve en muchos metales, y, además de escape, puede tener efectos adversos sobre ellos, tales como la fragilización por hidrógeno, dando lugar a grietas y explosiones. Fuga de gas de hidrógeno en el aire externo puede arder espontáneamente. Por otra parte, el fuego de hidrógeno, mientras que ser extremadamente caliente, es casi invisible, y por lo tanto puede conducir a quemaduras accidentales.
Incluso la interpretación de los datos de hidrógeno (incluidos los datos de seguridad) es confundida por una serie de fenómenos. Muchas de las propiedades físicas y químicas de hidrógeno dependen de la relación de parahidrógeno / orthohydrogen (se tarda a menudo días o semanas a una temperatura dada para alcanzar la relación de equilibrio, para el que se da generalmente los datos). Parámetros de detonación hidrógeno, tal como presión de detonación y la temperatura crítica, dependen fuertemente de la geometría del recipiente.

