
Masse moléculaire
Saviez-vous ...
SOS Enfants, un organisme de bienfaisance de l'éducation , a organisé cette sélection. enfants SOS est le plus grand don de charité du monde enfants orphelins et abandonnés la chance de la vie familiale.
La masse moléculaire (en abrégé MM) d'une substance , anciennement appelé également poids moléculaire et abrégé en MW, est la masse d'une molécule de cette substance, par rapport à la unifié unité de masse atomique u (égale à 1/12 de la masse d'un atome de carbone-12). Cela est différent de la masse moléculaire relative d'une molécule, qui est le rapport de la masse de ladite molécule à 1/12 de la masse de carbone 12 et est un nombre sans dimension. Masse moléculaire relative est abrégé à M..
Définition
Il existe diverses interprétations de cette définition. Beaucoup de chimistes utilisent la masse moléculaire comme un synonyme de masse molaire , ne différant que par unités (voir la masse moléculaire moyenne ci-dessous). Une interprétation stricte ne signifie pas les deux, comme la masse d'une molécule unique ne est pas la même que la moyenne d'un ensemble. Une mole de molécules peut contenir une variété de masses moléculaires naturels due à des isotopes , de sorte que la masse moyenne est généralement pas identique à la masse de ne importe quelle molécule unique. La différence numérique réelle peut être très faible lors de l'examen de petites molécules et la masse moléculaire du isotopomère plus courante dans ce cas, l'erreur importe seulement aux physiciens et un petit sous-ensemble de chimistes hautement spécialisés; mais il est toujours plus correcte, précise et cohérente à utiliser masse molaire dans les calculs stoechiométriques vrac. La taille de cette erreur devient beaucoup plus important lorsque l'on considère des molécules plus grandes ou isotopomères moins abondantes. La masse moléculaire d'une molécule qui se trouve contenir des isotopes plus lourds que la molécule moyenne de l'échantillon peuvent différer de la masse molaire par plusieurs des unités de masse.
De masse moléculaire moyenne
La masse moléculaire moyenne (parfois abrégé en tant que masse moyenne) est une autre variante de l'utilisation de la masse moléculaire terme. La masse moléculaire moyenne est pondérée abondance moyenne (moyenne) des masses moléculaires dans un échantillon. Ce est souvent plus proche de ce que l'on entend lorsque «masse moléculaire» et «masse molaire" sont utilisés comme synonymes et peuvent avoir dérivé de raccourcissement de ce terme. La masse moléculaire moyenne et la masse molaire d'une substance particulière dans un échantillon particulier sont en fait numériquement identique et peuvent être convertis entre eux par le nombre d'Avogadro . Il convient de noter, cependant, que la masse molaire est presque toujours un chiffre calculée dérivée de la poids atomiques standard, tandis que la masse moléculaire moyenne, dans les domaines qui ont besoin du terme, est souvent une figure spécifique mesurée à un échantillon. Par conséquent, elles varient souvent depuis une est théorique et l'autre est expérimentale. Échantillons spécifiques peuvent varier sensiblement de la composition isotopique prévu en raison de réels écarts par rapport à la moyenne de la terre abondances isotopiques.
Le calcul de la masse moléculaire
La masse moléculaire peut être calculée comme la somme des masses des isotopes individuels (que l'on trouve dans une table des isotopes) de tous les atomes dans une quelconque molécule . Ceci est possible parce que les molécules sont créés par des réactions chimiques qui, contrairement réactions nucléaires, ont très faible énergies de liaison par rapport à la masse au repos des atomes ( 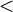 10 -9) et donc créer un défaut de masse négligeable. On notera que l'utilisation de la moyenne masses atomiques dérivées des poids atomiques standards trouvés sur un tableau périodique standard se traduira par une masse moléculaire moyenne, alors que l'utilisation des masses isotopiques se traduira par une masse moléculaire compatible avec l'interprétation stricte de la définition, à savoir que d'une seule molécule. Notez que toute molécule donnée peut contenir ne importe quelle combinaison d'isotopes, donc il peut y avoir des masses moléculaires multiples pour chaque composé chimique.
10 -9) et donc créer un défaut de masse négligeable. On notera que l'utilisation de la moyenne masses atomiques dérivées des poids atomiques standards trouvés sur un tableau périodique standard se traduira par une masse moléculaire moyenne, alors que l'utilisation des masses isotopiques se traduira par une masse moléculaire compatible avec l'interprétation stricte de la définition, à savoir que d'une seule molécule. Notez que toute molécule donnée peut contenir ne importe quelle combinaison d'isotopes, donc il peut y avoir des masses moléculaires multiples pour chaque composé chimique.
Mesure de la masse moléculaire
La masse moléculaire peut également être mesurée directement en utilisant la spectrométrie de masse . Dans la spectrométrie de masse, la masse moléculaire d'une petite molécule est généralement rapportée comme la masse monoisotopique, ce est la masse de la molécule contenant uniquement l'isotope le plus commun de chaque élément. A noter que celle-ci diffère également subtilement de la masse moléculaire en ce que le choix des isotopes est défini et est donc une seule masse moléculaire spécifique des nombreux possible. Les masses utilisées pour calculer la masse moléculaire monoisotopique se trouvent sur une table des masses isotopiques et ne sont pas disponibles sur un tableau périodique typique. La masse moléculaire moyenne est souvent utilisé pour des molécules plus grandes puisque les molécules avec de nombreux atomes sont peu susceptibles d'être composé exclusivement de l'isotope le plus abondant de chaque élément. Une masse moléculaire moyenne théorique peut être calculée en utilisant la poids atomiques standards disponibles sur un tableau périodique classique, car il est susceptible d'être une répartition statistique des atomes représentant les isotopes à travers la molécule. Cela peut cependant différer de la véritable masse moléculaire moyenne de l'échantillon en raison de variations naturelles (ou artificiels) dans les distributions isotopiques.
Exemple: masse moléculaire moyenne par rapport masse moléculaire par rapport masse molaire
La masse molaire d'une substance est la masse de 1 mole (de l'unité de mesure pour la quantité de base de SI quantité de substance, comportant le symbole n) de la substance. Ceci a une valeur numérique qui est la masse moléculaire moyenne des molécules dans la substance multipliée par la constante d'Avogadro environ 6,022 10 * 23. Les unités les plus courants de masse molaire sont g / mol parce que dans ces unités la valeur numérique est égale à la masse moléculaire moyenne en unités de u.
Facteur de la masse moléculaire moyenne de conversion de masse molaire:
- masse molaire = masse moléculaire moyenne * (6,022 * 10 -23 g / u) * (6,022 * 10 23 / mol)
- ou
- masse molaire en g / mol = masse moléculaire moyenne en u
(Notez que ces relations sont vraies pour les valeurs théoriques et expérimentales, mais pas entre les valeurs expérimentales et théoriques. La masse molaire est le plus souvent théorique et la masse moléculaire moyenne est le plus souvent expérimentale)
La masse atomique moyenne de naturel l'hydrogène est 1,00794 u et que des ressources naturelles de l'oxygène est 15,9994 u; par conséquent, la masse moléculaire de naturel de l'eau avec la formule H 2 O est (2 x 1,00794 u) + u = 18,01528 15,9994 u. Par conséquent, une molaire de l'eau a une masse de 18,01528 g. Cependant, la masse exacte de l'hydrogène-1 (hydrogène le plus commun isotopes ) est 1,00783, et la masse exacte de l'oxygène-16 (isotope de l'oxygène le plus commun) est 15,9949, de sorte que la masse de la molécule la plus fréquente de l'eau est 18,01056 u . La différence de 0,00472 à 0,03% u ou provient du fait que les eaux naturelles contiennent des traces de molécules d'eau contenant de l'oxygène 17, l'oxygène 18 ou un atome d'hydrogène-2 ( Deutérium) atomes. Bien que cette différence est négligeable dans les calculs de chimie en vrac, il peut en résulter un échec complet dans les situations où le comportement des molécules individuelles questions, comme dans la spectrométrie de masse et de la physique des particules (où le mélange d'isotopes ne agit pas comme une moyenne).
Il existe également des situations dans lesquelles les distributions ne sont pas caractéristiques isotopiques comme avec eau lourde utilisée dans certains réacteurs nucléaires qui est artificiellement enrichis en deutérium. Dans ces cas, les valeurs calculées de la masse molaire et la masse moléculaire moyenne, qui sont finalement dérivés du poids atomiques classiques, ne seront pas les mêmes que la masse molaire réel ou de masse moléculaire moyenne de l'échantillon. Dans ce cas, la masse du deutérium est 2,0136 u et la masse moléculaire moyenne de cette eau (en supposant enrichissement en deutérium 100%) est (2 × 2,0136 u) + u = 15,9994 20,0266 u. Ce est une très grande différence de ~ erreur de 11% de la masse moléculaire moyenne attendue sur la base des poids atomiques standard. De plus la masse moléculaire la plus abondante est en fait légèrement inférieure à la masse moléculaire moyenne car l'oxygène-16 est toujours le plus commun. (2 × 2,0136 u) + u = 15,9949 20,0221 u. Bien que ce soit un exemple artificiel extrême, la variation naturelle dans les distributions isotopiques ne se produisent et sont mesurables.

