
Point d'ébullition
Renseignements généraux
Cette sélection écoles a été choisi par SOS Enfants pour les écoles dans le monde en développement ne ont pas accès à Internet. Il est disponible en téléchargement intranet. SOS Enfants a regardé des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
Le point d'ébullition d'un liquide est la température à laquelle la la pression de vapeur du liquide est égale à la pression de l'environnement entourant le liquide. Un liquide dans un environnement sous vide présente un point d'ébullition plus faible que lorsque le liquide est au pression atmosphérique. Et un liquide dans un environnement à haute pression a un point d'ébullition plus élevé que lorsque le liquide est à la pression atmosphérique. En d'autres termes, tous les liquides ont un nombre infini de points d'ébullition.
Le point d'ébullition normal (appelé également le point d'ébullition atmosphérique ou pression au point d'ébullition atmosphérique) d'un liquide est le cas spécial dans lequel la pression de vapeur du liquide est égale à la pression atmosphérique définie au niveau de la mer, une atmosphère. A cette température, la pression de vapeur du liquide devient suffisante pour vaincre la pression atmosphérique et soulever le liquide pour former des bulles à l'intérieur de la masse du liquide. Le point d'ébullition standard est maintenant (à partir de 1982) défini par IUPAC comme la température à laquelle se produit l'ébullition sous une pression de 1 bar.
Le chaleur de vaporisation est la quantité de chaleur requise pour convertir ou vaporiser un liquide saturé (à savoir, un liquide à son point d'ébullition) en une vapeur.
Les liquides peuvent passer à une vapeur à des températures inférieures à leurs points d'ébullition dans le processus de évaporation. L'évaporation est un phénomène de surface dans lequel des molécules situées près de la surface vapeur / liquide se échapper dans la phase vapeur. D'autre part, l'ébullition est un procédé dans lequel des molécules ne importe où dans la fuite de liquide, entraînant la formation de bulles de vapeur au sein du liquide.
La température et la pression de saturation
Un liquide saturé contient autant d'énergie thermique que possible sans faire bouillir (ou inversement une vapeur saturée contient que peu d'énergie thermique que possible sans condensation).
Température de saturation signifie point d'ébullition. La température de saturation est la température pour une pression de saturation correspondant à laquelle un liquide bout dans sa vapeur de phase . Le liquide peut être dit saturé avec energie thermique. Tous les résultats d'addition d'énergie thermique en un changement de phase.
Si le la pression dans un système reste constante ( isobare), une vapeur de saturation à la température commence à se condenser en phase liquide sous forme d'énergie thermique ( chaleur ) est retiré. De même, un liquide à la température et à la pression de saturation va bouillir dans sa phase vapeur sous forme d'énergie thermique supplémentaire est appliquée.
Le point d'ébullition correspond à la température à laquelle la pression de vapeur du liquide est égale à la pression de l'environnement environnant. Ainsi, le point d'ébullition dépend de la pression. Habituellement, les points d'ébullition sont publiées par rapport à la pression atmosphérique (101,325 kilopascals ou 1 atm). A des altitudes plus élevées, où la pression atmosphérique est beaucoup plus faible, le point d'ébullition est également plus faible. Le point d'ébullition augmente avec l'augmentation de la pression jusqu'à la point critique, où les propriétés du gaz et de liquides deviennent identiques. Le point d'ébullition ne peut pas être augmenté au-delà du point critique. De même, le point d'ébullition diminue avec la diminution de la pression jusqu'à ce que point triple est atteint. Le point d'ébullition ne peut pas être réduite en dessous du point triple.
Si la chaleur de vaporisation et la pression de vapeur d'un liquide à une certaine température est connue, le point d'ébullition normal peut être calculée en utilisant le Équation de Clausius-Clapeyron ainsi:
![T_B = \ Bigg (\ frac {\, R \, [\, \ ln (P_0) - \ ln (101,325) \,]} {\ Delta H_ {vap}} + \ frac {1} {} T_0 \ Bigg ) ^ {- 1}](../../images/154/15428.png)
| où: | |
 | = Le point d'ébullition normal, K |
|---|---|
 | = La constante des gaz parfaits, 8,314 J · K -1 · mol -1 |
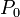 | = Est la pression de vapeur à une température donnée, kPa |
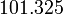 | = La pression atmosphérique, kPa |
 | = Chaleur de vaporisation du liquide, J / mol |
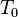 | = La température donnée, K |
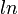 | = Le logarithme naturel à la base e |
la pression est la pression de saturation pour une température de saturation correspondant à laquelle un liquide revient dans sa phase vapeur. la pression de saturation et la température de saturation ont une relation directe: en tant que pression de saturation est augmentée si la température est de saturation.
Si la température dans un système reste constante (e système isotherme), de la vapeur à la pression de saturation et la température commencera à condenser en phase liquide en tant que la pression du système est augmentée. De même, un liquide à la pression de saturation et la température a tendance à flash dans sa phase vapeur en tant que la pression du système est réduite.
Le point d'ébullition de l'eau est de 100 ° C (212 ° F) à la pression normale. Au sommet de l'Everest , la pression est d'environ 260 mbar (26,39 kPa) sorte que le point d'ébullition d'eau est de 69 ° C . (156,2 ° F).
Pour les puristes, le point d'ébullition normal de l'eau est 99,97 degrés Celsius à une pression de 1 atm (c.-à 101,325 kPa). Jusqu'en 1982, ce était aussi le point d'ébullition niveau de l'eau, mais le UICPA recommande maintenant une pression normale de 1 bar (100 kPa). A cette pression légèrement réduite, le point d'ébullition niveau de l'eau est 99,61 degrés Celsius.
Relation entre le point d'ébullition normal et la pression de vapeur des liquides
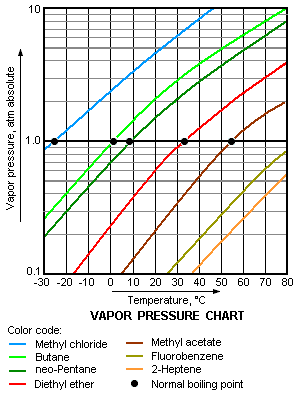
Plus la pression de vapeur d'un liquide à une température donnée, plus le point d'ébullition normal (ce est à dire, le point d'ébullition à la pression atmosphérique) du liquide.
Le graphique de la pression de vapeur vers la droite a des graphiques de pressions de vapeur par rapport à la température pour une variété de liquides. Comme on peut le voir dans le graphique, les liquides avec des pressions de vapeur plus élevées ont les plus faibles points d'ébullition normaux.
Par exemple, à ne importe quelle température donnée, le propane a la pression de vapeur la plus élevée de l'un des liquides dans le graphique. Il a également point le plus bas d'ébullition normale (-43,7 ° C), qui est l'endroit où la courbe de pression de vapeur de propane (ligne pourpre) coupe la ligne horizontale de pression de une atmosphère ( atm) de pression de vapeur absolue.
Sur le plan de interactions intermoléculaires, le point d'ébullition représente le point auquel les liquides molécules possèdent assez l'énergie thermique à surmonter les diverses attractions intermoléculaires liant les molécules dans le liquide (par exemple. dipôle-dipôle attraction, instantanée-dipôle induit-dipôle attractions, et liaisons hydrogène). Par conséquent, le point d'ébullition est également un indicateur de l'intensité de ces forces d'attraction.
Propriétés d'autres éléments
L'élément dont le point d'ébullition le plus bas est de l'hélium . Les deux points d'ébullition rhénium et le tungstène dépassent 5000 K à pression standard. En raison de la difficulté expérimentale de mesure précise des températures extrêmes sans parti pris, il ya une certaine différence dans la littérature quant à savoir si le tungstène ou le rhénium a le point d'ébullition supérieur.

