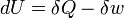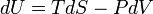Première loi de la thermodynamique
Renseignements généraux
Les articles de cette sélection écoles ont été organisés par sujet du programme d'études grâce aux bénévoles d'enfants SOS. SOS Enfants a regardé des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
| Lois de la thermodynamique |
|---|
| Loi Zéro |
| Première loi |
| Deuxième loi |
| Troisième loi |
| Relation fondamentale |
Dans la thermodynamique , la première loi de la thermodynamique est une expression de la loi physique plus universelle de la conservation de l'énergie. Succinctement, la première loi de la thermodynamique:
| " | L'augmentation de l'énergie interne d'un système est égale à la quantité d'énergie ajoutée par chauffage du système, moins la quantité perdue en raison du travail effectué par le système sur son environnement. | " |
Description
La première loi de la thermodynamique stipule essentiellement qu'un système thermodynamique peut stocker ou de conserver l'énergie et que ce interne de l'énergie est conservée. La chaleur est un processus par lequel l'énergie est ajouté à un système à partir d'une source de haute température, ou perdu à une basse température évier. En outre, l'énergie peut être perdue par le système quand il fait un travail mécanique sur son environnement, ou à l'inverse, il peut gagner de l'énergie à la suite de travaux effectués sur elle par son environnement. La première loi stipule que cette énergie est conservée: La variation de l'énergie interne est égale à la quantité ajoutée par chauffage moins le montant perdu en faisant des travaux sur l'environnement. La première loi peut être déclaré mathématiquement comme:
où 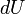 est une petite augmentation de l'énergie interne du système,
est une petite augmentation de l'énergie interne du système, 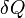 est une petite quantité de chaleur ajoutée au système, et
est une petite quantité de chaleur ajoutée au système, et 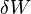 est une petite quantité de travail effectuée par le système. Par analogie, si la chaleur était l'argent, alors nous pourrions dire que tout changement dans nos économies (
est une petite quantité de travail effectuée par le système. Par analogie, si la chaleur était l'argent, alors nous pourrions dire que tout changement dans nos économies ( 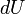 ) Est égale à l'argent que nous mettons en (
) Est égale à l'argent que nous mettons en ( 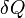 ) Moins l'argent que nous dépensons (
) Moins l'argent que nous dépensons ( 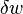 ).
).
Les δ est devant les conditions de chaleur et de travail sont utilisés pour indiquer qu'ils décrivent une augmentation de l'énergie qui doit être interprété un peu différemment que l'incrément dU de l'énergie interne. Travail et chaleur sont des processus qui ajoutent ou soustraient l'énergie, tandis que le U intérieur de l'énergie est une forme particulière d'énergie associée avec le système. Ainsi, le terme «énergie thermique» pour 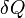 signifie «cette quantité d'énergie a ajouté que le résultat du chauffage» plutôt que de se référer à une forme particulière d'énergie. De même, le terme "d'énergie de travail»
signifie «cette quantité d'énergie a ajouté que le résultat du chauffage» plutôt que de se référer à une forme particulière d'énergie. De même, le terme "d'énergie de travail» 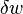 signifie «cette quantité d'énergie perdue à la suite du travail». Le résultat le plus significatif de cette distinction est le fait que l'on peut indiquer clairement la quantité d'énergie interne possédé par un système thermodynamique, mais on ne peut pas dire combien d'énergie se est écoulé dans ou hors du système à la suite de son être chauffé ou refroidi , ni à la suite de travaux exécutés sur ou par le système.
signifie «cette quantité d'énergie perdue à la suite du travail». Le résultat le plus significatif de cette distinction est le fait que l'on peut indiquer clairement la quantité d'énergie interne possédé par un système thermodynamique, mais on ne peut pas dire combien d'énergie se est écoulé dans ou hors du système à la suite de son être chauffé ou refroidi , ni à la suite de travaux exécutés sur ou par le système.
La première déclaration explicite de la première loi de la thermodynamique a été donnée par Rudolf Clausius en 1850 : "Il ya une fonction d'état E, appelée« énergie », dont l'écart est égal au travail échangé avec l'environnement au cours d'une processus adiabatique. "
Notez que la formulation ci-dessus est favorisée par des ingénieurs et des physiciens. Les chimistes préfèrent une seconde forme, dans lequel le terme de travail 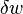 est défini comme le travail effectué sur le système, et insérez donc un signe plus dans l'équation ci-dessus avant le terme de travail. Cet article va utiliser la première définition exclusivement.
est défini comme le travail effectué sur le système, et insérez donc un signe plus dans l'équation ci-dessus avant le terme de travail. Cet article va utiliser la première définition exclusivement.
Formulation mathématique
L'énoncé mathématique de la première loi est donné par:
où 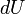 est l'augmentation infinitésimale de l'énergie interne du système,
est l'augmentation infinitésimale de l'énergie interne du système, 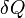 est la quantité infinitésimale de chaleur ajoutée au système, et
est la quantité infinitésimale de chaleur ajoutée au système, et 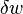 est la quantité infinitésimale du travail effectué par le système. La chaleur infinitésimal et le travail sont désignés par δ plutôt que d parce que, en termes mathématiques, ils ne sont pas différentielles exactes. En d'autres termes, ils ne décrivent pas l'état de ne importe quel système. L'intégrale d'un différentiel inexacte dépend du «chemin» particulière à travers l'espace des paramètres thermodynamiques alors l'intégrale d'une différentielle exacte ne dépend que des états initiaux et finaux. Si les états initiaux et finaux sont les mêmes, alors l'intégrale d'un différentiel inexacte peut ou ne peut pas être nul, mais l'intégrale d'une différentielle exacte sera toujours zéro. Le chemin emprunté par un système thermodynamique dans l'espace d'état est connu comme un processus thermodynamique.
est la quantité infinitésimale du travail effectué par le système. La chaleur infinitésimal et le travail sont désignés par δ plutôt que d parce que, en termes mathématiques, ils ne sont pas différentielles exactes. En d'autres termes, ils ne décrivent pas l'état de ne importe quel système. L'intégrale d'un différentiel inexacte dépend du «chemin» particulière à travers l'espace des paramètres thermodynamiques alors l'intégrale d'une différentielle exacte ne dépend que des états initiaux et finaux. Si les états initiaux et finaux sont les mêmes, alors l'intégrale d'un différentiel inexacte peut ou ne peut pas être nul, mais l'intégrale d'une différentielle exacte sera toujours zéro. Le chemin emprunté par un système thermodynamique dans l'espace d'état est connu comme un processus thermodynamique.
Une expression de la première loi peut être rédigée en termes de différences exactes en réalisant que le travail que fait un système est égale à ses moments de pression la variation infinitésimale de son volume. Autrement dit 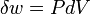 où
où 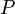 est pression et
est pression et 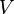 est le volume . Pour un processus réversible, la quantité totale de chaleur ajoutée à un système peut être exprimée comme
est le volume . Pour un processus réversible, la quantité totale de chaleur ajoutée à un système peut être exprimée comme 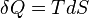 où
où  est la température et
est la température et 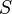 est l'entropie . Pour un processus réversible, la première loi peut maintenant être reformulée:
est l'entropie . Pour un processus réversible, la première loi peut maintenant être reformulée:
Dans le cas où le nombre de particules dans le système ne est pas nécessairement constante et peut être de différents types, la première loi est déposé:
où 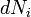 est le (petit) nombre de particules de type i ajoutés au système, et
est le (petit) nombre de particules de type i ajoutés au système, et 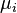 est la quantité d'énergie ajoutée au système quand une particule de type I est ajouté, où l'énergie de cette particule est telle que le volume et l'entropie du système reste inchangée.
est la quantité d'énergie ajoutée au système quand une particule de type I est ajouté, où l'énergie de cette particule est telle que le volume et l'entropie du système reste inchangée. 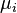 qui est connu comme le le potentiel chimique des particules de type i dans le système. La déclaration de la première loi des processus réversibles, en utilisant des différentielles exactes est maintenant:
qui est connu comme le le potentiel chimique des particules de type i dans le système. La déclaration de la première loi des processus réversibles, en utilisant des différentielles exactes est maintenant:
Une idée de la mécanique utile est que l'énergie acquise par une particule est égale à la force appliquée à la particule multiplié par le déplacement de la particule pendant que la force est appliquée. Considérons maintenant la première loi sans le terme de chauffage: 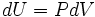 . La pression P peut être considérée comme une force (et en fait a des unités de force par unité de surface), tandis que dV est le déplacement (avec unités de fois la distance région). On peut dire, par rapport à cette période de travail, qu'une différence de pression force un transfert de volume et que le produit des deux (travail) est la quantité d'énergie transférée à la suite du processus.
. La pression P peut être considérée comme une force (et en fait a des unités de force par unité de surface), tandis que dV est le déplacement (avec unités de fois la distance région). On peut dire, par rapport à cette période de travail, qu'une différence de pression force un transfert de volume et que le produit des deux (travail) est la quantité d'énergie transférée à la suite du processus.
Il est utile de voir le terme TdS dans la même lumière: En ce qui concerne ce terme de chaleur, une différence de température oblige un transfert de l'entropie, et le produit des deux (la chaleur) est la quantité d'énergie transférée à la suite du processus . Ici, la température est connue comme une force "généralisé" (au lieu d'une force mécanique réelle) et l'entropie est un déplacement généralisé.
De même, une différence de potentiel chimique entre les groupes de particules dans le système impose une trasfer de particules, et le produit correspondant est la quantité d'énergie transférée à la suite du processus. Par exemple, envisager un système composé de deux phases: l'eau liquide et la vapeur d'eau. Il existe une "force" généralisé qui entraîne l'évaporation de molécules d'eau hors du liquide. Il ya une «force» généralisée de la condensation qui entraîne les molécules de vapeur sur la vapeur. Seulement lorsque ces deux «forces» (ou potentiels chimiques) sont égaux ce qu'il y aura équilibre, et le transfert net sera zéro.
Les deux paramètres thermodynamiques qui forment une paire force-déplacement généralisé sont appelées «variables conjuguées". Les deux paires les plus connus sont, bien entendu, la pression-volume et température-entropie.
Les types de processus thermodynamiques
Chemins à travers l'espace des variables thermodynamiques sont souvent spécifiées en maintenant certaines variables thermodynamiques constante. Il est utile de regrouper ces processus en paires, dans lequel chaque variable maintenue constante est un membre d'une paire de conjugué.
La paire conjugué pression-volume est préoccupé par le transfert de l'énergie mécanique ou dynamique à la suite des travaux.
- Un processus isobarique se produit à une pression constante. Un exemple serait d'avoir un piston mobile dans un cylindre, de sorte que la pression à l'intérieur du cylindre est toujours à la pression atmosphérique, bien qu'il soit isolé de l'atmosphère. En d'autres termes, le système est relié de façon dynamique, par une frontière mobile, à un réservoir à pression constante.
- Un processus isochore est celui dans lequel le volume est maintenu constant, ce qui signifie que le travail effectué par le système sera zéro. Il se ensuit que, pour la simple système de deux dimensions, toute l'énergie de la chaleur transférée au système externe sera absorbé l'énergie interne. Un processus isochore est également connu comme un processus isométrique. Un exemple serait de placer une boîte de conserve fermée contenant uniquement de l'air dans un feu. En première approximation, la boîte ne sera pas étendre, et le seul changement sera que le gaz gagne énergie interne, comme en témoigne l'augmentation de sa température et de pression. Mathématiquement,
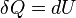 . Nous pouvons dire que le système est dynamique isolé, par une frontière rigide, de l'environnement
. Nous pouvons dire que le système est dynamique isolé, par une frontière rigide, de l'environnement
La paire conjugué température-entropie est préoccupé par le transfert d'énergie thermique à la suite de chauffage.
- Un processus isotherme se produit à une température constante. Un exemple serait d'avoir un système immergé dans un grand bain à température constante. Toute l'énergie de travail effectuée par le système sera perdu dans le bain, mais sa température reste constante. En d'autres termes, le système est relié thermiquement, par une frontière thermiquement conductrice à un réservoir à température constante.
- Un processus isentropique se produit à une entropie constante. Pour un processus réversible ce est identique à un processus adiabatique (voir ci-dessous). Si un système a une entropie qui n'a pas encore atteint sa valeur maximale d'équilibre, un processus de refroidissement peut être nécessaire pour maintenir cette valeur de l'entropie.
- Un procédé adiabatique est un procédé dans lequel il n'y a pas d'énergie ajoutée ou soustraite à partir du système de chauffage ou de refroidissement. Pour un processus réversible, ce est identique à un processus isentropique. Nous pouvons dire que le système est isolé thermiquement de son environnement et que sa frontière est un isolant thermique. Si un système comporte une entropie qui n'a pas encore atteint sa valeur maximale à l'équilibre, l'entropie augmente même si le système est isolé thermiquement.
Le ci-dessus ont tous assumé implicitement que les limites sont également imperméable aux particules. On peut supposer que les frontières sont à la fois rigide et thermiquement isolant, mais est perméable à un ou plusieurs types de particules. Des considérations similaires valent alors pour le (potentiel chimique) - (nombre de particules) des paires conjuguées.