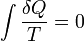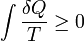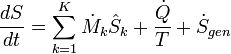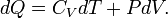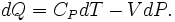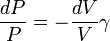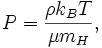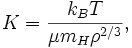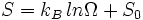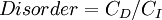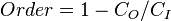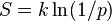Entropy
Contexte des écoles Wikipédia
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. Tous les enfants disponibles pour le parrainage de SOS Enfants des enfants sont pris en charge dans une maison de famille près de la charité. Lire la suite ...

| Articles Entropy |
|---|
| Introduction |
| Histoire |
| Classique |
| Statistique |
Dans la thermodynamique (une branche de la physique ), l'entropie est une mesure de l'indisponibilité d'un de système de l'énergie à faire le travail .
Ce est une mesure du caractère aléatoire de molécules dans un système et est au cœur de la seconde loi de la thermodynamique et de la la loi combinée de la thermodynamique, qui traitent avec les processus physiques et se ils se produisent spontanément. Changements spontanés, dans systèmes isolés, se produisent avec une augmentation de l'entropie. Changements spontanés ont tendance à lisser les différences de température , la pression, la densité , et potentiel chimique qui peuvent exister dans un système, et l'entropie est donc une mesure de savoir jusqu'où ce processus de lissage-out a progressé.
Le mot «entropie» est dérivé du grec εντροπία "un tournant vers" (εν- "dans" + τροπή "un tournant"), et est symbolisée par S en physique.
Explication
Lorsque l'énergie d'un système est définie comme la somme de son énergie «utile», (par exemple celui utilisé pour pousser un piston), et son «énergie inutile", ce est à dire que l'énergie qui ne peut être utilisé pour le travail externe , puis entropie peut être (plus concrètement) visualisé comme le "scrap" ou d'énergie "inutile" dont la prévalence énergétique sur l'énergie totale d'un système est directement proportionnelle à la température absolue de l'considéré système. (Notez les produits "TS" dans le l'énergie libre de Gibbs ou Helmholtz relations énergétiques gratuits).
L'entropie est une fonction d'une quantité de chaleur qui montre la possibilité de conversion de la chaleur en travail. L'augmentation de l'entropie est petite lorsque la chaleur est ajoutée à température élevée et est plus grand lorsque la chaleur est ajoutée à une température inférieure. Ainsi, pour l'entropie maximale il ya disponibilité minimale pour la conversion en travail et pour entropie minimum il ya une disponibilité maximale pour la conversion en travaux.
Sur le plan quantitatif, l'entropie est définie par la quantité de différentiel 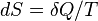 Où
Où 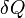 est la quantité de chaleur absorbée dans un isotherme et processus réversible dans laquelle le système passe d'un état à un autre, et T est la température absolue à laquelle le processus est en cours. L'entropie est un des facteurs qui détermine le l'énergie libre du système. Cette définition thermodynamique de l'entropie ne est valable que pour un système en équilibre (parce que la température est définie que pour un système en équilibre), alors que la définition statistique de l'entropie (voir ci-dessous) se applique à ne importe quel système. Ainsi la définition statistique est généralement considéré comme la définition fondamentale de l'entropie.
est la quantité de chaleur absorbée dans un isotherme et processus réversible dans laquelle le système passe d'un état à un autre, et T est la température absolue à laquelle le processus est en cours. L'entropie est un des facteurs qui détermine le l'énergie libre du système. Cette définition thermodynamique de l'entropie ne est valable que pour un système en équilibre (parce que la température est définie que pour un système en équilibre), alors que la définition statistique de l'entropie (voir ci-dessous) se applique à ne importe quel système. Ainsi la définition statistique est généralement considéré comme la définition fondamentale de l'entropie.
Entropy changement a souvent été définie comme un changement à un plus état désordonné à un niveau moléculaire. Au cours des dernières années, l'entropie a été interprété en termes de " dispersion "de l'énergie. L'entropie est une extensif fonction d'état qui tient compte des effets de irréversibilité systèmes thermodynamiques.
En termes de mécanique statistique , l'entropie décrit le numéro du possible configurations microscopiques du système. La définition statistique de l'entropie est la définition la plus fondamentale, à partir de laquelle toutes les autres définitions et toutes les propriétés de l'entropie suivent.
Origine du concept de
La première loi de la thermodynamique , formalisé à travers les expériences chaleur de friction James Joule en 1843, traite de la notion d'énergie, qui est conservé dans tous les processus; la première loi, toutefois, n'a pas dans sa capacité à quantifier les effets de frottement et dissipation.
Le concept d'entropie a été développé dans les années 1850 par l'allemand physicien Rudolf Clausius qui l'a décrit comme la transformation-contenu, ce est à dire de dissipation de l'énergie utilisation, d'un système thermodynamique ou corps de travail espèces chimiques lors d'un changement de État.
Bien que le concept d'entropie était à l'origine une construction thermodynamique, il a été adapté dans d'autres domaines d'études, y compris théorie de l'information, psychodynamique, thermoéconomie, et l'évolution .
Histoire

L'histoire de l'entropie commence avec le travail des Français mathématicien Lazare Carnot qui, dans ses 1803 papier Principes fondamentaux de l'équilibre et du mouvement proposé que dans ne importe quelle machine, les accélérations et les chocs des pièces en mouvement tous représentent des pertes de moment d'activité. En d'autres termes, dans tout processus naturel, il existe une tendance inhérente vers la dissipation d'énergie utile. Se appuyant sur ce travail, en 1824 le fils de Lazare Sadi Carnot publié Réflexions sur la puissance motrice du feu dans lequel il expose le point de vue que, dans tous les moteurs de chaleur chaque fois " calorique ", ou ce qui est maintenant connu comme la chaleur , tombe à travers une différence de température, que le travail ou force motrice peut être produite à partir des actions de la «chute du calorique» entre un corps chaud et le froid. Ce était un premier aperçu de la seconde loi de la thermodynamique .
Carnot a basé ses vues de chaleur en partie sur le début du 18e siècle "hypothèse newtonienne" que la chaleur et la lumière étaient les types de formes indestructibles de la matière, qui sont attirés et repoussés par d'autres matières, et en partie sur les vues contemporaines de Comte Rumford qui a montré en 1789 que la chaleur pourrait être créé par le frottement comme lorsque alésages de canon sont usinés. En conséquence, Carnot a estimé que si le corps de la substance de travail, comme un corps de vapeur d'eau, est ramené à son état d'origine (de température et de pression) à la fin d'une complète cycle du moteur, qui "se produit pas de changement dans l'état de l'organe de travail." Ce dernier commentaire a été modifié dans ses notes de bas, et ce est ce commentaire qui a conduit au développement de l'entropie.
Dans les années 1850 et 60, physicien allemand Rudolf Clausius gravement opposé à cette dernière supposition, ce est à dire qu'aucun changement ne se produit dans le corps de travail, et a donné ce «changement» une interprétation mathématique en se interrogeant sur la nature de la perte inhérente de chaleur utilisable lorsque le travail est effectué, p.ex. chaleur produite par le frottement. Ce était à la différence de vues antérieures, sur la base des théories de Newton , que la chaleur était une particule indestructible qui avait masse. Plus tard, des scientifiques tels que Ludwig Boltzmann, Josiah Willard Gibbs et James Clerk Maxwell ont entropie une base statistique. Carathéodory liée entropie avec une définition mathématique de l'irréversibilité, en termes de trajectoires et intégrabilité.
Définitions et descriptions
En science, le terme «entropie» est généralement interprété de trois manières distinctes, mais les semi-liés, ce est à dire du point de vue macroscopique ( de la thermodynamique classique ), un point de vue microscopique ( de la thermodynamique statistique ), et un point de vue de l'information ( théorie de l'information).
La définition statistique de l'entropie (voir ci-dessous) est la définition fondamentale parce que les deux autres peuvent être mathématiquement en découlent, mais pas vice versa. Toutes les propriétés de l'entropie (y compris la deuxième loi de la thermodynamique ) découlent de cette définition.
Point de vue macroscopique (thermodynamique classique)
| Variables conjuguées de la thermodynamique | |
|---|---|
| Pression | Volume |
| ( Stress) | ( Strain) |
| Température | Entropy |
| Potentiel chimique | nombre de particules |
Dans un système thermodynamique, un «univers» constitué de «environnement» et «systèmes» et composé de quantités de matière, ses différences de pression, les différences de densité, et les différences de température tous ont tendance à égaliser dans le temps - tout simplement parce que état d'équilibre a une plus grande probabilité (plus possible combinaisons de microétats) que tout autre - voir la mécanique statistique . Dans l' exemple de la fonte des glaces , la différence de température entre une pièce chaude (les abords) et le verre à froid de la glace et de l'eau (le système et ne fait pas partie de la pièce), commence à être égalisé que des portions de l'énergie thermique à partir d'un cadre chaleureux étaler au système de refroidissement de la glace et de l'eau.

Avec le temps, la température du verre et de son contenu et la température de la pièce devienne égale. L'entropie de la salle a diminué en partie de son énergie a été dispersé sur la glace et de l'eau. Cependant, comme calculé dans l'exemple, l'entropie du système de glace et d'eau a augmenté de plus de l'entropie de la salle environnante a diminué. Dans un système isolé comme la salle et de la glace d'eau pris ensemble, la dispersion de l'énergie de plus chaud à Cooler toujours traduit par une augmentation nette de l'entropie. Ainsi, lorsque le «univers» du système d'eau et de glace chambre a atteint un équilibre de température, le changement d'entropie de l'état initial est à un maximum. L'entropie de la système thermodynamique est une mesure de savoir jusqu'où l'égalisation a progressé.
Un cas particulier de l'augmentation de l'entropie, le entropie de mélange, se produit lorsque deux ou plusieurs substances différentes sont mélangés. Si les substances sont à la même température et la pression, il n'y aura pas d'échange net de chaleur ou de travail - l'augmentation entropie sera entièrement dû au mélange des différentes substances.
Du point de vue macroscopique, dans la thermodynamique classique l'entropie est interprété comme un simple fonction d'état d'un système thermodynamique: ce est une propriété en fonction seulement de l'état actuel du système, indépendamment de la façon dont cet état est venu à être atteint. La fonction d'état a la propriété importante qui, lorsqu'il est multiplié par une température de référence, il peut être considéré comme une mesure de la quantité d' énergie dans un système physique qui ne peut pas être utilisé pour faire un travail thermodynamique ; ce est à dire, le travail médiée par l'énergie thermique. Plus précisément, dans tout processus où le système donne de l'énergie Δ E et son entropie diminue de Δ S, une quantité au moins T R Δ S de cette énergie doit être accordée à l'environnement du système comme inutilisable de chaleur (T R est le température de milieu extérieur du système). Sinon, le processus ne sera pas aller de l'avant.
En 1862, Clausius a déclaré ce qu'il appelle le «théorème d'équivalence en respectant les valeurs des transformations» ou ce qui est maintenant connu comme le deuxième loi de la thermodynamique , comme tel:
- La somme algébrique de toutes les transformations qui se produisent dans un processus cyclique ne peut être positive, ou, comme un cas extrême, égale à rien.
Quantitativement, Clausius indique l'expression mathématique pour ce théorème est le suivant. Soit AQ un élément de la chaleur dégagée par le corps à ne importe quel réservoir de chaleur au cours de ses variations, la chaleur qui peut absorber à partir d'un réservoir étant compté comme ici négatif, et T la température absolue du corps au moment de donner cette chaleur, alors l'équation:
doit être vrai pour tous les processus cyclique réversible, et la relation:
doit détenir bon pour tous les processus cyclique qui est de toute façon possible. Ce est la formulation essentiel de la seconde loi et l'une des formes d'origine du concept de l'entropie. On voit que les dimensions de l'entropie sont l'énergie divisée par la température, qui est la même que les dimensions de La constante de Boltzmann (k B) et la capacité calorifique. Le Unité SI de l'entropie est " joule par kelvin »(J · K -1). De cette manière, la quantité" ΔS "est utilisé comme un type d'énergie interne, qui représente les effets de irréversibilité, dans l'équation de l'équilibre énergétique de tout système. Dans l' énergie libre Gibbs équation, à savoir AG = AH - TΔS, par exemple, qui est une formule couramment utilisée pour déterminer si les réactions chimiques se produisent, l'énergie liée à l'entropie changements TΔS est soustraite de la AH "total" d'énergie du système pour donner le "libre" Ag d'énergie du système, comme au cours d'une processus chimique ou comme quand un système change d'état.
Définition microscopique de l'entropie (mécanique statistique)
Dans la thermodynamique statistique de l'entropie est défini comme le nombre de configurations microscopiques qui se traduisent par la observés description macroscopique du système thermodynamique:
où
- k B est Constante 1,38066 × 10 -23 J K -1 et de Boltzmann
-
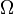 est le nombre de microétats correspondant à la macro-thermodynamique observée.
est le nombre de microétats correspondant à la macro-thermodynamique observée.
Cette définition est considéré comme la définition fondamentale de l'entropie (comme toutes les autres définitions peuvent être dérivées d'mathématiquement, mais pas vice versa). En 1896 Conférences de Boltzmann sur la théorie des gaz, il a montré que cette expression donne une mesure de l'entropie pour les systèmes d'atomes et de molécules dans la phase gazeuse, fournissant ainsi une mesure de l'entropie de la thermodynamique classique.
En 1877, Boltzmann visualisé de manière probabiliste pour mesurer l'entropie d'un ensemble de particules de gaz parfaits, dont il a défini l'entropie d'être proportionnelle au logarithme du nombre de micro-un tel gaz pourrait occuper. Désormais, le problème essentiel dans la thermodynamique statistique , ce est à dire en fonction de Erwin Schrödinger, a été de déterminer la distribution d'une quantité d'énergie donnée E sur N systèmes identiques.
La mécanique statistique explique entropie comme la quantité d'incertitude (ou "mixedupness» dans l'expression de Gibbs ) qui reste d'un système, d'après ses propriétés macroscopiques observables ont été prises en compte. Pour un ensemble donné de variables macroscopiques, comme la température et le volume, l'entropie mesure le degré auquel la probabilité que le système est réparti sur les différents états quantiques possibles. Les plus états disponibles dans le système avec une probabilité plus élevée, plus la entropie. Plus précisément, l'entropie est une mesure logarithmique de la densité d'états. En substance, l'interprétation la plus générale de l'entropie est une mesure de l'incertitude sur notre système. Le état d'un système d'équilibre maximise l'entropie parce que nous avons perdu toutes les informations sur les conditions initiales, sauf pour les variables conservées; maximisant l'entropie maximise notre ignorance sur les détails du système. Cette incertitude ne est pas du genre subjective de tous les jours, mais plutôt de l'incertitude inhérente à la méthode expérimentale et modèle interprétatif.
À l'échelle moléculaire, les deux définitions correspondent parce ajoutant de la chaleur à un système, ce qui augmente son entropie thermodynamique classique, augmente également du système fluctuations thermiques , donnant ainsi un manque accru d'informations sur l'état microscopique exacte du système, ce est à dire une augmentation de la entropie mécanique statistique.
Le modèle interprétatif a un rôle central dans la détermination de l'entropie. Le qualificatif "pour un ensemble donné de variables macroscopiques» ci-dessus a des implications très profondes: si deux observateurs utilisent différents ensembles de variables macroscopiques, alors ils observeront différentes entropies. Par exemple, si l'observateur A utilise les variables U, V et W, et l'observateur B utilise U, V, W, X, puis, en changeant X, l'observateur B peut provoquer un effet qui ressemble à une violation de la deuxième loi de la thermodynamique d'observateur A. En d'autres termes: l'ensemble des variables macroscopiques on choisit doit inclure tout ce qui peut changer dans l'expérience, sinon on pourrait voir diminuer l'entropie!
Entropie en thermodynamique chimiques
Entropie thermodynamique est central dans thermodynamique chimique, permettant de quantifier les changements et les résultats des réactions prévisibles. La seconde loi de la thermodynamique indique que l'entropie de la combinaison d'un système et de son environnement (ou dans une système isolé par lui-même) augmente pendant tous les processus chimiques et physiques spontanées. Spontanéité dans la chimie signifie "par lui-même, ou sans aucune influence extérieure", et n'a rien à voir avec la vitesse. L'équation de Clausius des δ q tr / T = Δ S introduit la mesure du changement d'entropie, Δ S. Changement entropie décrit la direction et quantifie l'ampleur des changements simples tels que la chaleur transfert entre systèmes - toujours du plus chaud à Cooler spontanément. Ainsi, lorsqu'un mole de substance à 0 K est réchauffée par son environnement à 298 K, la somme des valeurs incrémentielles de q tr / T constituent de chaque élément ou entropie molaire standard du composé, une propriété physique fondamentale et un indicateur de la quantité d'énergie stockée par un substance à 298 K. changement d'entropie mesure également le mélange de substances correspondant à la somme de leurs quantités relatives dans le mélange final.
Entropy est également essentiel de prévoir l'ampleur des réactions chimiques complexes, à savoir si un processus ira écrite ou de procéder dans la direction opposée. Pour de telles applications, Δ S doit être incorporé dans une expression qui inclut à la fois le système et ses environs, Δ de l'univers = environnement système + S Δ de Δ. Cette expression devient, par l'intermédiaire de certaines étapes, l' énergie libre Gibbs équation pour réactifs et des produits dans le système: Δ G [l' énergie libre de Gibbs changement du système] = Δ H [l' enthalpie changement] - T Δ S [le changement d'entropie] .
La deuxième loi
Un important loi de la physique, de la seconde loi de la thermodynamique , stipule que l'entropie totale de tout système thermodynamique isolé tend à augmenter au fil du temps, l'approche d'une valeur maximale; et donc, par voie de conséquence, l'entropie de l'univers (ce est à dire le système et ses environs), pris comme un système isolé, tend à augmenter. Deux conséquences importantes sont que la chaleur ne peut pas lui-même passer d'un froid à un corps chaud: ce est à dire, il est impossible de transférer la chaleur d'un endroit froid à un réservoir à chaud sans en même temps la conversion d'une certaine quantité de travail à la chaleur. Il est également impossible pour ne importe quel appareil qui peut fonctionner sur un cycle pour recevoir la chaleur à partir d'un seul réservoir et de produire un montant net de travail; il ne peut obtenir un travail utile sur la chaleur si la chaleur est en même temps transféré d'une chaude à un réservoir froid. Cela signifie qu'il n'y a pas possibilité d'une isolé " perpétuel "système de mouvement. De plus, à partir de cela, il se ensuit que la réduction de l'augmentation de l'entropie dans un procédé spécifié, tel qu'une réaction chimique , signifie qu'il est énergétiquement plus efficace.
En général, selon la seconde loi, l'entropie d'un système qui ne est pas isolé peut diminuer. Une climatiseur, par exemple, refroidit l'air dans une pièce, ce qui réduit l'entropie de l'air. La chaleur, cependant, impliqués dans le fonctionnement du climatiseur fait toujours une plus grande contribution à l'entropie de l'environnement que la diminution de l'entropie de l'air. Ainsi l'entropie totale de la salle et l'environnement augmente, en accord avec la deuxième loi.
Équation d'équilibre entropie pour les systèmes ouverts
En génie chimique, les principes de la thermodynamique sont couramment appliqué à " systèmes ouverts ", ce est à dire ceux dans lesquels la chaleur , le travail et la masse écoulement à travers les limites du système. Dans un système dans lequel il existe des flux de la chaleur ( 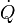 ) Et le travail, ce est-
) Et le travail, ce est- 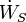 (Travail sur l'arbre) et P (dV / dt) (travail pression-volume), dans les limites du système, le flux de chaleur, mais pas le flux de travail, entraîne une modification de l'entropie du système. Ce taux de variation d'entropie est
(Travail sur l'arbre) et P (dV / dt) (travail pression-volume), dans les limites du système, le flux de chaleur, mais pas le flux de travail, entraîne une modification de l'entropie du système. Ce taux de variation d'entropie est 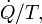 où T est l'absolu température thermodynamique du système à l'endroit de l'écoulement de chaleur. Si, en plus, il existe des flux de masse à travers les limites du système, l'entropie totale du système sera également changer en raison de ce flux de convection.
où T est l'absolu température thermodynamique du système à l'endroit de l'écoulement de chaleur. Si, en plus, il existe des flux de masse à travers les limites du système, l'entropie totale du système sera également changer en raison de ce flux de convection.

Pour dériver une équation équilibrée entropie généralisée, nous commençons par l'équation d'équilibre général pour le changement dans toute Θ vaste quantité dans un système thermodynamique, une quantité qui peut être soit conservée, comme l'énergie, ou non conservé, comme l'entropie. L'expression générique de base de la balance indique que dΘ / dt, ce est à dire le taux de variation de Θ dans le système, est égale à la vitesse à laquelle Θ entre dans le système au niveau des joints, moins la vitesse à laquelle Θ quitte le système à travers les limites du système, ainsi que la vitesse à laquelle Θ est généré dans le système. En utilisant cette équation d'équilibre générique, en ce qui concerne le taux de variation dans le temps de la grande quantité d'entropie S, l'équation du bilan d'entropie pour un système thermodynamique est ouvert:
où
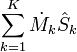 = Le taux net de flux d'entropie due aux flux de masse dans et hors du système (où
= Le taux net de flux d'entropie due aux flux de masse dans et hors du système (où 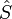 = Entropie par unité de masse).
= Entropie par unité de masse).
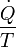 = Le débit d'écoulement d'entropie due à l'écoulement de chaleur à travers la limite du système.
= Le débit d'écoulement d'entropie due à l'écoulement de chaleur à travers la limite du système.
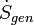 = La vitesse de génération interne d'entropie dans le système.
= La vitesse de génération interne d'entropie dans le système.
Notez aussi que se il ya plusieurs flux de chaleur, le terme 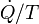 est destinée à être remplacée par
est destinée à être remplacée par  où
où  est le flux de chaleur et
est le flux de chaleur et 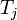 est la température à l'orifice d'écoulement de chaleur jième dans le système.
est la température à l'orifice d'écoulement de chaleur jième dans le système.
Entropie en mécanique quantique (von Neumann entropie)
En mécanique statistique quantique, le concept d'entropie a été développé par John von Neumann et est généralement appelé "l'entropie de von Neumann". Von Neumann a établi le cadre mathématique correct pour la mécanique quantique avec son travail Mathematische Grundlagen der Quantenmechanik. Il a fourni dans ce travail d'une théorie de la mesure, où la notion habituelle de l'effondrement d'onde est décrit comme un processus irréversible (la soi-disant von Neumann ou de mesure projective). En utilisant ce concept, en liaison avec le matrice densité il a étendu le concept classique de l'entropie dans le domaine quantique.
Il est bien connu que la définition de l'information basée entropie de Shannon conduit dans le cas classique de l'entropie de Boltzmann. Il est tentant de considérer l'entropie de Von Neumann que la définition de la mécanique quantique correspondante. Mais celui-ci est problématique du point de vue quantique de l'information. Par conséquent Stotland, Pomeransky, Bachmat et Cohen ont introduit une nouvelle définition de l'entropie qui reflète l'incertitude inhérente aux états quantiques. Cette définition permet de distinguer entre l'entropie d'incertitude minimum de l'état pur, et l'excès entropie statistique de mélanges.
Entropie en astrophysique
En astrophysique, ce qui est appelé «l'entropie» est en fait la constante adiabatique calculée comme suit.
Utilisation de la première loi de la thermodynamique pour un processus infinitésimale quasi-statique d'un système hydrostatique
Pour un gaz parfait dans ce cas particulier, l'énergie interne, U, est seulement une fonction de T; par conséquent la dérivée partielle de la capacité de chaleur par rapport à T est identiquement la même chose que le dérivé complet, ce qui donne par quelques manipulations
Autre manipulation en utilisant la version différentielle de la loi des gaz parfaits, l'équation précédente, et en supposant une pression constante, on trouve
Pour un processus adiabatique 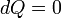 et rappelant
et rappelant 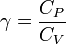 , On trouve
, On trouve
On peut résoudre cette équation différentielle simple à trouver
Cette équation est connue comme une expression de la constante adiabatique, K, aussi appelé le adiabatique. De l'équation des gaz parfaits on sait aussi
où 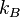 est la constante de Boltzmann. En substituant cette dans l'équation ci-dessus avec
est la constante de Boltzmann. En substituant cette dans l'équation ci-dessus avec ![V = [g] / \ rho](../../images/175/17559.png) et
et  pour un gaz monoatomique idéal on trouve
pour un gaz monoatomique idéal on trouve
où 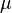 est le poids moléculaire moyen du gaz ou du plasma; et
est le poids moléculaire moyen du gaz ou du plasma; et  est la masse de l'atome d'hydrogène, qui est très proche de la masse du proton,
est la masse de l'atome d'hydrogène, qui est très proche de la masse du proton, 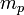 , La quantité le plus souvent utilisée dans la théorie astrophysique des amas de galaxies. Ce est ce que astrophysiciens se référer à "l'entropie" et dispose d'unités de [keV cm 2]. Cette quantité se rapporte à l'entropie thermodynamique
, La quantité le plus souvent utilisée dans la théorie astrophysique des amas de galaxies. Ce est ce que astrophysiciens se référer à "l'entropie" et dispose d'unités de [keV cm 2]. Cette quantité se rapporte à l'entropie thermodynamique
où 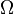 , La densité d'états dans la théorie statistique, prend la valeur de K tel que défini ci-dessus.
, La densité d'états dans la théorie statistique, prend la valeur de K tel que défini ci-dessus.
Définitions de manuels standard
Ce qui suit est une liste de définitions de l'entropie d'une collection de manuels. Notez que les définitions de manuels scolaires ne sont pas toujours les définitions les plus utiles, mais ils sont un aspect important de la culture entourant la notion d'entropie.
- Entropie - énergie ventilés irrémédiable chaleur .
- Constante fois de Boltzmann le logarithme d'une multiplicité; où la multiplicité d'une macroscopique est le nombre de microscopiques qui correspondent à l'état macroscopique.
- le nombre de façons d'arranger les choses dans un système (les temps La constante de Boltzmann).
- un thermodynamique de non conservé fonction d'état, mesurée en termes de nombre de un système micro-peuvent prendre, ce qui correspond à une dégradation utilisable énergie .
- une mesure directe de la aléatoire d'un système.
- une mesure de dispersion d'énergie à une température spécifique.
- une mesure de la perte partielle de la capacité d'un système à exécuter un travail en raison des effets de irréversibilité.
- un indice de la tendance vers un système de changement spontané.
- une mesure de l'indisponibilité de l'énergie d'un système pour faire le travail; également une mesure de désordre; l'entropie la plus élevée plus le trouble.
- un paramètre représentant l'état de trouble d'un système à l'échelle atomique, ionique ou moléculaire.
- une mesure du trouble ou de l'univers de la disponibilité de l'énergie dans un système à faire le travail.
Les approches de compréhension entropie
Ordre et désordre
L'entropie, historiquement, a souvent été associé à la quantité de afin, trouble, et / ou dans un chaos système thermodynamique. La définition traditionnelle de l'entropie, ce est qu'il se réfère à des changements dans le statu quo du système et est une mesure de "désordre moléculaire" et la quantité d'énergie gaspillée dans une transformation de l'énergie dynamique d'un état ou une forme à l'autre. En ce sens, un certain nombre d'auteurs, au cours des dernières années, ont dérivé formules d'entropie exactes de comptabiliser et de mesurer le trouble et l'ordre dans les assemblées atomiques et moléculaires. Une des formules plus simples afin entropie / trouble est celle dérivée en 1984 par le physicien Peter thermodynamique Landsberg, qui est basé sur une combinaison de la thermodynamique et arguments de la théorie de l'information. Landsberg affirme que lorsque les contraintes fonctionnent sur un système, de telle sorte qu'elle est empêchée d'entrer dans une ou plusieurs de ses états possibles ou permises, par opposition à ses états interdits, la mesure de la quantité totale de "trouble" dans le système est donnée par l'expression suivante:
De même, la quantité totale de "commande" dans le système est donnée par:
Dans lequel C D est le "désordre" capacité du système, qui est l'entropie des pièces contenues dans l'ensemble permis, C I est l '"information" capacité du système, une expression similaire à Shannon la capacité du canal, et C O est "l'ordre" capacité du système.
Dispersion d'énergie
Le concept d'entropie peut être décrit qualitativement comme une mesure de la dispersion d'énergie à une température donnée. Termes similaires ont été en usage dès le début de l'histoire de la thermodynamique classique , et avec le développement de la thermodynamique statistique et la théorie quantique , les changements entropie ont été décrits en termes de mélange ou de "diffusion" de l'énergie totale de chaque constituant d'un système sur ses niveaux d'énergie quantifiés particuliers.
Ambiguïtés dans les termes désordre et le chaos, qui ont généralement le sens directement opposés à l'équilibre, contribuent à une grande confusion et entravent la compréhension de l'entropie pour la plupart des étudiants. Comme la seconde loi de la thermodynamique montre, en système isolé parties internes à différentes températures auront tendance à se adapter à une température uniforme unique et donc de produire équilibre. Une approche éducative récemment développé évite les termes ambigus et décrit comme étalement de l'énergie que la dispersion, ce qui conduit à la perte des écarts nécessaires pour le travail, même si l'énergie totale reste constante en conformité avec la première loi de la thermodynamique . Physico-chimiste Peter Atkins, par exemple, qui a déjà écrit de la dispersion conduisant à un état désordonné, écrit maintenant que "des changements spontanés sont toujours accompagnés par une dispersion de l'énergie", et a jeté «désordre» comme une description.
la théorie de l'entropie et de l'information
En théorie de l'information, l'entropie est la mesure de la quantité d'informations qui est absent avant réception et est parfois appelée entropie de Shannon. Entropie de Shannon est un concept large et général qui trouve des applications dans théorie de l'information, ainsi que la thermodynamique. Il a été initialement conçu par Claude Shannon en 1948 pour étudier la quantité d'informations dans un message transmis. La définition de l'entropie de l'information est, cependant, tout à fait général, et est exprimé en termes d'un ensemble discret de probabilités  . Dans le cas des messages transmis, ces probabilités étaient les probabilités qu'un message particulier a été effectivement transmis, et l'entropie du système de messagerie était une mesure de la quantité d'information dans le message. Pour le cas des probabilités égales (ce est à dire chaque message est tout aussi probable), l'entropie de Shannon (en bits) ne est que le nombre de questions oui / non nécessaires pour déterminer le contenu du message.
. Dans le cas des messages transmis, ces probabilités étaient les probabilités qu'un message particulier a été effectivement transmis, et l'entropie du système de messagerie était une mesure de la quantité d'information dans le message. Pour le cas des probabilités égales (ce est à dire chaque message est tout aussi probable), l'entropie de Shannon (en bits) ne est que le nombre de questions oui / non nécessaires pour déterminer le contenu du message.
La question du lien entre l'entropie de l'information et l'entropie thermodynamique est un sujet chaudement débattu. Certains auteurs soutiennent qu'il ya un lien entre les deux, tandis que d'autres diront qu'ils ne ont absolument rien à voir avec l'autre.
Les expressions pour les deux entropies sont très similaires. Les informations entropie H pour des probabilités égales  est:
est:
où K est une constante qui détermine les unités de l'entropie. Par exemple, si les unités sont des bits, alors K = 1 / ln (2). La thermodynamique entropie S, d'un point de vue mécanique statistique a été exprimée par Boltzmann:
où p est la probabilité d'un système étant dans un état microscopique particulier, étant donné qu'il est dans un état macroscopique particulier, et k est la constante de Boltzmann. On peut voir que l'on peut penser de l'entropie thermodynamique constante, divisé par ln (2), multiplié par le nombre de Boltzmann des questions oui / non qui doivent être posées afin de déterminer l'état microscopique du système, étant donné que nous savons que les macroscopique. Le lien entre l'entropie thermodynamique et de l'information a été développé dans une série de documents par Edwin Jaynes à partir de 1957.
Le problème avec reliant entropie thermodynamique à l'information entropie, ce est que l'information entropie l'ensemble du corps de la thermodynamique qui traite de la nature physique de l'entropie est manquant. La deuxième loi de la thermodynamique qui régit le comportement des systèmes thermodynamiques à l'équilibre, et la première loi qui exprime l'énergie thermique que le produit de la température et l'entropie sont des concepts physiques plutôt que des concepts d'information. Si l'entropie thermodynamique est considéré comme incluant toutes les dynamiques physiques de l'entropie ainsi que les aspects statistiques d'équilibre, l'information entropie donne qu'une partie de la description de l'entropie thermodynamique. Certains auteurs, comme Tom Schneider, plaident en faveur de la suppression du terme entropie pour la fonction H de la théorie de l'information et l'aide d'autres terme «incertitude» de Shannon à la place.
exemple de fusion de la glace
L'illustration de cet article est un exemple classique dans laquelle l'entropie augmente dans un petit «univers», un système thermodynamique constitué de la (la pièce chaude) »des alentours» et «système» (verre, glace, eau froide). Dans cet univers, certains chaleur AQ de l'énergie à partir de l'environnement de pièce plus chaude (à 298 K ou 25 ° C) se propage vers le système de refroidissement de la glace et de l'eau à sa température constante T de 273 K (0 ° C), la température de fusion de glace. L'entropie du système va changer par la quantité dS = AQ / T, dans cet exemple AQ / 273 K. (La AQ de chaleur pour ce processus est l'énergie nécessaire pour changer l'eau de l'état solide à l'état liquide, et est appelé la enthalpie de fusion, à savoir le ΔH. pour la fusion de la glace) L'entropie de l'environnement change par une quantitédS= -AQ/ 298 K. Ainsi, dans cet exemple, l'entropie du système augmente, tandis que l'entropie de l'environnement diminue .
Il est important de réaliser que la diminution de l'entropie de la salle environnante est inférieure à l'augmentation de l'entropie de la glace et de l'eau: la température ambiante de 298 K est supérieure à 273 K, et donc le rapport, (changement d'entropie), d' AQ / 298 K pour l'environnement est plus petit que le rapport (changement d'entropie), de AQ / 273 K pour la glace système d'eau +. Pour trouver le changement d'entropie de notre «univers», nous additionnons les changements d'entropie pour ses mandants: la salle environnante, et la glace + eau. Le changement d'entropie totale est positive; cela est toujours le cas dans les événements spontanés dans un système thermodynamique et il montre l'importance prédictive de l'entropie: l'entropie net final après un tel événement est toujours plus grande que ne l'était l'entropie initiale.
Comme la température de l'eau fraîche se lève à celle de la chambre et la salle refroidit encore imperceptiblement, la somme de l' AQ / T sur la plage continue, à de nombreux paliers, d'abord dans le froid pour finalement l'eau chaude peut être trouvé par le calcul. La miniature toute «univers», à savoir ce système thermodynamique, l'entropie a augmenté. Energy a spontanément devenir plus dispersée et se propager dans cette «univers» que lorsque le verre d'eau glacée a été introduit et est devenu un «système» en son sein.
Sujets de l'entropie
Entropie et de la vie
Depuis plus d'un siècle et demi, en commençant par 1 863 mémoires de Clausius "sur la concentration des rayons de chaleur et de lumière, et sur les limites de son action", beaucoup d'écriture et de recherche a été consacrée à la relation entre l'entropie thermodynamique et l' évolution de la vie . L'argument selon lequel la vie se nourrit de l'entropie négative ou néguentropie comme mis en avant dans le livre 1944 What is Life? par physicien Erwin Schrödinger a servi de nouvelles mesures de relance à cette recherche. Écrits récents ont utilisé le concept de Gibbs l'énergie libre d'élaborer sur cette question. Tangentiellement, certains créationnistes ont fait valoir que l'entropie exclut évolution .
En 1982 manuels populaires Principles of Biochemistry par biochimiste américain a noté Albert Lehninger, par exemple, il est soutenu que l' ordre produit dans les cellules comme ils croissent et se divisent est plus que compensée par le désordre qu'ils créent dans leur environnement au cours de la croissance et la division. En bref, selon Lehninger, "organismes vivants conservent leur ordre interne en prenant de leur environnement de l'énergie libre, sous la forme de nutriments ou de la lumière du soleil, et de retourner à leur environnement une quantité égale de l'énergie comme la chaleur et l'entropie. "
Evolution liées définitions:
- Néguentropie- une phrase familière raccourci pour l'entropie négative.
- Ectropy- une mesure de la tendance d'un système dynamique de faire un travail utile et croître plus organisée.
- Syntropy- une tendance vers l'ordre et des combinaisons symétriques et les dessins de modèles de plus en plus avantageuses et ordonnée.
- Extropy- un terme métaphorique définir l'étendue de la vie ou l'intelligence de système organisationnel, par ordre fonctionnel, la vitalité, l'énergie, la vie, l'expérience et la capacité et l'entraînement pour l'amélioration et la croissance.
- Entropie écologique- une mesure dela biodiversitédans l'étude de la diversité biologiquede l'écologie.
La flèche du temps
L'entropie est la seule quantité dans les sciences physiques que les «pics» une direction particulière pour le temps, parfois appelé une flèche du temps. Comme nous allons "avant" dans le temps, la deuxième loi de la thermodynamique nous dit que l'entropie d'un système isolé ne peut augmenter ou rester la même; il ne peut pas diminuer. Ainsi, d'un point de vue, la mesure entropie est considéré comme une sorte d'horloge.
Entropie et de la cosmologie
Comme un univers fini peut être considéré comme un système isolé, il peut être soumis à la deuxième loi de la thermodynamique, de sorte que son entropie totale augmente constamment. Il a été spéculé que l'univers est voué à une mort de chaleur dans lequel tout l' énergie finit en une répartition homogène de l'énergie thermique, de sorte que pas plus de travail peut être extrait d'une source quelconque.
Si l'univers ne peut être considéré comme ayant généralement entropie croissante, puis - comme Roger Penrose l'a souligné - gravité joue un rôle important dans l'augmentation parce que la gravité provoque la matière dispersée à accumuler en étoiles, qui chute finalement dans les trous noirs . Jacob Bekenstein et Stephen Hawking ont montré que les trous noirs ont l'entropie maximale possible de tout objet de taille égale. Cela fait d'eux des points finaux probables de tous les processus d'entropie croissante, si elles sont matière et d'énergie pièges totalement efficaces. Hawking a, cependant, a récemment changé sa position sur cet aspect.
Le rôle de l'entropie en cosmologie reste un sujet controversé. Des travaux récents ont jeté le doute sur la vaste hypothèse de la mort de la chaleur et de l'applicabilité de tout modèle thermodynamique simple à l'univers en général. Bien que l'entropie ne augmentation dans le modèle d'un univers en expansion, l'entropie maximale possible augmente beaucoup plus rapidement - donc la densité entropie diminue avec le temps. Il en résulte un "écart de l'entropie" pousser le système plus loin de l'équilibre. Autres facteurs aggravants, tels que la densité d'énergie du vide et macroscopiques quantiques effets, sont difficiles à concilier avec les modèles thermodynamiques, de faire des prévisions de la thermodynamique à grande échelle extrêmement difficile.
Autres relations
Autres définitions mathématiques
- Kolmogorov-Sinai entropie- un type mathématique de l'entropie dansles systèmes dynamiques liées aux mesures de partitions.
- Entropie topologique- une façon de définir l'entropie dans une carte de fonction itérée théorie ergodique.
- Entropie relative- est une mesure de distance naturelle à partir d'un "vrai" distribution de probabilitéPà un arbitraire distribution de probabilitéQ.
- Entropie Rényi- une mesure de l'entropie généralisée pour les systèmes fractales.
Définitions sociologiques
Le concept d'entropie a également pénétré le domaine dela sociologie, généralement comme unemétaphore pour le chaos, le désordre ou la dissipation de l'énergie, plutôt que comme une mesure directe de l'entropie thermodynamique ou de l'information:
- Entropology- l'étude ou de discussion de l'entropie ou le nom parfois donné àla thermodynamiquesanséquations différentielles.
- Entropie psychologique- la distribution d'énergie dans la psyché, ce qui tend à rechercher l'équilibre ou équilibre entre toutes les structures de la psyché.
- Entropie économique- une mesure semi-quantitative de la dissipation irrévocable et la dégradation de matériaux naturels et de l'énergie disponible par rapport à l'activité économique.
- Entropie sociale - une mesure de la structure du système social, ayant deux interprétations théoriques et statistiques, à savoir la société (variables macrosociétales) mesurée en termes de la façon dont les différentes fonctions dans la société (variables microsocietal); également liée à l'équilibre social.
- Entropie d'entreprise - le gaspillage d'énergie que les formalités administratives et de l'équipe entreprise inefficacité, à savoir l'énergie perdue à perdre. (Cette définition est comparable à la notion de von Clausewitz de friction dans la guerre.)
Citations
| " | Toute méthode impliquant la notion del'entropie, l'existence même de ce qui dépend de ladeuxième loi de la thermodynamique, semblera sans doute pour beaucoup exagéré, et peut repousser les débutants comme obscure et difficile à comprendre. | " |
- -Willard Gibbs,méthodes graphiques dans la thermodynamique des fluides(1873)
| " | Ma plus grande préoccupation était comment l'appeler. Je pensais l'appeler «information», mais le mot a été trop utilisé, donc je décidai de l'appeler «l'incertitude». Quand je discuté avec John von Neumann , il avait une meilleure idée. Von Neumann m'a dit, 'Vous devez appeler l'entropie , pour deux raisons. En premier lieu, votre fonction d'incertitude a été utilisé dans la mécanique statistique sous ce nom, il a déjà un nom. En second lieu, et plus important encore, personne ne sait ce que l'entropie est vraiment, donc dans un débat que vous aurez toujours l'avantage. | " |
- --Conversation EntreClaude Shannon etJohn von Neumannau sujet de ce nom à donner à la «mesure de l'incertitude" ou l'atténuation des signaux de la ligne téléphonique (1949)
| " | Chaque étoile qui brûle, chaque planète dont l'orbite est lentement en décomposition, chaque souffle que vous prenez et en calories à métaboliser apporte l'univers de plus en plus près du point où l'entropie est maximisée, mouvement organisé de toute sorte cesse, et rien ne se reproduise plus jamais. On ne peut échapper. Peu importe combien magnifique vie dans l'univers devient ou comment avancée, la lente augmentation de l'entropie ne peut être arrêtée - l'univers finira par mourir. | " |
- --Warren Friedl, Université de Windsor (2007)