
La vitesse de réaction
Renseignements généraux
Cette sélection écoles a été choisi par SOS Enfants pour les écoles dans le monde en développement ne ont pas accès à Internet. Il est disponible en téléchargement intranet. SOS Children travaille dans 45 pays africains; pouvez-vous aider un enfant en Afrique ?


La vitesse de réaction ou la vitesse de réaction pendant une réactif ou produit dans un particulier réaction est intuitivement défini comme la vitesse à laquelle une réaction se produit. Par exemple, le oxydation du fer dans l'atmosphère est une réaction lente qui peut prendre de nombreuses années, mais la combustion de butane dans un incendie est une réaction qui se déroule en quelques fractions de seconde.
Cinétique chimique est la part de chimie physique qui étudie les taux de réaction. Les concepts de la cinétique chimique sont appliqués dans de nombreuses disciplines, telles que génie chimique, enzymologie et ingénierie de l'environnement .
Définition formelle de la vitesse de réaction
Considérons un typique réaction chimique :
- aA + bB → PP + qQ
Les lettres minuscules (a, b, p et q) représentent coefficients stoechiométriques, tandis que les lettres majuscules représentent la réactifs (A et B) et le produits (P et Q).
Selon IUPAC de Livre d'or de la définition v la vitesse de réaction (également R ou R) pour une réaction chimique qui se produit dans un système en vase clos dans des conditions à volume constant, sans accumulation de intermédiaires de réaction, est défini comme:
Le IUPAC recommande à l'unité de temps doit toujours être la seconde. Dans un tel cas, la vitesse de réaction différente de la vitesse d'augmentation de la concentration d'un produit P par un facteur constant (l'inverse de son nombre stoechiométrique) et à un réactif A moins par l'inverse du nombre stoechiométrique. La vitesse de réaction a généralement les unités de mol dm -3 s -1. Il est important de garder à l'esprit que la définition précédente est valable que pour une seule réaction, dans un système fermé de volume constant. Cette hypothèse le plus souvent implicite doit être déclaré explicitement, sinon la définition est incorrecte: Si l'eau est ajouté à un pot contenant de l'eau salée, la concentration de sel diminue, bien qu'il n'y ait pas de réaction chimique.
Pour tout système en général la pleine bilan de masse doit être prise en compte: IN - OUT + GÉNÉRATION = ACCUMULATION
Lorsqu'il est appliqué au cas simple indiqué précédemment cette équation se réduit à: ![v = \ frac {d [A]} {dt}](../../images/163/16346.png)
Pour une seule réaction dans un système fermé de volume variable le taux dite de conversion peut être est utilisé, afin d'éviter de manipuler des concentrations. Elle est définie comme la dérivée de la étendue de la réaction par rapport au temps.
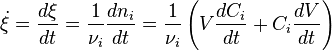
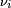 est le coefficient stoechiométrique pour la substance i,
est le coefficient stoechiométrique pour la substance i, 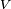 est le volume de réaction et
est le volume de réaction et 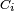 est la concentration de substance i.
est la concentration de substance i.
Lorsque des produits secondaires ou des intermédiaires de réaction sont formés, l'IUPAC recommande l'utilisation des termes vitesse d'apparition et le taux de disparition des produits et des réactifs, respectivement.
Les vitesses de réaction peuvent également être définis sur une base qui ne est pas le volume du réacteur. Quand un catalyseur est utilisé, la vitesse de réaction peut être indiqué sur le poids de catalyseur (g mol -1 s -1) ou de la surface (m mol -2 s -1) base. Si la base est un site de catalyseur spécifique qui peut être rigoureusement compté par une méthode déterminée, le taux est donnée en unités de s -1 et est appelé une fréquence de rotation.
Facteurs influant sur la vitesse de réaction
Les facteurs qui affectent la vitesse de réaction:
- Concentration: hausses de taux de réaction de concentration, tel que décrit par le loi de vitesse et expliquée par la théorie de la collision. Comme réactifs concentration augmente, la fréquence de collision augmente.
- La nature de la réaction: Certaines réactions sont naturellement plus rapidement que d'autres. Le nombre d'espèces réactives, de leur état physique (les particules solides qui se forment déplace beaucoup plus lentement que ceux des gaz ou celles en solution ), la complexité de la réaction et d'autres facteurs peuvent influencer considérablement la vitesse d'une réaction.
- Température : Généralement la réalisation d'une réaction à une température supérieure fournit plus d'énergie dans le système et augmente la vitesse de réaction en provoquant davantage de collisions entre les particules, comme expliqué par la théorie de la collision. Toutefois, la principale raison pourquoi il augmente la vitesse de réaction, ce est que plusieurs des particules en collision auront la nécessaire énergie d'activation résultant de collisions plus de succès (où les obligations sont formés entre des réactifs). L'influence de la température est décrit par la Équation d'Arrhenius. Comme un règle générale, les taux de réaction pour de nombreuses réactions doubles ou triples pour chaque 10 degrés Celsius augmentation de la température, bien que l'effet de la température peut être très grande ou plus petite que cela (dans la mesure que les taux de réaction peut être indépendante de la température ou diminuent avec augmentation de la température!)
Par exemple, le charbon brûle dans une cheminée en présence d'oxygène, mais ce ne est pas quand il est stocké à la température ambiante. La réaction est spontanée à des températures basses et élevées, mais à la température ambiante son taux est si lent qu'il est négligeable. L'augmentation de la température, comme réalisé par une correspondance, permet à la réaction de commencer et ensuite elle se réchauffe, parce que ce est exothermique. Ce est valable pour d'autres combustibles, tels que le méthane , butane, de l'hydrogène ...
- Solvant : de nombreuses réactions ont lieu en solution et les propriétés du solvant affectent la vitesse de réaction. Le la force ionique a aussi un effet sur la vitesse de réaction.
- Pression: Le taux de réactions gazeux augmente avec la pression, qui est, en fait, correspond à une augmentation de la concentration du gaz. Pour les réactions en phase condensée, le dependendence de pression est faible.
- Rayonnement électromagnétique : Le rayonnement électromagnétique est une forme d'énergie de sorte qu'il peut accélérer le rythme ou même faire une réaction spontanée, car il fournit les particules des réactifs avec plus d'énergie. Cette énergie est d'une manière ou d'une autre stocké dans les particules réagissant (il peut rompre les liaisons, de promouvoir molécules aux Etats électronique ou vibrationnel excité ...) la création d'espèces intermédiaires qui réagissent facilement.
Par exemple, lorsque le méthane réagit avec le chlore dans l'obscurité, la vitesse de réaction est très lente. Il peut être accéléré lorsque le mélange est mis sous lumière diffuse. En plein soleil, la réaction est explosive.
- Un catalyseur : La présence d'un catalyseur augmente la vitesse de réaction (à la fois en avant et en arrière de la réaction) en fournissant une voie alternative avec une faible énergie d'activation .
Par exemple, le platine catalyse la combustion de l'hydrogène avec l'oxygène à température ambiante.
- Isotopes : Le effet isotopique cinétique consiste en une vitesse de réaction différents pour la même molécule si elle a, en général des différents isotopes d'hydrogène isotopes, en raison de la différence de masse entre l'hydrogène et le deuterium.
- Surface: En réactions sur les surfaces, qui ont lieu par exemple pendant la catalyse hétérogène, la vitesse de réaction augmente à mesure que la zone de surface fait. Cela est dû au fait que plus de particules du solide sont exposés et peuvent être frappés par des molécules de réactif.
- Ordre: L'ordre des commandes de réaction comment la concentration de réactif affecte la vitesse de réaction.
- Agitation: agitation peut avoir un effet important sur la vitesse de réaction pour réactions hétérogènes.
Tous les facteurs qui influent sur la vitesse de réaction sont prises en compte dans l'équation de la réaction de vitesse.
Taux équation
Pour une réaction chimique n A + B → m C + D, l'équation de vitesse ou loi de vitesse est un expression mathématique utilisée dans la cinétique chimique de relier la vitesse d'une réaction de la concentration de chaque réactif. Il est du genre:
Dans cette équation k (t) est le coefficient de vitesse de réaction ou la vitesse constante, même se il ne est pas vraiment une constante, car elle comprend tous les paramètres qui affectent la vitesse de réaction, à l'exception de la concentration, qui est explicitement prise en compte. Parmi tous les paramètres décrits précédemment, la température est normalement la plus importante.
Les exposants n  et m
et m  sont appelés réaction ordres et dépendent de la mécanisme de réaction. Ils sont parfois le même que le les coefficients stoechiométriques de A et B, mais pas nécessairement.
sont appelés réaction ordres et dépendent de la mécanisme de réaction. Ils sont parfois le même que le les coefficients stoechiométriques de A et B, mais pas nécessairement.
Stoechiométrie, molécularité (le nombre réel de molécules entrent en collision) et Afin de réaction ne coïncide nécessairement dans les réactions élémentaires, ce est-à ces réactions qui ont lieu en une seule étape. L'équation de réaction pour les réactions élémentaires coïncide avec le processus qui se déroule à l'échelle atomique, ce est à dire n molécules de type A sont collision avec m molécules de type B (n plus m est la molécularité).
Pour les gaz la loi de vitesse peut aussi être exprimée en unités de pression en utilisant par exemple la loi des gaz parfaits.
En combinant la loi de vitesse avec un bilan massique pour le système dans lequel la réaction se produit, une expression de la vitesse de variation de concentration peut être dérivé. Pour un système fermé à volume constant une telle expression peut ressembler
Influence de la température
Chaque coefficient de vitesse de réaction k a une dépendance à la température, qui est généralement donnée par la Équation d'Arrhenius:
E a est l' énergie d'activation et R est le constante des gaz. Comme à la température T les molécules ont des énergies fournies par un Distribution de Boltzmann, on peut se attendre le nombre de collisions avec une énergie supérieure à E un être proportionnelle à 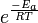 . A est le facteur pré-exponentiel ou facteur de fréquence.
. A est le facteur pré-exponentiel ou facteur de fréquence.
Les valeurs de A et E un dépendent de la réaction. Il existe également des équations plus complexes possibles, qui décrivent la dépendance de la température d'autres constantes de vitesse qui ne suivent pas cette tendance.
la dépendance de la pression
La dépendance de la pression de la constante de vitesse de résumés réactions Phase (ie, quand les réactifs et produits sont des solides ou liquides) est généralement suffficiently faible dans la gamme de pressions normalement rencontrées dans l'industrie qu'elle est négligée dans la pratique.
La dépendance de la pression de la constante de vitesse est associé avec le volume d'activation. Pour la réaction de procéder par le biais d'un complexe de l'État-activation:
le volume d'activation, 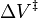 , Est:
, Est:
où 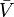 désigner les volumes molaires partielles des réactifs et des produits, et
désigner les volumes molaires partielles des réactifs et des produits, et 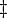 indique le complexe de l'état d'activation.
indique le complexe de l'état d'activation.
Pour la réaction ci-dessus, on peut se attendre le changement de la constante de vitesse de réaction (basé soit sur fraction molaire ou molal-concentration) avec la pression à température constante d'être:
En pratique, la question peut être compliqué car les volumes molaires partielles et le volume d'activation peuvent être eux-mêmes une fonction de la pression.
Les réactions peuvent augmenter ou diminuer leurs taux avec la pression, depeding sur la valeur de 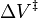 . A titre d'exemple de l'importance possible de l'effet de pression, certaines réactions organiques ont été présentés au double de la vitesse de réaction lorsque la pression a été augmentée de atomospheric (0,1 MPa) à 50 MPa (ce qui donne
. A titre d'exemple de l'importance possible de l'effet de pression, certaines réactions organiques ont été présentés au double de la vitesse de réaction lorsque la pression a été augmentée de atomospheric (0,1 MPa) à 50 MPa (ce qui donne 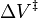 = -0,025 L / mol).
= -0,025 L / mol).
Exemples
Pour la réaction
L'équation de taux est de:
L'équation de taux ne reflète pas simplement les réactifs coefficients stoechiométriques dans la réaction globale: il est premier ordre en H 2, bien que le coefficient stoechiométrique est deux et il est le deuxième ordre dans NO.
Dans la cinétique chimique de la réaction globale est généralement proposé de se produire à travers un certain nombre d'étapes élémentaires. Toutes ces étapes affecte pas la vitesse de réaction; normalement ce ne est que l'étape la plus lente élémentaire qui affectent le taux de réation. Par exemple, dans:
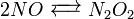 (Équilibre rapide)
(Équilibre rapide) 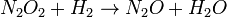 (Ralentir)
(Ralentir) 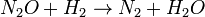 (Rapide)
(Rapide)
Les réactions 1 et 3 sont très rapide par rapport à la seconde, il est donc plus lente que la réaction se traduit par l'équation de vitesse. L'étape lente est considéré comme l'étape de la détermination de taux. Les ordres de l'équation de vitesse sont celles de l'étape de la détermination de taux.

![v = - \ frac {1} {a} \ frac {d [A]} {dt} = - \ frac {1} {b} \ frac {d [B]} {dt} = \ frac {1} { p} \ frac {d [P]} {dt} = \ frac {1} {q} \ frac {d [Q]} {dt}](../../images/163/16344.png)
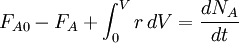
![\, R = k (T) [A] ^ {n '} [B] m ^ {'}](../../images/163/16350.png)
![\ Frac {d [C]} {} dt = k (T) [A] ^ {n '} [B] ^ {m'}](../../images/163/16352.png)
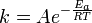
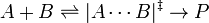

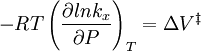
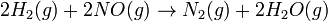
![r = k [H_2] ^ 1 [NO] ^ 2 \,](../../images/163/16362.png)
