
Chlore
Saviez-vous ...
SOS Enfants, qui se déroule près de 200 sos écoles dans le monde en développement, a organisé cette sélection. Le parrainage d'enfants aide les enfants un par un http://www.sponsor-a-child.org.uk/ .
| Chlore | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
17 Cl | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||
gaz jaune-vert pâle  | ||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||
| Nom, symbole, nombre | chlore, Cl, 17 | |||||||||||||||||||||||||||
| Prononciation | / k l ɔər Je n / Klohr -een ou / k l ɔər ɨ n / Klohr -ən | |||||||||||||||||||||||||||
| Catégorie Metallic | halogène | |||||||||||||||||||||||||||
| Groupe, période, bloc | (17) les halogènes , 3, p | |||||||||||||||||||||||||||
| Poids atomique standard | 35,45 (1) | |||||||||||||||||||||||||||
| Configuration électronique | [ Ne ] 3s 2 3p 5 2, 8, 7 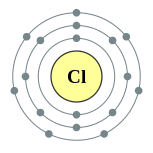 | |||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||
| Découverte | Carl Wilhelm Scheele (1774) | |||||||||||||||||||||||||||
| Premier isolement | Carl Wilhelm Scheele (1774) | |||||||||||||||||||||||||||
| Reconnu comme un élément par | Humphry Davy (1808) | |||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||
| Phase | gaz | |||||||||||||||||||||||||||
| Densité | (0 ° C, 101,325 kPa) 3,2 g / L | |||||||||||||||||||||||||||
| Liquid densité à BP | 1,5625 g · cm -3 | |||||||||||||||||||||||||||
| Point de fusion | 171,6 K , -101,5 ° C, -150,7 ° F | |||||||||||||||||||||||||||
| Point d'ébullition | 239,11 K, -34,04 ° C -29,27 ° C | |||||||||||||||||||||||||||
| Point critique | 416,9 K, 7,991 MPa | |||||||||||||||||||||||||||
| La chaleur de fusion | (Cl 2) 6,406 kJ · mol -1 | |||||||||||||||||||||||||||
| Chaleur de vaporisation | (Cl 2) 20,41 kJ · mol -1 | |||||||||||||||||||||||||||
| Capacité thermique molaire | (Cl 2) 33,949 J · mol -1 · K -1 | |||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||
| États d'oxydation | 7, 6, 5, 4, 3, 2, 1, -1 (Fortement acide oxyde) | |||||||||||||||||||||||||||
| Électronégativité | 3,16 (échelle de Pauling) | |||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 1251,2 kJ · mol -1 | |||||||||||||||||||||||||||
| 2ème: 2298 kJ · mol -1 | ||||||||||||||||||||||||||||
| 3ème: 3822 kJ · mol -1 | ||||||||||||||||||||||||||||
| Rayon covalente | 102 ± 16 heures | |||||||||||||||||||||||||||
| Rayon de Van der Waals | 175 h | |||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||
| Crystal structure | orthorhombique  | |||||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | |||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C)> 10 Ω · m | |||||||||||||||||||||||||||
| Conductivité thermique | 8,9 × 10 -3 W · m -1 · K -1 | |||||||||||||||||||||||||||
| Vitesse du son | (Gaz, 0 ° C) 206 m · s -1 | |||||||||||||||||||||||||||
| Numéro de registre CAS | 7782-50-5 | |||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||
| Article détaillé: Isotopes de chlore | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Le chlore est un élément chimique avec le symbole Cl et de numéro atomique 17. Le chlore est dans le groupe d'halogène (17) et le second est plus léger après halogène fluor . L'élément est un gaz jaune-vert sous des conditions standards, où il forme des molécules diatomiques. Il a le plus haut affinité électronique et le troisième plus haut électronégativité de tous les éléments; pour cette raison, le chlore est un solide agent oxydant. Le chlore libre est rare sur la Terre, et est habituellement un résultat de l'oxydation directe ou indirecte par l'oxygène.
Le composé le plus commun de chlore, chlorure de sodium , a été connu depuis l'Antiquité. Autour de 1630 du chlore gazeux a été sythesized premier d'une réaction chimique, mais pas reconnue comme une substance fondamentale. Caractérisation de gaz de chlore a été faite en 1774 par Carl Wilhelm Scheele, qui supposait que ce un oxyde d'un élément nouveau. En 1809, les chimistes ont suggéré que le gaz pourrait être un élément pur, et cela a été confirmé par Sir Humphry Davy en 1810, qui nommé de grec ancien : Khloros de χλωρóς "vert pâle".
Presque tout le chlore dans la croûte de la Terre se produit sous forme de chlorure dans divers composés ioniques, y compris sel de table. C'est le halogène secondes plus abondant et 21 élément chimique le plus abondant dans la croûte terrestre. Chlore élémentaire est produit commercialement à partir la saumure par électrolyse. Le potentiel oxydant élevé de chlore élémentaire conduit commercialement au chlore libre de blanchiment et désinfectant utilisations, ainsi que ses nombreuses utilisations d'un réactif essentiel dans l'industrie chimique. Le chlore est utilisé dans la fabrication d'une large gamme de produits de consommation, environ les deux tiers sont des produits chimiques organiques, tels que le polychlorure de vinyle, ainsi que de nombreux produits intermédiaires pour la production de matières plastiques et d'autres produits finaux qui ne contiennent pas l'élément. Comme un désinfectant commun, de chlore et de chlore génératrices de composés élémentaires sont utilisés plus directement dans piscines pour les garder propres et sanitaire.
Sous la forme de des ions chlorure, de chlore est nécessaire pour toutes les espèces connues de la vie. D'autres types de composés chlorés sont rares dans les organismes vivants et organiques chlorés produites artificiellement vont de inerte à des substances toxiques. Dans le la haute atmosphère, molécules organiques contenant du chlore tels que chlorofluorocarbones ont été impliqués dans la couche d'ozone . De petites quantités de chlore élémentaire sont générés par l'oxydation du chlorure de dans l'hypochlorite neutrophiles, dans le cadre de la réponse immunitaire contre les bactéries. Chlore élémentaire à des concentrations élevées est extrêmement dangereux et toxique pour tous les organismes vivants, et a été historiquement utilisé dans la Première Guerre mondiale comme le premier agent gazeux de guerre chimique.
Caractéristiques
Les caractéristiques physiques de chlore et ses composés

À température et pression normales, deux atomes de chlore forment le molécule diatomique Cl 2. Ce est un gaz jaune-vert qui a une forte odeur distinctive, familier à la plupart de la common eau de javel. La liaison entre les deux atomes est relativement faible (seulement 242,580 ± 0,004 kJ / mol), ce qui rend la molécule Cl 2 fortement réactif. Le point d'ébullition régulière atmosphère est d'environ -34 ° C, mais il peut être liquéfié à la température ambiante avec des pressions supérieures à 740 kPa.
Bien que le chlore élémentaire est yelow-vert, des ions chlorure, en commun avec d'autres ions halogénures, n'a pas de couleur soit dans des minéraux ou des solutions (par exemple, sel de table). De même, (encore une fois comme avec d'autres halogènes) des atomes de chlore confèrent pas de couleur de chlorures organiques quand ils remplacent les atomes d'hydrogène dans les composés organiques incolores, tels que le tétrachlorométhane . Le point de fusion et la densité de ces composés est augmentée par substitution d'un atome d'hydrogène à la place du chlore. Composés de chlore avec d'autres halogènes, cependant, ainsi que de nombreux oxydes de chlore, sont visiblement colorée.
Caractéristiques chimiques
Avec le fluor , le brome , l'iode et l'astate , le chlore est un membre de l' halogène série qui forme le groupe 17 (anciennement VII, VIIA, VIIB ou) de la classification périodique. forme des composés chlorés avec presque tous les éléments pour donner des composés qui sont généralement appelés chlorures. Le gaz de chlore réagit avec la plupart des composés organiques, et même soutenir lentement la combustion de des hydrocarbures.
L'hydrolyse du chlore ou dismutation libre dans l'eau
A 25 ° C et pression atmosphérique, une litre d' eau dissout 3,26 g ou 1,125 L de chlore gazeux. Les solutions de chlore dans l'eau contiennent du chlore (Cl 2), l'acide chlorhydrique, l'acide hypochloreux et:
- Cl 2 + H 2 O
 HCl + HClO
HCl + HClO
Cette conversion vers la droite est appelé dismutation, parce que l'ingrédient le chlore des augmentations et des diminutions dans l'état d'oxydation formel. La solubilité du chlore dans l'eau est augmentée si l'eau contient de l'hydroxyde alcalin dissous, et de cette manière, l'eau de Javel est produite.
- Cl 2 + 2 OH - → ClO - Cl + - + H 2 O
Le chlore gazeux ne existe que dans une solution neutre ou acide.
Chimie et composés
Chlore existe dans tous les impaires états d'oxydation de -1 à 7, ainsi que l'état élémentaire de zéro et quatre en dioxyde de chlore (voir tableau ci-dessous, et aussi des structures de chlorite). Progresser à travers les états, de l'acide chlorhydrique peut être oxydé en utilisant du dioxyde de manganèse, ou gaz de chlorure d'hydrogène oxydé catalytiquement par de l'air pour former du gaz de chlore élémentaire.
| Oxydation état | Nom | Formule | Composés caractéristiques |
|---|---|---|---|
| -1 | chlorures | Cl - | chlorures ioniques, les chlorures organiques, l'acide chlorhydrique |
| 0 | chlore | Cl 2 | chlore élémentaire |
| 1 | hypochlorites | CLO - | l'hypochlorite de sodium, l'hypochlorite de calcium |
| 3 | chlorites | CLO - 2 | le chlorite de sodium |
| 4 | chlore (IV) | ClO 2 | le dioxyde de chlore |
| 5 | chloryl, chlorates | CLO - 3 ClO + 2 | le chlorate de potassium, acide chlorique, dichloryl trisulfate [ClO2] 2 [S 3 O 10]. |
| 6 | chlore (VI) | Cl 2 O 6 | hexoxyde dichlorine (de gaz). Dans dismute liquides ou solides de mélanger des cinq et sept états d'oxydation, comme ionique chloryl perchlorate [ClO 2] + [ClO 4] - |
| 7 | perchlorates | CLO - 4 | l'acide perchlorique, les sels tels que le perchlorate le perchlorate de magnésium, dichlorine heptoxyde |
Chlorures
Le chlore se combine avec presque tous les éléments pour donner des chlorures. Les composés avec de l'oxygène , l'azote , le xénon et le krypton sont connus, mais ne forment pas par réaction directe des éléments. Le chlorure est l'un des anions les plus courants dans la nature. Le chlorure d'hydrogène et de sa solution aqueuse, l'acide chlorhydrique , sont produites à l'échelle de mégatonnes chaque année à la fois comme intermédiaires précieux mais parfois comme des polluants indésirables.
oxydes de chlore
Le chlore se forme une grande variété d'oxydes, comme on le voit ci-dessus: dioxyde de chlore (CIO2), monoxyde de dichlore (Cl 2 O), hexoxyde dichlorine (Cl 2 O 6), heptoxyde dichlorine (Cl 2 O 7). Les dérivés anioniques de ces mêmes oxydes sont également bien connus y compris chlorate (ClO -
3), chlorite (ClO -
2), hypochlorite (ClO -), et perchlorate (ClO -
4). Les dérivés d'acides de ces anions sont l'acide hypochloreux (HOCl), acide chlorique (HClO 3) et l'acide perchlorique (HClO 4). Le cation chloroxy chloryl (ClO 2 +) est connu et a la même structure que chlorite mais avec une charge positive et de chlore dans l'état d'oxydation +5. Le composé "trioxyde de chlore" ne se produit pas, mais plutôt sous forme de gaz se trouve que le dimère hexoxyde dichlorine (Cl 2 O 6) avec un état d'oxydation +6. Ce composé liquide ou solide dismute forme à un mélange de cinq et sept états d'oxydation sous la forme du composé ionique chloryl perchlorate, [ClO 2] + [ClO 4] -.
Dans une solution alcaline concentrée chaude dismute hypochlorite:
- 2 ClO - → Cl - + ClO -
2 - CLO - + ClO -
2 → Cl - + ClO -
3
Le chlorate de sodium et chlorate de potassium peut être cristallisé à partir de solutions formées par les réactions ci-dessus. Si leurs cristaux sont chauffés, ils subissent un autre, dismutation final:
- 4 ClO -
3 → Cl - + 3 - CLO
4
Cette même progression de chlorure de perchlorate peut être réalisé par électrolyse. La progression de la réaction à l'anode est la suivante:
Réaction Électrode
potentielCl - + 2 OH - → ClO - + H 2 O + 2 e - 0,89 volts CLO - + 2 OH - → ClO -
2 + H 2 O + 2 e -0,67 volts CLO -
2 + 2 OH - → ClO -
3 + H 2 O + 2 e -0,33 volts CLO -
3 + 2 OH - → ClO -
4 + H 2 O + 2 e -0,35 volts
Chaque étape est accompagnée à la cathode par
- 2 H 2 O 2 + e - → 2 OH - + H 2 (-0,83 volt)
Composés interhalogénés
Le chlore oxyde les sels de bromure et de l'iodure de brome et d'iode, respectivement. Cependant, il ne peut pas se oxyder sels de fluorure de fluor. Il fait une variété de des composés interhalogénés, tels que les fluorures de chlore, monofluorure de chlore (CLF), le trifluorure de chlore (ClF 3), pentafluorure de chlore (ClF 5). Les chlorures de brome et l'iode sont également connus.
Composés organochlorés
Le chlore est largement utilisé dans la chimie organique dans substitution et des réactions d'addition. Chlore donne souvent de nombreuses propriétés souhaitées à un composé organique , en partie en raison de son électronégativité.
Comme les autres halogénures, le chlore subit des réactions d'addition électrophile, la plus notable étant la chloration de alcènes et des composés aromatiques avec un Acide de Lewis catalyseur . Composés chlorés organiques ont tendance à être moins réactif en substitution nucléophile de réactions que les dérivés de brome ou d'iode correspondants, mais ils ont tendance à être moins cher. Elles peuvent être activées par réaction avec une substitution par groupe tosylate, ou par l'utilisation d'une quantité catalytique de l'iodure de sodium.
Occurrence
Dans le milieu interstellaire, le chlore est produit dans supernovae via le r-processus.
Dans les météorites et sur Terre, le chlore se trouve principalement le ion chlorure qui se produit dans les minéraux. Dans la croûte de la Terre, le chlore est présent à des concentrations moyennes d'environ 126 parties par million, principalement dans des minéraux comme halite ( chlorure de sodium ), sylvite ( chlorure de potassium), et carnallite (magnésium chlorure de potassium hexahydraté).
Le chlorure est un composant du sel qui se dépose dans la terre ou dissous dans les océans - environ 1,9% de la masse d'eau de mer est d'ions chlorure. Même des concentrations plus élevées de chlorure se trouvent dans la Mer Morte et souterrain les dépôts de la saumure. La plupart des sels de chlorure sont solubles dans l'eau, donc, les minéraux contenant du chlorure sont habituellement seulement trouvés en abondance dans les climats secs ou profondeur.
Plus de 2000 d'origine naturelle de composés organiques chlorés sont connus.
Isotopes
Le chlore a un large éventail de isotopes. Les deux stables isotopes sont 35 Cl (75,77%) et 37 Cl (24,23%). Ensemble, ils donnent un chlore poids atomique de 35,4527 g / mol. Le valeur demi-entier pour le poids de chlore a provoqué une certaine confusion dans les premiers jours de la chimie, quand il avait été postulé que les atomes étaient composées d'unités d'hydrogène même (voir La loi de Proust), et l'existence de produits chimiques des isotopes était insoupçonnée.
Des traces de radioactif 36 Cl existe dans l'environnement, dans un rapport d'environ 7x10 -13 à 1 avec des isotopes stables. Cl 36 est produit dans l'atmosphère par spallation de 36 Ar par des interactions avec rayons cosmiques protons . Dans l'environnement du sous-sol, 36 Cl est générée principalement du fait de la capture des neutrons par 35 Cl ou muon capture de 40 Ca . 36 Cl se désintègre en 36 S et 36 Ar , avec un combiné demi-vie de 308000 années. La demi-vie de cette isotope non réactif hydrophile rend approprié pour datation géologique dans la gamme de 60 000 à 1 million d'années. En outre, de grandes quantités de 36 Cl ont été produites par l'irradiation de l'eau de mer au cours des détonations atmosphériques de l'arme nucléaire entre 1952 et 1958. Le temps de séjour de 36 Cl dans l'atmosphère est d'environ 1 semaine. Ainsi, en tant que marqueur de l'eau 1950 de l'événement dans le sol et les eaux souterraines, 36 Cl est également utile pour la datation des eaux de moins de 50 ans avant le présent. 36 Cl a vu l'utilisation dans d'autres domaines des sciences géologiques, y compris datant glace et les sédiments.
Histoire
Le composé le plus commun de chlore, chlorure de sodium, a été connu depuis l'Antiquité; les archéologues ont trouvé des preuves que le sel gemme a été utilisé dès 3000 BC et de la saumure dès 6000 BC. Vers 1630, le chlore a été reconnu comme un gaz par le chimiste belge et médecin Jean-Baptiste Van Helmont.

Chlore élémentaire a été préparé et étudié en 1774 par le chimiste suédois Carl Wilhelm Scheele, et, par conséquent, il est crédité pour sa découverte. Il l'appelle «l'air de l'acide chlorhydrique déphlogistiqué", car il est un gaz (alors appelés "airs") et il est venu de l'acide chlorhydrique (alors connu comme "l'acide chlorhydrique"). Cependant, il n'a pas établi le chlore comme un élément, pensant à tort que ce était la oxyde obtenu à partir de l'acide chlorhydrique (voir théorie du phlogistique). Il a nommé le nouvel élément au sein de cet oxyde comme muriaticum. Indépendamment de ce qu'il pensait, Scheele n'a isoler le chlore par réaction MnO 2 (comme le minéral pyrolusite) avec HCl:
- 4 HCl + MnO 2 → MnCl 2 + H 2 O 2 + Cl 2
Scheele observé plusieurs des propriétés de chlore: l'effet de blanchiment sur décisif, l'effet mortel sur les insectes, la couleur vert-jaune, et l'odeur semblable à l'eau régale.
À l'époque, la théorie chimique commun était: tout acide est un composé qui contient de l'oxygène (toujours sonnant dans les noms allemands et néerlandais de l'oxygène : Sauerstoff ou zuurstof, à la fois la traduction en anglais que des choses acide), donc un certain nombre de chimistes, y compris Claude Berthollet, a suggéré que l'air de l'acide chlorhydrique déphlogistiqué de Scheele doit être une combinaison de l'oxygène et l'élément non encore découvertes, muriaticum.
En 1809, Louis Joseph Gay-Lussac et Louis-Jacques Thénard a essayé de décomposer l'air de l'acide chlorhydrique déphlogistiqué en le faisant réagir avec du charbon pour libérer l'élément muriaticum libre (et dioxyde de carbone). Ils ne ont pas réussi et a publié un rapport dans lequel ils ont considéré la possibilité que déphlogistiqué air de l'acide chlorhydrique est un élément, mais ne étaient pas convaincus.
En 1810, Sir Humphry Davy a tenté la même expérience à nouveau, et a conclu que ce est un élément, et non un composé. Il a nommé ce nouvel élément que le chlore, du mot grec (χλωρος de chloros), ce qui signifie vert-jaune. Le nom halogène , ce qui signifie "producteur de sel," a été utilisé à l'origine pour le chlore en 1811 par Johann Salomo Christoph Schweigger. Cependant, ce terme a été plus tard utilisé comme un terme générique pour décrire tous les éléments de la famille de chlore (fluor, le brome, iode), après une suggestion Jöns Jakob Berzelius en 1842. En 1823, Michael Faraday de chlore liquéfié pour la première fois, et démontré que ce qui était alors connu sous le nom «chlore solide" avait une structure d'hydrate de chlore (Cl 2 · H 2 O).
Le gaz de chlore a été utilisé la première fois par le chimiste français Claude Berthollet pour blanchir les textiles en 1785. blanchiment modernes résultent de la poursuite des travaux par Berthollet, qui, le premier produit l'hypochlorite de sodium dans 1789 dans son laboratoire sur le quai Javel à Paris , France, en faisant passer du chlore gazeux à travers une solution de carbonate de sodium. Le liquide résultant, connu sous le nom "Eau de Javel" (" Eau de Javel »), était une solution faible de l'hypochlorite de sodium. Cependant, ce processus ne était pas très efficace, et les méthodes de production alternatives ont été recherchées. Chimiste écossais et l'industriel Charles Tennant a produit d'abord une solution de l'hypochlorite de calcium ("de chaux chlorée»), alors solide d'hypochlorite de calcium (poudre de blanchiment). Ces composés produisent de faibles niveaux de chlore élémentaire, et qu'ils peuvent être transportés de manière plus efficace que l'hypochlorite de sodium, qui est resté solutions diluées car lorsqu'il est purifié pour éliminer l'eau, il est devenu un oxydant puissant et dangereusement instable. Près de la fin du XIXe siècle, ES Smith breveté une méthode de production d'hypochlorite de sodium impliquant électrolyse de saumure pour produire de l'hydroxyde de sodium et du chlore gazeux, qui a ensuite mélangés pour former de l'hypochlorite de sodium. Ceci est connu comme la processus de chlore-alcali, d'abord introduit à l'échelle industrielle en 1892, et maintenant la source de la quasi-totalité production moderne chlore élémentaire et de l'hydroxyde de sodium (une réaction d'électrolyse à basse température connexe, le Processus Hooker, est maintenant responsable de l'eau de Javel et production d'hypochlorite de sodium).
Solutions de chlore élémentaire dissous dans eau chimiquement base (sodium et hypochlorite de calcium) a été d'abord utilisé comme agents anti-putréfaction et des désinfectants dans les années 1820, en France, bien avant la création de la théorie des germes de la maladie. Ce travail est principalement due à Antoine-Germain Labarraque, qui a adapté "eau de Javel" l'eau de Javel de Berthollet et autres préparations de chlore dans le but (voir une histoire plus complète, voir ci-dessous). Chlore élémentaire a depuis servi une fonction continue dans l'antisepsie topique (solutions d'irrigation de la plaie, etc.) ainsi que l'hygiène publique (en particulier de la natation et de l'eau potable).
En 1826, chlorure d'argent a été utilisé pour produire des images photographiques pour la première fois. Chloroforme a été d'abord utilisé comme un anesthésique en 1847.
Le chlorure de polyvinyle (PVC) a été inventé en 1912, d'abord sans un but.
Le gaz de chlore a d'abord été présenté comme une arme, le 22 Avril 1915 au Ypres par la Armée allemande, et les résultats de cette arme furent désastreuses parce masques à gaz ne avaient pas été distribués en masse et étaient difficile à trouver rapidement.
Production

Dans l'industrie, le chlore élémentaire est habituellement produit par l'électrolyse du chlorure de sodium dissous dans l'eau. Cette méthode, la processus de chlore-alcali industrialisés en 1892, prévoit désormais la quasi-totalité du gaz de chlore industrielle. Avec le chlore, le procédé donne de l'hydrogène gazeux et de l'hydroxyde de sodium (avec de l'hydroxyde de sodium en fait être le plus crucial de ces trois produits industriels fabriqués selon le procédé). Le produit de traitement selon le schéma suivant équation chimique:
- 2 NaCl + H 2 O 2 → Cl 2 + H 2 + 2 NaOH
L'électrolyse de solutions de chlorure tout procéder selon les équations suivantes:
- Cathode: 2 H + (aq) + 2 e - → H 2 (g)
- Anode: 2 Cl - (aq) → Cl 2 (g) + 2 e -
Processus global: 2 NaCl (ou KCl) + 2 H 2 O → Cl 2 2 2 NaOH + H + (ou KOH)
Dans la cellule d'électrolyse à membrane, un amiante (ou polymère-fibre) diaphragme sépare une cathode et une anode, empêchant la formation de chlore à l'anode de re-mélange avec de l'hydroxyde de sodium et l'hydrogène formé à la cathode. La solution de sel (saumure) est introduit en continu dans le compartiment anodique et se écoule à travers la membrane vers le compartiment de cathode, où la caustique alcalin est produit et la saumure est partiellement déchargée. Méthodes membranes produisent diluer et légèrement impur alcalin mais ils ne sont pas accablés par le problème de la prévention des rejets de mercure dans l'environnement et ils sont plus économes en énergie. Membrane de la cellule d'électrolyse emploi comme une membrane perméable Echangeur d'ions. Sodium saturé (ou de potassium) une solution de chlorure est passé à travers le compartiment anodique, ce qui laisse une plus faible à concentration. Cette méthode est plus efficace que la cellule à diaphragme et produit très pur sodium (ou de potassium) hydroxyde à une concentration d'environ 32%, mais nécessite saumure très pure.

Les méthodes de laboratoire
De petites quantités de chlore gazeux peuvent être réalisés dans le laboratoire en combinant de l'acide chlorhydrique et le dioxyde de manganèse. En variante, un acide fort tel que l'acide sulfurique ou l'acide chlorhydrique réagit avec solution d'hypochlorite de sodium pour libérer du chlore gazeux mais réagit avec de chlorate de sodium pour produire du chlore gazeux et du dioxyde de chlore ainsi. Dans la maison, les accidents se produisent lorsque des solutions de blanchiment hypochlorite sont combinés avec certains vidange-nettoyants acides.
Applications
La production de produits industriels et de consommation
Principales applications de chlore sont dans la production d'une large gamme de produits industriels et de consommation. Par exemple, il est utilisé dans la fabrication des plastiques, des solvants pour le nettoyage à sec et le dégraissage des métaux, textiles, produits agrochimiques et pharmaceutiques, insecticides, colorants, produits d'entretien ménager, etc.
De nombreux produits industriels importants sont produits via des intermédiaires organochlorés. Des exemples comprennent polycarbonates, les polyuréthanes, les silicones, le polytétrafluoroéthylène, de la carboxyméthylcellulose, et l'oxyde de propylène. Comme les autres halogènes, le chlore participe à des réactions de substitution de radicaux libres avec des composés organiques contenant de l'hydrogène. Lorsqu'il est appliqué à des substrats organiques, la réaction est souvent, mais pas toujours non-régiosélective, et, par conséquent, peut conduire à un mélange de produits isomères. Il est souvent difficile de contrôler le degré de substitution ainsi, de sorte que plusieurs substitutions sont communs. Si les différents produits de réaction sont facilement séparés, par exemple par distillation, la chloration substitutive radicalaire (dans certains cas, accompagnée par déshydrochloration thermique simultané) peut être une voie de synthèse utile. Exemples industriels de ce sont la production de le chlorure de méthyle, le chlorure de méthylène, le chloroforme et le tétrachlorure de carbone à partir du méthane, le chlorure d'allyle à partir de propylene, et le trichloroéthylène, et tétrachloroéthylène 1,2-dichloroéthane.
Quantitativement, environ 63% et 18% de tout le chlore élémentaire produit est utilisé dans la fabrication des composés chlorés organiques et inorganiques, respectivement ,. Environ 15 000 composés chlorés sont utilisés commercialement. Le 19% restant est utilisé pour les agents de blanchiment et de produits de désinfection. La plus importante de composés organiques en termes de volume de production sont 1,2-dichloroéthane et le chlorure de vinyle, intermédiaires dans la production de PVC. Autres organochlorés sont particulièrement importants le chlorure de méthyle, le chlorure de méthylène, le chloroforme, le chlorure de vinylidène, trichloroéthylène, perchloroéthylène, le chlorure d'allyle, l'épichlorhydrine, le chlorobenzène, dichlorobenzènes, et trichlorobenzènes. Les principaux composés inorganiques comprennent HCl, Cl 2 O, HOCl, NaClO 3, les isocyanurates chlorés, AlCl 3, SiCl 4, SnCl 4, PCl 3, PCl 5, POCl 3, AsCl 3, SbCl 3, SbCl 5, BiCl 3, S 2 Cl 2, SCl 2, SOCI 2, CIF 3, ICl, ICl 3, TiCl 3, TiCl 4, MoCl 5, FeCl 3, ZnCl 2, etc.
L'hygiène publique, la désinfection et antisepsie
La lutte contre la putréfaction

En France (comme ailleurs) il y avait une nécessité de traiter viscères d'animaux afin de rendre cordes d'instruments de musique, Baudruches et d'autres produits. Ceci a été réalisé dans des "usines de gut" (de boyauderies) comme une entreprise odiferous et malsain. Ou vers 1820, le Société d'encouragement Pour L'industrie nationale a offert un prix pour la découverte d'une méthode, chimique ou mécanique, qui pourrait être utilisé pour séparer la membrane péritonéale des intestins d'animaux sans causer la putréfaction. Il a été remporté par Antoine-Germain Labarraque, un de 44 ans chimiste et pharmacien français qui avait découvert que les solutions de blanchiment chlorés de Berthollet (" Eau de Javel ») non seulement détruit l'odeur de la putréfaction de la décomposition des tissus animaux, mais aussi retardé le processus de décomposition lui-même.
La recherche de Labarraque entraîné chlorures et hypochlorites de chaux ( l'hypochlorite de calcium) et de sodium ( l'hypochlorite de sodium) étant utilisé non seulement dans les boyauderies mais également pour la désinfection et la désodorisation de routine latrines, les égouts, les marchés, abattoirs, théâtres et les morgues anatomiques. Ils ont également été utilisés, avec succès, dans les hôpitaux, lazarets, les prisons, les infirmeries (à la fois sur terre et en mer), magnaneries, écuries, étables, etc .; et pour exhumations, embaumement, pendant les flambées de maladie épidémique, la fièvre, Jambe noire (la maladie) chez les bovins, etc.
Contre l'infection et de contagion
Solutions de chaux et de la soude chlorés de LABARRAQUE avaient été préconisée en 1828 pour prévenir l'infection (appelée «infection contagieuse", et présumé être transmis par " miasmes ») et aussi à traiter putréfaction des blessures existantes, y compris les plaies septiques. Dans ce travail 1828, Labarraque recommandé pour le médecin de respirer chlore, se laver les mains avec de la chaux chlorée, et même saupoudrer chlorure de chaux sur le lit du patient, en cas de "infection contagieuse." En 1828, il était bien connu que certaines infections étaient contagieux, même si l'agence du microbe ne devait pas être réalisé ou découvert pendant plus d'un demi-siècle.
Pendant le Paris épidémie de choléra de 1832, de grandes quantités de ce qu'on appelle le chlorure de chaux ont été utilisés pour désinfecter la capitale. Ce ne était pas simplement moderne chlorure de calcium , mais contient du chlore gazeux dissous dans l'eau de chaux (dilué l'hydroxyde de calcium) pour former l'hypochlorite de calcium (chaux chlorée). La découverte de Labarraque aidé à retirer la terrible odeur de pourriture des hôpitaux et des salles de dissection, et, ce faisant, efficace désodorisé la Quartier Latin de Paris. Ces miasmes putrides "" étaient considérés par beaucoup comme responsable de la propagation de «contagion» et «infection» - deux mots utilisés avant la théorie des germes de l'infection. L'utilisation de chlorure de chaux a été basé sur la destruction des odeurs et «matière putride." Une source a affirmé que le chlorure de chaux a été utilisé par le Dr John Snow pour désinfecter l'eau du choléra contaminés puits alimentant la pompe de Broad Street en 1854 à Londres. Trois sources fiables qui décrivaient la célèbre Broad Street pompe épidémie de choléra ne mentionnent pas de neige d'effectuer toute désinfection de l'eau de ce puits. Au lieu de cela, une référence, il est clair que le chlorure de chaux a été utilisé pour désinfecter la abats et la saleté dans les rues environnantes la pompe une pratique courante Broad Street à la mi-Angleterre du XIXe siècle.
Semmelweis et expériences avec l'antisepsie
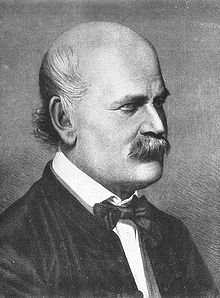
Peut-être le plus célèbre application de la chlore et de Labarraque solutions chimiques de base était en 1847, lorsque Ignaz Semmelweis utilisé (premier) de chlore dans l'eau (tout simplement chlore dissous dans l'eau pure), des solutions de chlorure de chaux, puis moins chers, pour désodoriser les mains des médecins autrichiens, qui Semmelweis remarqué portais toujours la puanteur de la décomposition des salles de dissection aux salles d'examen des patients . Semmelweis, encore long avant que la théorie des germes de la maladie, avait émis l'hypothèse que "particules cadavériques» ont été en quelque sorte transmettent décomposition des cadavres médicaux frais aux patients vivant, et il a utilisé les "solutions de LABARRAQUE" bien connus comme la seule méthode connue pour enlever l'odeur de décadence et de décomposition des tissus (qui il a trouvé que le savon n'a pas fait). Les solutions se sont avérées antiseptiques germicides beaucoup plus efficaces que le savon (Semmelweis était aussi conscient de leur plus grande efficacité, mais pas la raison), ce qui a entraîné dans de Semmelweis (plus tard) a célébré le succès dans l'arrêt de la transmission de la fièvre puerpérale ("de la fièvre puerpérale") dans les maternités de Hôpital général de Vienne en Autriche en 1847.
Beaucoup plus tard, au cours de la Première Guerre mondiale en 1916, une modification standardisée et diluée de la solution de Labarraque, contenant de l'hypochlorite (0,5%) et de l'acide borique en tant que stabilisant acide, a été développé par Henry Drysdale Dakin (qui a donné tout le crédit au travail préalable de Labarraque dans ce domaine). Appelé La solution de Dakin, le procédé de l'irrigation de la plaie avec des solutions chlorées a permis un traitement antiseptique d'une grande variété de plaies ouvertes, bien avant l'ère moderne antibiotique. Une version modifiée de cette solution continue d'être employé dans l'irrigation des plaies à l'époque moderne, où il reste efficace contre les bactéries résistantes aux antibiotiques se multiplient (voir Century Pharmaceuticals).
Assainissement public
En 1918, le US Department of Treasury appelé à toute l'eau potable à désinfecter avec du chlore. Le chlore est un produit chimique important actuellement pour la purification de l'eau (tels que des usines de traitement d'eau), en désinfectants, et l'eau de Javel. Le chlore dans l'eau est plus de trois fois plus efficace comme désinfectant contre Escherichia coli à une concentration équivalente de brome , et est plus de six fois plus efficace que la concentration équivalente d' iode .
Le chlore est généralement utilisé (sous la forme de acide hypochloreux) pour tuer les bactéries et d'autres microbes dans l'eau potable et fournitures piscines publiques. Dans la plupart des piscines privées, chlore lui-même ne est pas utilisé, mais plutôt l'hypochlorite de sodium, formé à partir de chlore et de l'hydroxyde de sodium , ou des comprimés solides de isocyanurates chlorés. L'inconvénient de l'utilisation du chlore dans les piscines est que le chlore réagit avec les cheveux et la peau d'un être humain parce que les cheveux et la peau sont faits de protéines. (Réaction avec des groupes amino de protéine) Même les petites réserves d'eau sont maintenant systématiquement chlorée.
Il est souvent impossible de stocker et d'utiliser du chlore gazeux toxique pour le traitement de l'eau, de sorte que d'autres méthodes de l'ajout de chlore sont utilisés. Il se agit notamment des solutions d'hypochlorite, qui libèrent progressivement le chlore dans l'eau, et des composés tels que sodium dichloro-s-triazinetrione (dihydrate ou anhydre), parfois appelée "dichlorure", et , triazinetrione-trichloro-s parfois appelé "trichlore". Ces composés sont stables tandis solide et peuvent être utilisés sous forme de poudre, en granulés ou sous forme de comprimés. Lorsqu'il est ajouté en petites quantités à l'eau de piscine ou de systèmes d'eau industriels, des atomes de chlore hydrolysent par rapport au reste de la molécule formant de l'acide hypochloreux (HOCl), qui agit comme un biocide général, tuant les germes, les micro-organismes, des algues et ainsi de suite.
Utiliser comme une arme
Première Guerre Mondiale
Le gaz de chlore, également connu comme bertholite, a été le premier utilisé comme une arme dans la Première Guerre mondiale par l'Allemagne le 22 Avril 1915 à la Deuxième bataille d'Ypres. Comme décrit par les soldats qu'il avait une odeur caractéristique d'un mélange entre le poivre et l'ananas. Il a également goûté métallique et piqué l'arrière de la gorge et la poitrine. Le chlore peut réagir avec l'eau dans la muqueuse des poumons pour former de l'acide chlorhydrique , un irritant qui peut être mortel. Les dommages causés par le chlore gazeux peut être empêchée par un masque à gaz, ou une autre méthode de filtration, ce qui rend le risque global de décès par le chlore gazeux beaucoup plus faible que celles des autres armes chimiques. Il a été lancé par un scientifique allemand tard d'être un lauréat du prix Nobel, Fritz Haber de l'Institut Kaiser Wilhelm à Berlin, en collaboration avec le conglomérat chimique allemande IG Farben, qui a développé des méthodes pour décharger le gaz de chlore contre un ennemi retranché. Il est allégué que le rôle de Haber dans l'utilisation du chlore comme une arme mortelle a conduit sa femme, Clara Immerwahr, au suicide. Après la première utilisation, le chlore a été utilisé par les deux parties comme une arme chimique, mais il a rapidement été remplacé par le plus mortel phosgène et gaz moutarde.
Guerre en Irak
Le gaz de chlore a également été utilisé par des insurgés contre la population et de la coalition des forces locales dans la guerre en Irak sous la forme de bombes de chlore. Le 17 Mars 2007, par exemple, trois camions de chlore remplis ont explosé dans la province d'Anbar tuant deux personnes et écœurante sur 350. D'autres attentats à la bombe de chlore a entraîné une augmentation des frais de la mort, avec plus de 30 morts à deux reprises. La plupart des décès ont été causés par la force des explosions plutôt que les effets du chlore, car le gaz toxique est facilement dispersé et dilué dans l'atmosphère par l'explosion. Les autorités irakiennes ont renforcé la sécurité pour le chlore élémentaire, qui est essentiel pour fournir de l'eau potable pour la population.
Chlore fissuration induite dans les matériaux structurels

L'élément est largement utilisé pour purifier l'eau grâce à ses puissantes propriétés oxydantes, l'approvisionnement en eau potable et en particulier de l'eau utilisée dans les piscines. Plusieurs effondrements catastrophiques de plafonds de piscines ont eu lieu en raison de la fissuration par corrosion des tiges d'acier inoxydable utilisés pour les suspendre. Certains polymères sont également sensibles à l'attaque, y compris résine acétal et polybutène. Les deux matériaux ont été utilisés dans les fournitures domestiques eau chaude et froide, et fissures de corrosion provoqués échecs répandus aux Etats-Unis dans les années 1980 et 1990. L'image de droite montre un joint acétal dans un système d'approvisionnement en eau, qui, quand il est fracturé, a causé un préjudice matériel important aux ordinateurs dans les laboratoires ci-dessous l'offre. Les fissures ont commencé à injection défauts de moulage dans l'articulation et ont progressé lentement jusqu'à ce que finalement déclenché. La surface de rupture montre des sels de fer et de calcium qui ont été déposées dans l'articulation de la fuite de l'alimentation en eau avant l'échec.
Effets sur la santé de l'élément libre et dangers
| NFPA 704 |
|---|
 0 3 0 OX |
Le chlore est un gaz toxique qui irrite le système respiratoire. Parce qu'il est plus lourd que l'air, il a tendance à s'accumuler au fond des espaces mal ventilés. gaz de chlore est un oxydant puissant, qui peut réagir avec des matières inflammables.
Le chlore est détectable avec des appareils de mesure des concentrations aussi faibles que 0,2 parties par million (ppm), et par l'odorat à 3 ppm. La toux et vomissements peuvent survenir à 30 ppm et une lésion pulmonaire à 60 ppm. A propos de 1000 ppm peut être mortelle après quelques respirations profondes du gaz. Respirer des concentrations plus faibles peut aggraver le système respiratoire, et l'exposition au gaz peut irriter les yeux. La toxicité du chlore vient de son pouvoir oxydant. Lorsque le chlore est inhalé à des concentrations supérieures à 30 ppm, il commence à réagir avec l'eau et les cellules, qui changent dans de l'acide chlorhydrique (HCl) et l'acide hypochloreux (HClO).
Lorsqu'il est utilisé à des niveaux spécifiés pour la désinfection de l'eau, la réaction du chlore avec de l'eau ne sont pas une préoccupation majeure pour la santé humaine. D'autres matériaux présents dans l'eau peuvent générer des-produits de désinfection qui sont associés à des effets négatifs sur la santé humaine, bien que le risque pour la santé est beaucoup plus faible que l'eau potable undisinfected.
Composés organochlorés comme polutants
Certains composés organochlorés sont des polluants graves. Ces produits sont fabriqués soit en tant que produits secondaires de procédés industriels ou des produits finis qui sont persistants dans l'environnement, tels que certains pesticides chlorés et les chlorofluorocarbones. Le chlore est ajouté à la fois pour les pesticides et les produits pharmaceutiques pour rendre les molécules plus résistants à la dégradation enzymatique par des bactéries, des insectes et les mammifères, mais cette propriété a aussi pour effet de prolonger le temps de séjour de ces composés quand ils pénètrent dans l'environnement. À cet égard organiques chlorés ont une certaine ressemblance avec organiques fluorés.

