
La fijación de nitrógeno
Antecedentes
Organizar una selección Wikipedia para las escuelas en el mundo en desarrollo sin acceso a Internet era una iniciativa de SOS Children. Para comparar obras de caridad de patrocinio este es el mejor vínculo de patrocinio .
La fijación de nitrógeno es el proceso por el cual el nitrógeno se toma de su forma molecular natural, relativamente inerte (N 2) en la atmósfera y se convierte en compuestos de nitrógeno (tales como amoniaco , nitrato y dioxido de nitrogeno).
La fijación de nitrógeno se lleva a cabo de forma natural por un número de diferentes procariotas, incluyendo bacterias , Actinobacteria, y ciertos tipos de bacterias anaerobias. Los microorganismos que fijan el nitrógeno se denominan diazótrofos. Algunas plantas superiores, y algunos animales ( termitas ), han formado asociaciones con diazótrofos.
La fijación de nitrógeno también se produce como resultado de los procesos no biológicos. Estos incluyen el rayo, industrialmente a través de la Proceso de Haber-Bosch, y la combustión.
Fijación biológica del nitrógeno fue descubierta por el microbiólogo holandés Martinus Beijerinck.
Fijación biológica del nitrógeno

Fijación Biológica de Nitrógeno (BNF) se produce cuando el nitrógeno atmosférico se convierte en amoniaco por un par de enzimas bacterianas llamada nitrogenasa. La fórmula para BNF es:
- N2 + 8H + + 8e - + 16 ATP → 2NH 3 + H 2 + 16 ADP + 16 P i
Aunque el amoníaco (NH 3) es el producto directo de esta reacción, es rápidamente protonado en amonio (NH 4 +). En diazótrofos de vida libre, el amonio nitrogenasa generados se asimila en glutamato a través de la vía de la sintasa de glutamina sintetasa / glutamato.
En la mayoría de las bacterias, las enzimas nitrogenasa son muy susceptibles a la destrucción por el oxígeno (y muchas bacterias cesar la producción de la enzima en presencia de oxígeno). Baja tensión de oxígeno se logra por diferentes bacterias por: viviendo en condiciones anaeróbicas, que respiran para dibujar abajo los niveles de oxígeno, o la unión del oxígeno con una proteína tal como Leghemoglobina - también deletreado leghemoglobina ..
Las plantas más conocidas que contribuyen a la fijación de nitrógeno en la naturaleza, están en el familia de las leguminosas - Fabaceae, que incluye tales como taxones trébol, habas, alfalfa, altramuces y cacahuetes. Contienen bacterias simbióticas llamadas rizobios dentro nódulos en su sistemas de raíces, produciendo compuestos de nitrógeno que ayudan a la planta a crecer y competir con otras plantas. Cuando la planta muere, el nitrógeno fijado se libera, ponerla a disposición de otras plantas y esto ayuda a fertilizar el suelo La gran mayoría de las legumbres tiene esta asociación, pero algunos géneros (por ejemplo, Styphnolobium) no lo hacen. En muchas de las prácticas agrícolas tradicionales y orgánicos, los campos se giran a través de diversos tipos de cultivos, que por lo general incluye una consistente principalmente o enteramente de trébol o alforfón (familia Polygonaceae), que se refiere a menudo como "abono verde", ya que la otra forma natural de la adición de nitrógeno al suelo es a través de los productos de desecho animal. La planta entera se ara a menudo de nuevo en el campo, por lo que no sólo añadir más nitrógeno, sino también mejorar el contenido y el volumen orgánica del suelo.
Plantas fijadoras de nitrógeno no leguminosos


Aunque la gran mayoría de las plantas fijadoras de nitrógeno están en la familia de las leguminosas Fabaceae, hay algunas plantas no leguminosas, que también puede fijar el nitrógeno. Estas plantas, denominadas plantas actinorrícicas, consisten en 22 géneros de arbustos leñosos o árboles dispersos en 8 familias de plantas. La capacidad de fijar el nitrógeno no es universalmente presente en estas familias. Por ejemplo, de 122 géneros en el Rosaceae, sólo 4 géneros son capaces de fijar el nitrógeno.
Familia: Genera
Betulaceae (Abedul): Alnus (Alder)
Cannabaceae: Trema
Casuarinaceae (ella-robles):
- Allocasuarina
- Casuarina
- Gymnostoma
Coriariaceae: Coriaria
Datiscaceae: Datiscaceae
Elaeagnaceae (acebuche):
- Elaeagnus (silverberry)
- Hippophae (espino cerval de mar)
- Shepherdia (buffaloberries)
Myricaceae:
- Morella arborea
- Myrica
- Comptonia
Rhamnaceae (espino amarillo):
- Ceanothus
- Colletia
- Discaria
- Kentrothamnus
- Retanilla
- Trevoa
Rosaceae (rosa):
- Cercocarpus (caoba de montaña)
- Chamaebatia (miseria montaña)
- Purshia (bitterbrush o acantilado-rosa)
- Dryas
También hay varias asociaciones simbióticas fijadoras de nitrógeno que involucran cianobacterias (como Nostoc). Estos incluyen algunos líquenes como Lobaria y Peltigera:
- Helecho mosquito ( Especies de Azolla)
- Las cícadas
- Gunnera
Los microorganismos que fijan el nitrógeno
- Diazótrofos
- Las cianobacterias
- Azotobacteraceae
- Rhizobia
- Frankia
Fijación de Nitrógeno por cianobacterias
Las cianobacterias habitan en casi todos los ambientes iluminados en la Tierra y desempeñan un papel clave en el carbono y el ciclo del nitrógeno de la biosfera . Generalmente, cianobacterias son capaces de utilizar una variedad de fuentes inorgánicas y orgánicas de nitrógeno combinado, como el nitrato , nitrito, de amonio, urea o algunos aminoácidos . Varias cepas de cianobacterias también son capaces de crecimiento diazotróficas. La secuenciación del genoma ha proporcionado una gran cantidad de información sobre la base genética de metabolismo del nitrógeno y su control en diferentes cianobacterias. Genómica comparativa, junto con los estudios funcionales, ha conducido a un avance significativo en este campo en los últimos años. 2-oxoglutarato ha resultado ser la molécula de señalización central de que refleja el balance de carbono / nitrógeno de cianobacterias. Jugadores centrales de control de nitrógeno son el factor transcripcional mundial NtcA, que controla la expresión de muchos genes implicados en el metabolismo del nitrógeno, así como la proteína de señalización P II, que las actividades en detalle los celulares en respuesta a las cambiantes condiciones de C / N. Estas dos proteínas son sensores del celular nivel 2-oxoglutarato y se han conservado en todas las cianobacterias. En contraste, la adaptación a la inanición de nitrógeno implica respuestas heterogéneas en diferentes cepas.
La fijación de nitrógeno químico
El nitrógeno también se puede fijar artificialmente para su uso en fertilizantes , explosivos, o en otros productos. El método más popular es por el Proceso de Haber. Esta producción de fertilizantes artificiales ha alcanzado tal magnitud que ahora es la mayor fuente de nitrógeno fijado en la Tierra 's ecosistema.
El proceso Haber requiere altas presiones y temperaturas muy elevadas y la investigación activa está comprometida con el desarrollo de sistemas de catalizadores que convierten el nitrógeno en amoníaco a temperatura ambiente. Muchos compuestos pueden reaccionar con el nitrógeno atmosférico en condiciones ambientales (por ejemplo, litio hace nitruro de litio si se deja expuesto), pero los productos de tales reacciones no se convierten fácilmente en fuentes de nitrógeno biológicamente accesibles. Después de la primera dinitrógeno complejo fue descubierto en 1965 basado en amoniaco coordinado de rutenio ([Ru (NH 3) 5 (N 2)] 2+), la investigación en la fijación química centrado en complejos de metales de transición. Desde entonces un gran número de compuestos de metales de transición que contienen como ligando de dinitrógeno se han descubierto. El ligando de dinitrógeno se puede unir ya sea a una sola de dos (o más) de metal o metales puente. La química de coordinación de dinitrógeno es rico y bajo intenso estudio. Esta investigación puede conducir a nuevas formas de utilización de dinitrógeno en síntesis y en escala industrial.
El primer ejemplo de ruptura homolítica de dinitrógeno en condiciones suaves se publicó en 1995. Dos equivalentes de una molibdeno complejo se hace reaccionar con un equivalente de dinitrógeno, creando una complejo LUN unida triple. Desde este complejo delimitada Triple se ha utilizado para hacer nitrilos. El primer sistema catalítico de conversión de nitrógeno a amoniaco a temperatura ambiente y 1 atmósfera fue descubierto en 2003 y se basa en otro compuesto de molibdeno, una fuente de protones y un fuerte agente reductor. Desafortunadamente, la reducción catalítica sólo se somete a unas pocas pérdidas de balón antes de que muera el catalizador.
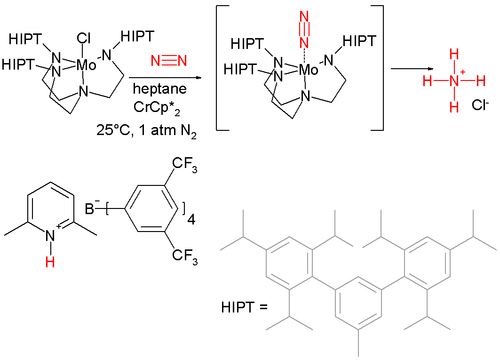
En contraste con el gráfico se muestra arriba, el principal producto de esta reacción es el amoníaco (NH3) y no una sal de amonio ([NH4] [X]). De hecho, aproximadamente el 75% del amoniaco producido se puede separó por destilación del recipiente de reacción (lo que sugiere el amoníaco no es protonada) en un recipiente que contiene HCl como una trampa. Este método de atrapar el NH3 se eligió porque, sin duda, hace que el producto sea más fácil de manejar. Además, observe que debido a que sólo 1 equiv de Cl anión está disponible bajo condiciones catalíticas (a través de la reducción del cloruro de molbdenum precatalizador, que se muestra), por lo tanto es poco probable que la sal de amonio del producto siempre tendría este contraión.
Tenga en cuenta también que aunque el complejo de dinitrógeno se muestra entre paréntesis esta especie pueden ser aislados y caracterizados. Aquí los soportes no indican que el intermediario no se observa.

