
Rutenio
Acerca de este escuelas selección Wikipedia
SOS ofrecen una descarga completa de esta selección de escuelas para su uso en escuelas intranets. Para comparar obras de caridad de patrocinio este es el mejor vínculo de patrocinio .
| Rutenio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
44 Ru | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
metálico blanco plateado  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | rutenio, Ru, 44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / r U θ yo n yo ə m / Roo- TI -nee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría Elemento | metal de transición | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 8, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 101.07 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Kr ] 4d 7 5s 1 2, 8, 18, 15, 1 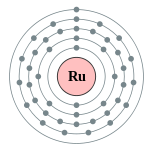 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Jędrzej Śniadecki (1807) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Jędrzej Śniadecki (1807) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reconocido como un distinto elemento por | Karl Ernst Claus (1844) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 12,45 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 10,65 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 2607 K , 2334 ° C, 4233 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 4423 K, 4150 ° C, 7502 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 38.59 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 591.6 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 24.06 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 8, 7, 6, 4, 3, 2, 1, -2 (Levemente ácida óxido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,2 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 710.2 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1620 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 2747 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 134 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 146 ± 19:00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal compacta | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (0 ° C) 71 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 117 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 6,4 micras · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 5970 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El módulo de Young | 447 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de corte | 173 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 220 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relación de Poisson | 0.30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 6.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 2160 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-18-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de rutenio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El rutenio es un elemento químico con el símbolo de Ru y número atómico 44. Es un raro metal de transición perteneciente a la grupo del platino de la tabla periódica . Como los otros metales del grupo del platino, rutenio es inerte a la mayoría de productos químicos. La Báltico científico alemán Karl Ernst Claus descubrió el elemento en 1844 y la llamó después Rutenia, la palabra latina para Rus '. Rutenio generalmente ocurre como un componente menor de platino minerales y su producción anual es de sólo 20 toneladas. La mayoría de rutenio se utiliza para contactos eléctricos resistentes al desgaste y la producción de resistencias de película gruesa. Una aplicación menor de rutenio es su uso en algunos de platino aleaciones.
Características
Propiedades físicas

Un metal blanco duro polivalente, rutenio es un miembro de la grupo del platino y está en grupo 8 de la tabla periódica:
| Z | Elemento | No. de electrones / shell |
|---|---|---|
| 26 | hierro | 2, 8, 14, 2 |
| 44 | rutenio | 2, 8, 18, 15, 1 |
| 76 | osmio | 2, 8, 18, 32, 14, 2 |
| 108 | hassio | 2, 8, 18, 32, 32, 14, 2 |
Sin embargo, tiene una configuración atípica en sus capas de electrones más externos: mientras que el resto del grupo 8 elementos tienen 2 electrones en la capa más externa, en rutenio, uno de los que se transfiere a una cubierta inferior. Este efecto se puede observar en los metales vecinos de niobio (41), rodio (45), y paladio (46).
Rutenio tiene cuatro modificaciones de cristal y no se empaña a temperaturas normales. Rutenio disuelve en álcalis fundidos, no es atacado por los ácidos pero es atacado por los halógenos a altas temperaturas. Pequeñas cantidades de rutenio pueden aumentar la dureza de platino y paladio . La corrosión resistencia del titanio está notablemente aumentada por la adición de una pequeña cantidad de rutenio.
Este metal puede ser plateado ya sea por galvanoplastia o por métodos de descomposición térmica. A rutenio de molibdeno de la aleación es conocido por ser superconductores a temperaturas inferiores a 10,6 K .
Isótopos
Naturalmente rutenio que ocurre está integrada por siete estables isótopos . Además, 34 isótopos radiactivos se han descubierto. De estos radioisótopos, los más estables son 106 Ru con una vida media de 373,59 días, 103 Ru con una vida media de 39,26 días y 97 Ru con una vida media de 2,9 días.
Otros quince radioisótopos se han caracterizado con pesos atómicos que van desde 89,93 u (90 Ru) a 114.928 u (115 Ru). La mayoría de estos tienen vidas medias que son menos de cinco minutos, excepto 95 Ru (vida media: 1,643 horas) y 105 Ru (vida media: 4,44 horas).
El primario modo de decaimiento antes del isótopo más abundante, 102 Ru, es captura de electrones y el modo primario después de que se emisión beta. El primario producto de la desintegración antes de 102 Ru es tecnecio y el modo primario después es el rodio .
Aparición
El rutenio es extremadamente rara, sólo la 74ª metal más abundante en la Tierra. Este elemento se encuentra generalmente en los minerales con los otros metales del grupo del platino en la Montes Urales y en Norte y Sur América. Las cantidades pequeñas pero importantes para el comercio también se encuentran en pentlandita extraído de Sudbury, Ontario, Canadá , y en depósitos piroxenita en Sudáfrica . La forma natural de rutenio es un mineral muy raro (Ir reemplaza parte de Ru en su estructura).
Producción
Minería
Aproximadamente 12 toneladas de rutenio se extraen cada año con las reservas mundiales estimadas como 5.000 toneladas. La composición de las mezclas extraído metal del grupo del platino (PGM) varía en un amplio intervalo dependiendo de la formación geoquímica. Por ejemplo, los MGP minadas en Sudáfrica contienen en promedio 11% de rutenio, mientras que los MGP minadas en la antigua URSS contienen sólo el 2% basado en la investigación que data de 1992.
Rutenio, como los otros metales del grupo del platino, se obtiene comercialmente como un subproducto del níquel y cobre minería y procesamiento, así como por el procesamiento de minerales de metales del grupo del platino. Durante electrolítico de cobre y níquel, metales nobles tales como plata, oro y los metales del grupo del platino se depositan en el fondo de la celda de ánodo como el barro, que forma el punto de partida para su extracción. Para separar los metales, que primero deben ser llevados a la solución. Varios métodos están disponibles dependiendo del proceso de separación y la composición de la mezcla; dos métodos representativos son la fusión con peróxido de sodio seguido por disolución en agua regia, y la disolución en una mezcla de cloro con ácido clorhídrico . Osmio, rutenio, rodio e iridio se pueden separar de platino y oro y metales básicos por su insolubilidad en agua regia, dejando un residuo sólido. El rodio se puede separar a partir del residuo mediante tratamiento con bisulfato de sodio fundido. El residuo insoluble, que contiene Ru, Os e Ir se trata con óxido de sodio, en el que Ir es insoluble, la producción de sales de Ru y Os solubles en agua. Después de la oxidación de los óxidos volátiles, RuO 4 se separa de OsO4 por precipitación de (NH 4) 3 RuCl 6 con cloruro de amonio o por destilación o extracción con disolventes orgánicos de la tetróxido de osmio volátiles. El hidrógeno se usa para reducir cloruro de rutenio de amonio, produciendo un polvo. El primer método para precipitar el rutenio con cloruro de amonio es similar al procedimiento que Smithson Tennant y William Hyde Wollaston utiliza para su separación. Varios métodos son adecuados para la producción a escala industrial. En cualquier caso, el producto se reduce utilizando hidrógeno, dando el metal como un polvo o una esponja que puede ser tratada usando técnicas de metalurgia de polvos o de argón - soldadura por arco.
A partir de combustibles nucleares usados
Los productos de fisión de uranio-235 contiene cantidades significativas de rutenio y de los metales del grupo del platino más ligeros y por lo tanto combustible nuclear usado podría ser una posible fuente de rutenio. La extracción es costosa y complicada los isótopos radiactivos de rutenio que están presentes haría de almacenamiento para varias vidas medias de los isótopos en descomposición necesarias. Esto hace que esta fuente de rutenio poco atractivo y no la extracción a gran escala se ha iniciado.
Los compuestos químicos
Los estados de oxidación de la gama de rutenio 0-8, y -2. Las propiedades de rutenio y osmio compuestos suelen ser similares. Los 2, 3, y 4 estados son los más comunes. El precursor es más prevalente tricloruro de rutenio, un sólido rojo que está mal definido químicamente pero versátil sintéticamente.
Óxidos
El rutenio puede ser oxidado a rutenio (IV) óxido (RuO 2, estado de oxidación 4), que a su vez puede ser oxidado por el metaperyodato de sodio para tetróxido de rutenio, RuO 4, un agente oxidante fuerte, con estructura y propiedades análogas a tetróxido de osmio. Como tetróxido de osmio, tetróxido de rutenio es un fijador potente y de la mancha para microscopía electrónica de materiales orgánicos, y se utiliza sobre todo para revelar la estructura de las muestras de polímero. Rutenato dipotásico (K 2 RuO 4, 6), y perrutenato potasio (Kruo 4, 7) también se conocen.
Complejos de coordinación y organometálicos

Rutenio forma una variedad de complejos de coordinación. Ejemplos de ello son los muchos derivados pentammine [Ru (NH 3) 5 L] n + que a menudo existe en tanto Ru (II) y Ru (III). Los derivados de bipiridina y terpiridina son numerosos, el más conocido es el luminiscente tris (bipiridina) rutenio (II) cloruro.
Rutenio formar una amplia gama compuestos con enlaces carbono-rutenio. Rutenoceno es análoga a la del ferroceno, estructuralmente, pero exhibe propiedades distintivas redox. Un gran número de complejos de monóxido de carbono son conocidos, siendo el padre dodecacarbonilo triruthenium. El análogo de pentacarbonilo de hierro, rutenio pentacarbonilo es inestable en condiciones ambientales. Tricloruro de rutenio carbonylates (reacciona con monóxido de carbono) para dar mono- y diruthenium (II) carbonilos de la que muchos derivados han sido preparados como RuHCl (CO) (PPh3) 3 y Ru (CO) 2 (PPh3) 3 ( Complejo de Roper). Soluciones de calefacción de tricloruro de rutenio en alcoholes con trifenilfosfina da tris (trifenilfosfina) rutenio (RuCl 2 (PPh 3 3)), que convierte a la rutenio chlorohydridotris complejo de hidruro (trifenilfosfina) (II) (RuHCl (PPh3) 3).
En el área de la síntesis química fina, Catalizador de Grubbs 'se utiliza para la metátesis de alquenos.
Ruthenides
Ruthenides metálicas (Ru 2-) son muy raros, pero se encuentran comúnmente en aplicaciones de superconductores, especialmente en relación con los lantánidos metales por ejemplo cerio ruthenide (Ceru 2).
Historia
Aunque de origen natural aleaciones de platino que contienen los seis metales del grupo del platino se utilizaron durante mucho tiempo por precolombina estadounidenses y conocido como un material para los químicos europeos desde mediados del siglo 16, hubo que esperar hasta la mitad del siglo 18 para el platino a ser identificado como un elemento puro. El descubrimiento de que el platino naturales contenía paladio, rodio, osmio e iridio se produjo en la primera década del siglo 19. Platino en arenas aluviales de los ríos rusos daban acceso a la materia prima para su uso en placas y medallas y para la acuñación de rublos monedas , a partir de 1828. Los residuos de la producción de platino para acuñar estaban disponibles en el Imperio Ruso, y por lo tanto la mayor parte de la investigación sobre ellos se hizo en Europa del Este.
Es posible que el polaco químico Elemento aislado Jędrzej Śniadecki 44 (que él llamó "vestium") a partir de minerales de platino en 1807. Publicó su descubrimiento en lengua polaca en el artículo "Rosprawa o nowym fáb w surowey platynie odkrytym" en 1808. Su obra nunca fue confirmado, sin embargo, y que más tarde retiró su demanda de descubrimiento. Jöns Berzelius y Gottfried Osann casi descubrió rutenio en 1827. Examinaron los residuos que quedaron después de la disolución de platino crudo de la Montes Urales en agua regia. Berzelius no encontró metales poco comunes, pero Osann pensó que encontró tres nuevos metales, pluranium, rutenio y polinium. Esta discrepancia llevó a una larga controversia entre Berzelius y Osann sobre la composición de los residuos.
En 1844, la Báltico científico alemán Karl Ernst Claus mostró que los compuestos preparados por Gottfried Osann contenía pequeñas cantidades de rutenio, que tenía Claus descubierto el mismo año. Noel aislado rutenio partir de los residuos de platino de la producción rublo mientras trabajaba en Universidad de Kazan, Kazan. Claus mostró que contenía óxido de rutenio un nuevo metal y obtuvo 6 gramos de rutenio de la parte de platino crudo que es insoluble en agua regia.
El nombre deriva de Rutenia, la palabra latina para Rus ', una zona histórica que incluye occidental actual Rusia , Ucrania , Bielorrusia , y partes de Eslovaquia y Polonia . Noel usa el nombre propuesto por Gottfried Osann en 1828. Él eligió el nombre del elemento en honor de su birthland, ya que nació en Tartu, Estonia , que era en ese momento una parte del Imperio Ruso .
Aplicaciones
Debido a su capacidad para endurecer el platino y el paladio, rutenio se utiliza en aleaciones de platino y paladio para hacer resistente al desgaste contactos eléctricos. En esta aplicación, las películas sólo plateado delgado se utilizan para lograr la resistencia al desgaste es necesario. Debido a su menor coste y propiedades similares en comparación con el rodio, el uso como material de chapado para contactos eléctricos es una de las principales aplicaciones. Los recubrimientos delgados se aplican ya sea por galvanoplastia o pulverización catódica.
Dióxido de rutenio y el plomo y bismuto rutenatos se utilizan en resistencias en chip de película gruesa. Estas dos aplicaciones electrónicas representan el 50% del consumo de rutenio.
Sólo unas pocas aleaciones de rutenio se utilizan distintos de aquellos con otros metales del grupo del platino. Rutenio se utiliza a menudo en pequeñas cantidades en las aleaciones para mejorar algunas de sus propiedades. El efecto beneficioso sobre la resistencia a la corrosión del titanio aleaciones condujo al desarrollo de una aleación especial que contiene 0,1% de rutenio. Rutenio también se utiliza en algunas avanzado de alta temperatura de monocristales superaleaciones, con aplicaciones que incluyen los álabes de la turbina de los motores a reacción . Composiciones de superaleación a base de níquel Varios se describen en la literatura. Entre ellos se encuentran EPM-102 (con 3% de Ru) y TMS-162 (con 6% de Ru), así como TMS-138 y TMS-174. tanto que contiene 6% de renio . Plumillas Fontana se inclinan frecuentemente con aleaciones que contienen rutenio. Desde 1944 en adelante, la famosa Parker 51 estilográfica fue equipado con la punta "RU", un plumín de oro de 14K con punta con el 96,2% de rutenio y el 3,8% de iridio .
El rutenio es un componente de óxido mixto de metal (MMO) ánodos utilizados para la protección catódica de estructuras subterráneas y sumergidas, y para las células electrolíticas para procesos químicos, tales como la generación de cloro de agua salada. La la fluorescencia de algunos complejos de rutenio se apaga por el oxígeno, lo que ha llevado a su uso como sensores optodos de oxígeno. Rojo de rutenio, [(NH 3) 5 Ru-O-Ru (NH 3) 4 -O-Ru (NH 3) 5] 6+, es una mancha biológico utilizado para teñir moléculas polianiónicos tales como pectina y ácidos nucleicos para microscopía de luz y microscopía electrónica. El isótopo beta-descomposición 106 de rutenio se usa en la radioterapia de los tumores oculares, principalmente melanomas malignos de la úvea. Los complejos de rutenio centrado están siendo investigados por posibles propiedades anticancerígenas. En comparación con los complejos de platino, los de rutenio muestran mayor resistencia a la hidrólisis y una acción más selectiva en tumores. NAMI-A y KP1019 son dos fármacos sometidos a evaluación clínica contra los tumores metastásicos y los cánceres de colon.
Catálisis
El rutenio es un catalizador versátil. El sulfuro de hidrógeno se puede dividir por la luz mediante el uso de una suspensión acuosa de Partículas de CdS cargados con dióxido de rutenio. Esto puede ser útil en la eliminación de H 2 S en las refinerías de petróleo y otras instalaciones de procesamiento industrial. Rutenio organometálica carbeno y complejos de alquilideno se han encontrado para ser catalizadores altamente eficientes para metátesis de olefinas, un proceso con importantes aplicaciones en química orgánica y farmacéutica.
La conversión de energía solar
Algunos complejos de rutenio absorber la luz en todo el espectro visible y se están investigando activamente en varios,, potencial de energía solar tecnologías. Por ejemplo, compuestos basados en rutenio se han utilizado para la absorción de la luz en células solares sensibilizadas por colorante, un prometedor nuevo sistema de células solares de bajo costo.
Almacenamiento de datos
Deposición de vapor químico de rutenio se utiliza como un método para producir películas delgadas de rutenio pura sobre sustratos. Estas películas muestran propiedades prometedoras para el uso de microchips y de la gigante elemento de lectura magnetorresistivo para unidades de disco duro. Rutenio También se sugirió como posible material para microelectrónica ya que su uso es compatible con las técnicas de procesamiento de semiconductores.
Materiales exóticos
Muchos óxidos basados rutenio muestran propiedades muy inusuales, como un comportamiento cuántico punto crítico, exótico superconductividad , y alta temperatura ferromagnetismo.

