
Urea
Antecedentes
Los artículos de esta selección escuelas se han organizado por tema currículo gracias a voluntarios SOS. Haga clic aquí para obtener más información sobre SOS Children.
| Urea | |
|---|---|
 |  |
Diaminomethanal | |
Otros nombres Carbamida | |
| Identificadores | |
| CAS | 57-13-6 |
| Imágenes-Jmol 3D | Image 1 |
SONRISAS
|
|
| Propiedades | |
| Fórmula molecular | (NH 2) 2 CO |
| Masa molar | 60.07 g / mol |
| Apariencia | sólido blanco inodoro |
| Densidad | 1,33 · 10³ kg / m³, sólida |
| Punto de fusion | 132,7 ° C (406 K) |
| Punto de ebullicion | n / a |
| Solubilidad en agua | 108 g / 100 ml (20 ° C) 167 g / 100 ml (40 ° C) 251 g / 100 ml (60 ° C) 400 g / 100 ml (80 ° C) 733 g / 100 ml (100 ° C) |
| Acidez (p K a) | 26.9 |
| Basicidad (p K b) | 13.82 |
| Estructura | |
| Momento bipolar | 4.56 p / D |
| Peligros | |
| MSDS | ScienceLab.com |
| Principal peligros | Tóxico |
| NFPA 704 |  1 2 |
| Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
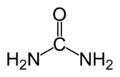
La urea es un compuesto orgánico con la fórmula química ( N H 2) 2 C O .
La urea es también conocido como carbamida, especialmente en el recomendado Denominaciones Comunes Internacionales (Rinn) en uso en Europa. Por ejemplo, la hidroxiurea compuesto medicinal (antiguo nombre aprobado británica) es ahora hidroxicarbamida. Otros nombres incluyen resina de carbamida, isourea, diamida carbónica, y carbonyldiamine.
Fue el primer compuesto orgánico que se sintetiza artificialmente a partir de materiales de partida inorgánicos, disipando así el concepto de vitalismo.
Descubrimiento
Fue el primer compuesto orgánico que se sintetiza artificialmente a partir de materiales de partida inorgánicos, en 1828 por Friedrich Wöhler, que lo preparó por la reacción de cianato de potasio con sulfato de amonio. Aunque Wöhler intentaba preparar cianato de amonio, mediante la formación de urea, sin darse cuenta, desacreditó vitalismo, la teoría de que los productos químicos de los organismos vivos son fundamentalmente diferentes de la materia inanimada, iniciando así la disciplina de la química orgánica .
Este descubrimiento impulsó Wöhler escribir triunfante a Berzelius:
"Debo decirles que puedo hacer urea sin el uso de los riñones, ya sea hombre o un perro. Cianato de amonio es urea."
Se encuentra en los mamíferos y anfibio orina, así como en algunos peces . Las aves y reptiles excretan ácido úrico, que comprende una forma diferente de nitrógeno metabolismo que requiere menos agua .
Estructura
La urea es altamente soluble en agua y es, por lo tanto, de una manera eficiente para el cuerpo humano para expulsar el exceso de nitrógeno. Debido a la extensa de enlaces de hidrógeno con agua (hasta seis enlaces de hidrógeno pueden formar - dos del átomo de oxígeno y uno de cada uno de hidrógeno), es muy soluble, y, por tanto, es también un buen fertilizante.
La molécula de urea es plana y retiene su punto completo simetría molecular, debido a la conjugación de uno de P de cada nitrógeno orbital al doble enlace carbonilo. Cada átomo de oxígeno carbonílico acepta cuatro enlaces de hidrógeno NHO, una característica muy inusual para un tipo de enlace tales. Esta densa (y energéticamente favorable) de la red de enlaces de hidrógeno se estableció probablemente a costa de empaquetamiento molecular eficiente: La estructura es bastante abierto, las cintas que forman túneles de sección cuadrada.
Fisiología
La producción endógena
Los átomos individuales que forman una molécula de urea proceden de dióxido de carbono , agua, aspartato, y amoníaco en una vía metabólica conocida como la ciclo de la urea, una proceso anabólico. Este gasto de energía es necesaria porque el amoníaco, un común producto de desecho metabólico, por su capacidad de elevar el pH, es tóxico y debe ser evitada. La urea es ni ácida ni básico y, por tanto, un vehículo perfecto para deshacerse de los residuos de nitrógeno. La producción de urea se produce en el hígado y está bajo el control regulador de N-acetilglutamato.
En este ciclo, amino grupos donados por amoniaco y L- aspartato se convierten en urea, mientras L- ornitina, citrulina, L- argininosuccinato, y L- acto arginina como intermedios.
Función
En los seres humanos
La urea es, en esencia, un producto de desecho. Sin embargo, también juega un papel muy importante ya que ayuda a establecer la sistema de contracorriente en las nefronas . El sistema en contracorriente en las nefronas permite la reabsorción de agua y los iones críticos. La urea se reabsorbe en el medular interior conductos colectores de las nefronas, elevando así la osmolaridad en el medular intersticio que rodea la rama ascendente de la delgada Asa de Henle. Cuanto mayor es la osmolaridad de la intersticio medular que rodea el asa ascendente delgada de Henle, más agua se reabsorbe fuera del túbulo renal de nuevo en el intersticio (y por tanto de nuevo en el cuerpo). Algunas de la urea de la intersticio medually que ayudó a establecer el Sistema Contracorriente también fluirá de nuevo en el túbulo, a través de urea transportador 2, en el extremidad delgada ascendente del asa de Henle, a través de los conductos colectores, y, finalmente, fuera del cuerpo como un componente de la orina.
Se disuelve en la sangre (en una concentración de 2.5 a 7.5 mmol / litro) y se excreta por el riñón como un componente de orina. Además, se excreta una pequeña cantidad de urea (junto con cloruro de sodio y agua) en sudar.
Regulación
Control de la urea por hormona antidiurética permite que el cuerpo para crear orina hyperosmotic (orina que tiene más iones en ella - es "más concentrado" - que la misma persona de el plasma sanguíneo). Prevención de la pérdida de agua de esta manera es importante si el cuerpo de la persona necesita para ahorrar agua con el fin de mantener una adecuada presión de la sangre o (más probablemente), a fin de mantener una concentración adecuada de sodio iones en el plasma sanguíneo.
Los no-humanos
La mayoría de los organismos tienen que tratar con la excreción de los residuos de nitrógeno procedente de la proteína y de aminoácidos catabolismo. En los organismos acuáticos la forma más común de residuos de nitrógeno es amoníaco, mientras que los organismos tierra-vivienda convierten el amoniaco tóxico para urea o acido urico. En general, las aves y saurios reptiles excretan ácido úrico, mientras que las restantes especies, incluyendo mamíferos , excretan urea. Es de destacar que renacuajos excretan amoniaco, y pasar a la producción de urea durante metamorfosis. En medicina veterinaria, Razas de perros dálmatas son dignos de mención en el que excretan nitrógeno en la forma de ácido úrico en la orina en lugar de en forma de urea. Esto es debido a un defecto en una de las genes que controlan la expresión de la conversión enzimas en el ciclo de la urea.
A pesar de la generalización anterior, la vía se ha documentado no sólo en los mamíferos y anfibios, pero en muchos otros organismos, así, como aves, invertebrados , insectos , plantas , levaduras , hongos , e incluso microorganismos.
Peligros
La urea puede ser irritante para la piel y los ojos. Demasiado altas concentraciones en la sangre pueden causar daño a los órganos del cuerpo. Las bajas concentraciones de urea, tales como en orina no son peligrosos.
Se ha encontrado que la urea puede causar la proliferación de algas que producen toxinas, y urea en la escorrentía de fertilizantes pueden jugar un papel en el aumento de las floraciones tóxicas.
Contacto prolongado o repetido con urea en forma de fertilizantes en la piel puede producir dermatitis. La sustancia también irrita los ojos, la piel y el tracto respiratorio. La sustancia se descompone al calentarla intensamente por encima del punto de fusión, produciendo gases tóxicos, y reacciona violentamente con oxidantes fuertes, nitritos, cloruros inorgánicos, cloritas y percloratos, causando peligro de incendio y explosión
La producción sintética
La urea es un producto químico que contiene nitrógeno que se produce en una escala de algunos 100 millones de toneladas por año en todo el mundo.
Para su uso en la industria, la urea se produce a partir de síntesis de amoníaco y dióxido de carbono . La urea puede ser producido como gránulos, gránulos, copos, gránulos, cristales, y soluciones.
Más del 90% de la producción mundial está destinado para su uso como un fertilizante . La urea tiene la más alta de nitrógeno contenido de todos los fertilizantes nitrogenados sólidos de uso común (46,4%). Por lo tanto, tiene los más bajos costos de transporte por unidad de nitrógeno nutriente .
La urea es altamente soluble en agua y es, por lo tanto, también es muy adecuado para su uso en soluciones de fertilizantes (en combinación con nitrato de amonio: UAN), por ejemplo, en los fertilizantes foliares 'alimentación'.
La urea sólida se comercializa como perlas o gránulos. La ventaja de gránulos es que, en general, se pueden producir de forma más barata que los gránulos, los cuales, debido a su distribución más estrecha del tamaño de partícula, tienen una ventaja sobre los gránulos si se aplica mecánicamente al suelo . Propiedades tales como resistencia al impacto, resistencia al aplastamiento, y el comportamiento de flujo libre son, en particular, importante en la manipulación del producto, el almacenamiento y el transporte a granel.
La producción comercial
La urea se produce comercialmente a partir de dos materias primas, amoniaco y dióxido de carbono . Se producen grandes cantidades de dióxido de carbono durante la fabricación de amoníaco a partir de hulla o de hidrocarburos tales como gas natural y materias primas derivadas del petróleo. Esto permite la síntesis directa de urea a partir de estas materias primas.
La producción de urea a partir de amoníaco y dióxido de carbono se lleva a cabo en una reacción de equilibrio , con una conversión incompleta de los reactivos. Los distintos procesos de urea se caracterizan por las condiciones en las que la formación de urea tiene lugar y el modo en que los reactivos no convertidos se procesan adicionalmente.
Reactivos no convertidos pueden ser utilizados para la fabricación de otros productos, por ejemplo nitrato de amonio o sulfato , o pueden ser reciclados para la conversión completa de la urea en un proceso total de reciclaje.
Dos reacciones principales tienen lugar en la formación de urea a partir de amoniaco y dióxido de carbono . La primera reacción es exotérmica:
- 2 NH3 + CO2 → H 2 N-COONH 4 ( carbamato de amonio)
Mientras que la segunda reacción es endotérmica:
- H 2 N-COONH 4 → (NH 2) 2 CO + H 2 O
Ambas reacciones combinadas son exotérmicas.
El proceso, desarrollado en 1922, también se le llama el proceso de urea Bosch-Meiser después de sus descubridores.
Usos
El uso agrícola
La urea se utiliza como un fertilizante de liberación de nitrógeno, ya que hidroliza de nuevo a amoniaco y dióxido de carbono, pero su impureza más común, biuret, debe estar presente en menos del 2%, ya que altera el crecimiento de la planta. También se utiliza en muchas formulaciones de fertilizantes sólidos de múltiples componentes. Su acción de liberación de nitrógeno se debe a las condiciones que favorecen el lado de reactivo de los equilibrios, que producen urea.
La urea se propaga normalmente a velocidades de entre 40 y 300 kg / ha, pero las tasas de propagación reales pueden variar según el tipo de explotación y región. Es mejor hacer varias aplicaciones pequeñas a medianas a intervalos para minimizar las pérdidas por lixiviación y aumentar el uso eficiente del N aplicado, en comparación con las aplicaciones pesadas individuales. Durante el verano, la urea debe extenderse justo antes o durante la lluvia para reducir las posibles pérdidas de volatilización (proceso en el que el nitrógeno se pierde en la atmósfera como gas amoníaco). La urea no debe ser mezclado por cualquier período de tiempo con otros fertilizantes, ya que pueden dar lugar a problemas de calidad física.
Debido a la alta concentración de nitrógeno en urea, que es muy importante para lograr un reparto equilibrado. El equipo de aplicación debe ser calibrado correctamente y usarlo correctamente. La perforación no debe ocurrir al hacer contacto con o cerca de las semillas, debido al riesgo de daño de la germinación. La urea se disuelve en agua para su aplicación como una pulverización o por medio de sistemas de riego.
En los cultivos de cereales y algodón, la urea se aplica a menudo en el momento de la última cultivo antes de la siembra. Se debe aplicar en o ser incorporada en el suelo. En las zonas de alta pluviosidad y en suelos arenosos (donde el nitrógeno puede perderse por lixiviación) y donde se espera una buena lluvia en temporada baja, la urea puede ser lateral o superior vestida durante la temporada de crecimiento. Top-vestidor también es popular en pastos y cultivos forrajeros. En el cultivo de la caña de azúcar, la urea es después de la siembra, y se aplica a cada lado del vestido segundo ciclo de cultivo.
En los cultivos de regadío, urea se puede aplicar seco para el suelo, o se disuelve y se aplica a través del agua de riego. Urea se disolverá en su propio peso en agua, pero se vuelve cada vez más difícil de disolver al aumentar la concentración. La disolución de urea en agua es endotérmica, causando que la temperatura de la solución a caer cuando la urea se disuelve.
Como una guía práctica que, al preparar las soluciones de urea para fertirrigación (inyección en líneas de riego), se disuelve no más de 30 kg de urea por cada 100 litros de agua.
En aplicaciones foliares, las concentraciones de urea de 0,5% - 2,0% son de uso frecuente en los cultivos hortícolas. Como aerosoles urea pueden dañar el follaje del cultivo, asesoramiento específico se debe buscar antes de su uso. Bajo grados biuret de urea deben usarse si sprays urea son para ser aplicado de forma regular o a los cultivos hortícolas sensibles.
El almacenamiento de los fertilizantes de urea
Como la mayoría de los productos de nitrógeno, urea absorbe la humedad de la atmósfera. Por lo tanto, debe ser almacenado en bolsas cerradas / selladas en paletas, o, si se almacena a granel, bajo cubierta con una lona. Al igual que con la mayoría de fertilizantes sólidos, también se debe almacenar en un lugar fresco, seco y bien ventilado.
Uso industrial
La urea tiene la capacidad de formar compuestos sueltos '', llamados clatratos, con muchos compuestos orgánicos. Los compuestos orgánicos se llevan a cabo en los canales formados por hélices interpenetran que comprenden las moléculas de urea con enlaces de hidrógeno. Este comportamiento se puede utilizar para separar mezclas, y se ha utilizado en la producción de combustible de aviación y aceites lubricantes. Como se interconectan las hélices, todas las hélices en un cristal deben tener el mismo 'imparcialidad'. Esto se determina cuando el cristal es nucleado y por lo tanto puede ser forzado por siembra. Esta propiedad ha sido utilizada para separar mezclas racémicas.
Usos comerciales adicionales
- Un estabilizador en explosivos de nitrocelulosa
- Un reactivo en el NO x -Reducción SNCR y Reacciones SCR en gases de escape de combustión, por ejemplo, a partir de plantas de energía y motores diesel
- Un componente de fertilizante y la alimentación animal, proporcionando una fuente relativamente barata de nitrógeno para promover el crecimiento
- Una materia prima para la fabricación de plásticos , para ser específico, resina de urea-formaldehído
- Una materia prima para la fabricación de diversos pegamentos (urea-formaldehído o urea-melamina-formaldehído); este último es resistente al agua y se utiliza para contrachapado marino
- Una alternativa a la roca de sal en el deshielo de carreteras y pistas de aterrizaje; no promueve la corrosión del metal en la medida en que la sal hace
- Un ingrediente aditivo en cigarrillos, diseñados para mejorar sabor
- Un agente de dorado en la fábrica-producido galletas saladas
- Un ingrediente en algunos acondicionadores para el cabello, limpiadores faciales, aceites de baño y lociones
- La reactivo en algún frío listo para usar compresas para el uso de primeros auxilios, debido a la reacción endotérmica se crea cuando se mezcla con agua
- La agente de la siembra de nubes, junto con sales, para acelerar la condensación de agua en las nubes, produciendo precipitaciones
- Un ingrediente utilizado en el pasado para separar parafinas, debido a la capacidad de la urea para formar clatratos (también llamados complejos anfitrión-huésped, compuestos de inclusión, y aductos)
- Un agente de la llama a prueba (comúnmente utilizado en extintores químicos secos como bicarbonato de urea-potasio)
- Un ingrediente en muchos productos para blanquear los dientes
- Un aditivo para aleaciones de acero inoxidable utilizado en algunos cuchillos japoneses para retener la nitidez
- Una crema para suavizar la piel, especialmente la piel agrietada en la parte inferior de los pies de uno
- Un ingrediente de jabón para lavar platos.
- Hacer cianato de potasio
- Un agente de fusión utilizado en que vuelve a allanar halfpipes snowboard y características snow park
Uso en laboratorio
La urea es un potente proteínas desnaturalizante. Esta propiedad puede ser explotada para aumentar la solubilidad de algunas proteínas. Para esta aplicación, se utiliza en concentraciones de hasta 10 M. La urea se utiliza para interrumpir eficazmente los enlaces no covalentes en las proteínas. La urea es un ingrediente en la síntesis de nitrato de urea. Nitrato de urea es también un alto explosivo muy similar al nitrato de amonio, sin embargo, puede incluso ser más potente debido a su complejidad. VOD es 11.000 fps a 15,420 fps.
El uso médico
- Uso de drogas
La urea se utiliza en tópica productos dermatológicos para promover la rehidratación de la la piel. Si está cubierto por un vendaje oclusivo, preparaciones de urea 40% también se pueden usar para no quirúrgico desbridamiento de uñas. Este medicamento también se utiliza como una ayuda la eliminación de cerumen.
- El diagnóstico clínico
La prueba de nitrógeno ureico en sangre (BUN) es una medida de la cantidad de nitrógeno en la sangre que proviene de urea. Se utiliza como un marcador de la función renal.
- Otro uso diagnóstico
Urea marcada isotópicamente ( o radiactivo, - carbono 14 se utiliza isótopos estables) en el - carbono-13 prueba de aliento de urea, que se utiliza para detectar la presencia de la bacteria Helicobacter pylori (H. pylori) en el estómago y el duodeno de los seres humanos. La prueba detecta la enzima característica ureasa producida por H. pylori, por una reacción que produce amoniaco a partir de urea. Esto aumenta el pH (reduce la acidez) de la ambiente del estómago alrededor de la bacteria. Bacterias similares a las especies H. pylori puede ser identificado por la misma prueba en animales tales como monos, perros, y gatos (incluidos grandes felinos).
Uso textil
Urea en laboratorios textiles se utilizan con frecuencia tanto en el teñido y la impresión como un auxiliar importante, que proporciona solubilidad al baño y retiene algo de humedad requerido para el proceso de teñido o impresión.
Líquido iónico
El cloruro de colina, en mezcla con urea, se utiliza como una disolvente eutéctica profundo, un tipo de líquido iónico .
Ureas
El término urea o carbamida también se utiliza para la clase de compuestos químicos que comparten la misma grupo funcional RR'N-CO-NRR 'basado en una grupo carbonilo flanqueado por dos orgánicos de amina residuos. Se puede acceder en el laboratorio mediante la reacción de fosgeno con primaria o secundaria aminas . Ejemplo de ureas son los compuestos peróxido de carbamida, alantoína, y Hidantoína. Ureas están estrechamente relacionados con biurets y relacionados en estructura con amidas, carbamatos, diimidas, carbodiimidas, y thiocarbamides.
Reacciones
La urea reacciona con alcoholes para formar uretanos. La urea reacciona con ésteres de ácido malónico para hacer ácidos barbitúricos.

