Sustitución nucleófila
Antecedentes
SOS Children han producido una selección de artículos de la Wikipedia para escuelas desde 2005. Una buena manera de ayudar a otros niños es mediante el patrocinio de un niño
En orgánica y química inorgánica , sustitución nucleófila es una clase fundamental de reacciones en las que un electrón nucleófilo Adhiere selectivamente con o ataques de la carga positiva o parcialmente positiva de un átomo o un grupo de átomos llamado grupo saliente; el átomo positivo o parcialmente positiva se refiere como una electrófilo.
La forma más general para la reacción puede ser dado como
- Nuc: + R-LG → R-Nuc + LG:
El par de electrones (:) desde el nucleófilo (Nuc) ataca el sustrato (R-LG) la formación de un nuevo enlace, mientras que el grupo saliente (LG) sale con un par de electrones. El producto principal en este caso es R-Nuc. El nucleófilo puede ser eléctricamente neutro o cargado negativamente, mientras que el sustrato es típicamente neutro o cargado positivamente.
Un ejemplo de sustitución nucleófila es la hidrólisis de un alquilo bromuro, R -Br, bajo condiciones alcalinas, en donde el nucleófilo atacante es el OH - y la grupo saliente es Br -.
- R-Br + OH - → R-OH + Br -
Reacciones de sustitución nucleofílica son comunes en la química orgánica, y pueden ser clasificadas como sigue teniendo lugar en un saturado de carbono alifático o al (menor frecuencia) un saturada centro de carbono insaturado aromático u otro.
Sustitución nucleófila en los centros de carbono saturados
S N 1 y S N 2 reacciones
En 1935, Edward D. Hughes y Sir Christopher Ingold estudió las reacciones de sustitución nucleofílica de haluros de alquilo y compuestos relacionados. Propusieron que había dos mecanismos principales en el trabajo, tanto de ellos compiten entre sí. Los dos mecanismos principales son la S N 1 de reacción y la S N 2 reacción. S significa la sustitución química, N significa nucleofílico, y el número representa la para cinética de la reacción.
En la reacción S N 2, la adición del nucleófilo y la eliminación de grupo saliente tener lugar simultáneamente. S N 2 se produce en el que el átomo de carbono central es de fácil acceso para el nucleófilo. En cambio, el S N 1 reacción implica dos pasos. S N 1 reacciones tienden a ser importante cuando el átomo de carbono central del sustrato está rodeado por grupos voluminosos, tanto porque tales grupos interfieren estéricamente con la reacción S N 2 (discutido anteriormente) y porque se forma un carbono altamente sustituidos una estables carbocatión.
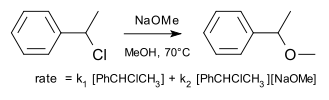
Un ejemplo de una reacción de sustitución que tiene lugar por un llamado mecanismo de borderline como estudiado originalmente por Hughes y Ingold es la reacción de cloruro de 1-feniletilo con metóxido de sodio en metanol.
La velocidad de reacción se encuentra a la suma de S N 1 y N 2 S componentes con 61% (3,5 M, 70 ° C) que tienen lugar por este último.
| Sustitución nucleófila en el carbono | |
|---|---|
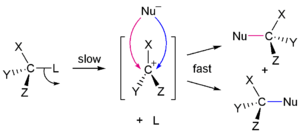 | 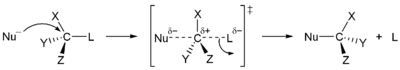 |
| S N 1 mecanismo | S N 2 mecanismo |
| Tabla 1. sustituciones nucleofílicas sobre RX (un haluro de alquilo o equivalente) | |||||||
|---|---|---|---|---|---|---|---|
| Factor | S N 1 | S N 2 | Comentarios | ||||
| Cinética | Velocidad = k [RX] | Velocidad = k [RX] [Nuc] | |||||
| Alquilo primarios | Nunca menos grupos estabilizadores adicional presente | Bueno menos que se utilice un nucleófilo obstaculizado | |||||
| Alquilo secundario | Moderado | Moderado | |||||
| Alquilo terciario | Excelente | Nunca | Eliminación probable si se calientan o si base fuerte utilizada | ||||
| Grupo saliente | Importante | Importante | Para halógenos, I> Br> Cl >> F | ||||
| Nucleofilicidad | Sin importancia | Importante | |||||
| Preferred disolvente | Polar prótico | Polar aprótico | |||||
| Estereoquímica | Racemización (+ parcial posible inversión) | Inversión | |||||
| Reordenamientos | Común | Raro | Reacción Side | ||||
| Eliminaciones | Es común, especialmente con nucleófilos básicos | Sólo con nucleófilos de calor y básicos | Reacción Side esp. si se calienta | ||||
Reacciones de sustitución nucleófila
Hay muchas reacciones en la química orgánica que implican este tipo de mecanismo. Los ejemplos más comunes incluyen
- Reducciones orgánicos con hidruros, por ejemplo
- reacciones de hidrólisis tales como
- R-Br + OH - → R-OH + Br - (S N 2) o
- R-Br + H 2 O → R-OH + HBr (S N 1)
- Síntesis de éter de Williamson
- R-Br + O '- → R-OR ' + Br - (S N 2)
- La Síntesis Wenker, una reacción de cierre del anillo de aminoalcoholes.
- La Reacción de Finkelstein, una reacción de intercambio de haluro. Nucleófilos de fósforo aparecen en el Y la reacción Perkow Reacción de Michaelis-Arbuzov.
- La Kolbe síntesis de nitrilo, la reacción de haluros de alquilo con cianuros.
Otros mecanismos
Además de S N 1 y N 2 S, otros mecanismos son conocidos, aunque son menos comunes. La S N i mecanismo se observa en las reacciones de cloruro de tionilo con alcoholes , y es similar a S N 1, excepto que el nucleófilo se entrega desde el mismo lado que el grupo saliente.
Sustituciones nucleofílicas pueden ser acompañados por un reordenamiento alílico como se ve en las reacciones tales como la Reordenamiento Ferrier. Este tipo de mecanismo se denomina S N 1 'o S N 2' de reacción (dependiendo de la cinética). Con haluros alílicos o sulfonatos, por ejemplo, el nucleófilo puede atacar en el carbono insaturado γ en lugar del carbono que lleva el grupo saliente. Esto puede verse en la reacción de 1-cloro-2-buteno con hidróxido de sodio para dar una mezcla de 2-buten-1-ol y 1-buten-3-ol:
- CH 3 CH = CH-CH 2 -Cl → CH 3 CH = CH-CH 2 -OH + CH 3 CH (OH) -CH = CH 2
La Mecanismo Sn1CB aparece en la química inorgánica . Existen mecanismos de la competencia.
Sustitución nucleófila en los centros de carbono insaturados
Sustitución nucleófila a través del mecanismo 2 S N 1 o N S no suele ocurrir con vinilo o aril haluros o compuestos relacionados. Bajo ciertas condiciones pueden producirse sustituciones nucleófilas, a través de otros mecanismos tales como los descritos en el artículo sustitución nucleófila aromática.
Cuando la sustitución se produce en el grupo carbonilo, el grupo acilo puede someterse sustitución nucleofílica de acilo. Este es el modo normal de sustitución con ácidos carboxílicos derivados, tales como cloruros de acilo, ésteres y amidas.