
Hidróxido
Antecedentes
SOS Children hizo esta selección Wikipedia junto a otros recursos de escuelas . Una rápida conexión para el apadrinamiento de niños es http://www.sponsor-a-child.org.uk/

El ión hidróxido es una diatómico anión con fórmula química OH -. Se compone de un oxígeno y un hidrógeno átomo mantiene unido por una enlace covalente, y que lleva un negativo carga eléctrica . Es un componente natural de agua. Actúa como una base hacia un ácido , o como una ligando hacia un metal, la donación de uno, dos o tres pares de electrones a los centros metálicos. El ión hidróxido está presente en los hidróxidos de grupo 1 y grupo 2 elementos, en el estado sólido. Esos hidróxidos se disocian en solución acuosa, liberando iones de hidróxido solvatados. El hidróxido de sodio es un multi-millones de toneladas por año química de los productos básicos. Un grupo de hidróxido unido a un fuertemente centro electropositivo puede disociar en sí, liberando un ion de hidrógeno, haciendo que el compuesto original un ácido .
En química orgánica el ion hidróxido puede actuar como un catalizador o como un reactivo nucleófilo. Un grupo OH, conocido como una grupo hidroxilo, está presente en los alcoholes , fenoles ácidos carboxílicos y afines compuestos orgánicos .
Ion hidróxido
El ión hidróxido es un constituyente natural de agua, a causa de la reacción de auto-ionización:
- H + + OH -
 H 2 O
H 2 O
La constante de equilibrio para esta reacción, definida como
- K w = [H +] [OH -]
tiene un valor de cerca de 10 -14 a 25 ° C, por lo que el concentración de iones hidróxido en el agua pura es cerca de 10 -7 mol dm -3, con el fin de satisfacer la restricción de igual carga. La pH de una solución es igual a la decimal cologaritmo de la concentración de iones de hidrógeno; el pH del agua pura es cerca de 7 a temperatura ambiente. La concentración de iones de hidróxido se puede expresar en términos de pOH, que es cerca de 14 - pH, por lo pOH de agua pura también está cerca de 7. La adición de una base de agua reducirá la concentración de iones de hidrógeno y, por tanto, aumentar la concentración de iones de hidróxido (aumento del pH, disminuir pOH) incluso si el base no contiene en sí hidróxido. Por ejemplo, amoníaco soluciones tienen un pH mayor que 7 debido a la reacción NH 3 + H + ![]() NH 4 +, lo que resulta en una disminución en la concentración de iones de hidrógeno y un aumento en la concentración de iones hidróxido. pOH se puede mantener a un valor casi constante con diversos soluciones tampón.
NH 4 +, lo que resulta en una disminución en la concentración de iones de hidrógeno y un aumento en la concentración de iones hidróxido. pOH se puede mantener a un valor casi constante con diversos soluciones tampón.

En la solución acuosa de iones hidróxido es una de base en el Sentido de Brönsted-Lowry, ya que puede aceptar un protón de un ácido de Bronsted-Lowry para formar una molécula de agua. También puede actuar como una Base de Lewis mediante la donación de un par de electrones a un ácido de Lewis. En solución acuosa ambos hidrógeno y iones hidróxido están fuertemente solvatadas, con enlaces de hidrógeno entre los átomos de oxígeno e hidrógeno. De hecho, el ion bihydroxide, H 3 O 2 -, se ha caracterizado en el estado sólido. Este compuesto es centrosymmetric y tiene un enlace de hidrógeno muy corto (114,5 pm) que es similar a la longitud en la ion bifluoruro, HF 2 - (114 horas). En solución acuosa el ion hidróxido de forma fuertes enlaces de hidrógeno con moléculas de agua. Una consecuencia de esto es que las soluciones concentradas de hidróxido de sodio tienen un alto viscosidad debido a la formación de una extensa red de enlaces de hidrógeno como en soluciones de fluoruro de hidrógeno.
En solución, el ión hidróxido reacciona rápidamente con la atmósfera de dióxido de carbono , que actúa como un ácido, para formar, inicialmente, la ion bicarbonato.
- OH - + CO 2
 HCO 3 -
HCO 3 -
La constante de equilibrio para esta reacción se puede especificar como una reacción con dióxido de carbono disuelto o como una reacción con gas de dióxido de carbono (ver ácido carbónico por los valores y detalles). A pH neutro o ácido, la reacción es lenta, pero es catalizada por la enzima anhidrasa carbónica que crea de manera efectiva los iones hidróxido en el sitio activo.
Las soluciones que contienen el ataque de iones de hidróxido de vidrio . En este caso, el silicatos de vidrio actúan como ácidos. Hidróxidos básicos, ya sea sólidos o en solución, se almacenan en recipientes de plástico hermético.
El ión hidróxido puede funcionar como un típico de donantes de pares de electrones ligando, la formación de complejos tales como [Al (OH) 4] -. También se encuentra a menudo en los complejos mixtos ligando del tipo [ML x (OH) y] z +, donde L es un ligando. El ión hidróxido a menudo sirve como una la reducción de ligando, la donación de un par de electrones a cada uno de los átomos de ser puenteada. Como se ilustra por [Pb 2 (OH)] 3+, hidróxidos de metal se escriben a menudo en un formato simplificado. Incluso puede actuar como un donante de 3 pares de electrones, como en el tetrámero [PTME 3 OH] 4).
Cuando se une a un centro de metal fuertemente aceptor de electrones, los ligandos de hidróxido tienden a ioniza en ligandos de óxido. Por ejemplo, el ion de bicromato, escribirse como [HCrO 4] -, se disocia según
- [O 3 Cro-H] -
 [CrO 4] 2- + H +
[CrO 4] 2- + H +
con un pKa de aproximadamente 5,9.
Espectros vibracionales
La espectros infrarrojos de compuestos que contienen el grupo OH tiene bandas de absorción fuertes en la región centrada alrededor de 3500 cm -1. La alta frecuencia es una consecuencia de la pequeña masa del átomo de hidrógeno en comparación con la masa del átomo de oxígeno y esto hace que la detección de grupos hidroxilo por espectroscopia infrarroja relativamente fácil Una banda debido a un grupo OH tiende a ser agudo. Sin embargo, el ancho de banda aumenta cuando el grupo OH está implicado en la unión de hidrógeno. Una molécula de agua tiene un HOH modo de flexión en torno a 1600 cm -1, por lo que la ausencia de esta banda se puede utilizar para distinguir un grupo OH de una molécula de agua.
Cuando el grupo OH está unido a un ion metálico en una complejo de coordinación, un modo de flexión M-OH se puede observar. Por ejemplo, en [Sn (OH) 6] 2- se produce a 1065 cm -1. El modo de flexión para un hidróxido de puente tiende a estar en una frecuencia más baja como en [( bipiridina) Cu (OH) 2 Cu ( bipiridina)] 2+ (955 cm -1). M-OH vibraciones de estiramiento se producen por debajo de aproximadamente 600 cm -1. Por ejemplo, el tetraédrica de iones [Zn (OH) 4] 2- tiene bandas a 470 cm -1 ( -Raman activo, polarizada) y 420 cm -1 (infrarrojos). El mismo ion tiene un (OH) Zn (OH) vibración de flexión a 300 cm -1.
Aplicaciones
Hidróxido de sodio soluciones, también conocido como lejía y soda cáustica, se utilizan en la fabricación de pulpa y papel, textiles , agua potable , jabones y detergentes, y como limpiador de cañerías. La producción mundial en 2004 fue de aproximadamente 60 millones toneladas. El principal método de fabricación es el proceso de cloro-álcali.
Las soluciones que contienen el ion hidróxido se generan cuando una sal de un ácido débil se disuelve en agua. El carbonato de sodio se usa como un álcali, por ejemplo, en virtud de la reacción de hidrólisis
- CO 3 2- + H 2 O
 HCO 3 - + OH -; ( pK a2 = 10,33 a 25 ° C y cero fuerza iónica)
HCO 3 - + OH -; ( pK a2 = 10,33 a 25 ° C y cero fuerza iónica)
Aunque la fuerza de la base de soluciones de carbonato de sodio es inferior a una solución concentrada de hidróxido de sodio, tiene la ventaja de ser un sólido. También se fabrica a gran escala (42 millones de toneladas en 2005) por la Proceso Solvay. Un ejemplo de la utilización de carbonato de sodio como un álcali es cuando de sosa comercial (otro nombre para el carbonato de sodio) actúa sobre ésteres insolubles, tales como triglicéridos, comúnmente conocidos como grasas, para hidrolizar ellos y los hacen soluble.
La bauxita, un hidróxido básico de aluminio , es el mineral principal de la cual se fabrica el metal. Del mismo modo, goetita (α-FeO (OH)) y lepidocrocita (γ-FeO (OH)), hidróxidos básicos de hierro , son algunos de los principales minerales utilizados para la fabricación de hierro metálico. Numerosos otros usos se pueden encontrar en los artículos sobre hidróxidos individuales.
Hidróxidos inorgánicos
Metales alcalinos
Aparte de NaOH y KOH, que gozan de aplicaciones muy gran escala, los hidróxidos de los otros metales alcalinos son también útiles. El hidróxido de litio es una base débil, con b pK de 0,2. El hidróxido de litio se utiliza en respirar sistemas de purificación de gas para naves espaciales, submarinos , y respiradores para eliminar el dióxido de carbono del gas exhalado.
- 2 LiOH + CO2 → Li 2 CO 3 + H 2 O
El hidróxido de litio se prefiere a la de sodio debido a su menor masa. El hidróxido de sodio , hidróxido de potasio y los hidróxidos de los otros metales alcalinos son bases fuertes.
Metales alcalinotérreos

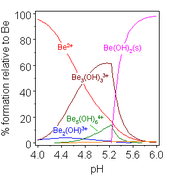
Las moléculas de agua para adjuntar y se omiten
Hidróxido de berilio, Be (OH) 2, es anfótero. El hidróxido de sí mismo es insoluble en agua, con una producto de solubilidad, log K * sp, de -11,7. La adición de ácido da soluble productos de hidrólisis, incluyendo el ion trimérica [BE 3 (OH) 3 (H 2 O) 6] 3+, que tiene grupos OH puente entre pares de iones de berilio haciendo un anillo de 6 miembros. A un pH muy bajo [Be (H 2 O) 4] 2+ se forma el ion aqua. La adición de hidróxido de Be (OH) 2 da tetrahydroxo soluble anión [Be (OH) 4] 2-.
La solubilidad en agua de los otros hidróxidos en este grupo se incrementa con el aumento de número atómico . El hidróxido de magnesio, Mg (OH) 2, es una base débil pero hidróxido de calcio es una base fuerte como son los hidróxidos de los tierras alcalinas más pesados, hidróxido de estroncio y hidróxido de bario. Una solución / suspensión de hidróxido de calcio es conocido como agua de cal y se puede utilizar para probar la dióxido de carbono ácido débil. La reacción de Ca (OH) 2 + CO 2 ![]() Ca 2+ + [HCO 3] - + OH - ilustra la fuerte basicidad de hidróxido de calcio. La cal sodada, que es una mezcla de NaOH y Ca (OH) 2 se utiliza como un absorbente de CO2.
Ca 2+ + [HCO 3] - + OH - ilustra la fuerte basicidad de hidróxido de calcio. La cal sodada, que es una mezcla de NaOH y Ca (OH) 2 se utiliza como un absorbente de CO2.
Elementos del grupo del boro

El hidróxido simple de boro, B (OH) 3, conocido como ácido bórico, es un ácido. A diferencia de los hidróxidos de los hidróxidos alcalinos y alcalinotérreos, que no se disocia en solución acuosa. En lugar de ello, reacciona con las moléculas de agua que actúa como un ácido de Lewis, liberando protones.
- B (OH) 3 + H 2 O
 [B (OH) 4] - + H +
[B (OH) 4] - + H +
Una variedad de oxianiones de boro son conocidos, que, en la forma protonada, contienen grupos hidróxido.

iones aluminato
El hidróxido de aluminio, Al (OH) 3 es anfótero y se disuelve en solución alcalina.
- Al (OH) 3 (sólido) + OH - (aq)
 [Al (OH) 4] - (aq)
[Al (OH) 4] - (aq)
En el Proceso de Bayer para la producción de óxido de aluminio puro a partir de minerales de bauxita este equilibrio es manipulado por un control cuidadoso de la temperatura y concentración de álcali. En la primera fase, el aluminio se disuelve en una solución alcalina caliente como [Al (OH) 4] -, pero otros hidróxidos normalmente presentes en el mineral, tales como hidróxidos de hierro, no se disuelven debido a que no son anfóteros. Después de la eliminación de los insolubles, la denominada solución de lodo rojo, se hace hidróxido de aluminio puro para precipitar mediante la reducción de la temperatura y la adición de agua al extracto, que, por dilución de la alcalino, reduce el pH de la solución. Hidróxido de aluminio básico, AlO (OH), que puede estar presente en la bauxita también es anfótero.
En soluciones ácidas suaves los complejos hidroxo formados por aluminio son algo diferentes de los de boro, que refleja el mayor tamaño de Al (III) vs. B (III). La concentración de las especies [Al 13 (OH) 32] 7+ es muy dependiente de la concentración total de aluminio. Varios otros complejos hidroxo se encuentran en compuestos cristalinos. Tal vez el más importante es el hidróxido básico, AlO (OH), un material polimérico conocido por los nombres de las formas minerales bohemita o diaspore, dependiendo de la estructura de cristal. Hidróxido de galio, hidróxido de indio y de talio (III) también son hidróxidos anfóteros. Talio (I) de hidróxido es una base fuerte.
Elementos del grupo Carbon
Formas de carbono no hidróxidos simples. El compuesto hipotético C (OH) 4 es inestable en solución acuosa:
- C (OH) 4 → HCO 3 - + H 3 O +
- HCO 3 - + H +
 H 2 CO 3
H 2 CO 3
El dióxido de carbono es también conocido como anhídrido carbónico, lo que significa que se forma por deshidratación del ácido carbónico, H 2 CO 3 (OC (OH) 2).
El ácido silícico es el nombre dado a una variedad de compuestos con una fórmula genérica [SiO x (OH) 4-2x] n. Ácido ortosilícico se han identificado en muy solución acuosa diluida. Es un ácido débil con pK a1 = 9,84, pK a2 = 13,2 a 25 ° C. Por lo general se escribe como H 4 SiO 4, pero la fórmula SiO2 (OH) 2 se acepta. Otros ácidos silícicos tales como ácido metasilícico (H 2 SiO 3), ácido disilicic (H 2 Si 2 O 5), y ácido pyrosilicic (H 6 Si 2 O 7) se han caracterizado. Estos ácidos también tienen grupos hidróxido unidos al silicio; las fórmulas sugieren que estos ácidos son formas protonadas de poli oxianiones.
Pocos complejos hidroxo de germanio se han caracterizado. De estaño (II) de hidróxido, Sn (OH) 2, se preparó en medios anhidro. Cuando de estaño (II) se trata con óxido alcalino del complejo hidroxo piramidal Sn (OH) 3 - se forma. Cuando las soluciones que contienen este ión se acidifican el ion [3 Sn (OH) 4] 2+ se forma junto con algunos complejos hidroxo básicos. La estructura de [3 Sn (OH) 4] 2+ tiene un triángulo de átomos de estaño conectados por puente grupos hidróxido. De estaño (IV) de hidróxido es desconocida, pero puede ser considerado como el ácido hipotética de la que estannatos, con una fórmula [Sn (OH) 6] 2-, se derivan mediante reacción con el (Lewis) ion hidróxido básico.
La hidrólisis de Pb 2+ en solución acuosa está acompañada por la formación de varios complejos que contienen hidroxo, algunos de los cuales son insolubles. El complejo hidroxo básica [Pb 6 O (OH) 6] 4+ es un racimo de seis centros de plomo con enlaces metal-metal que rodean a un ion óxido central. Los seis grupos hidróxido encuentran en las caras de los dos externos Pb 4 tetraedros. En soluciones fuertemente alcalinas solubles iones Plomizos se forman, incluyendo [Pb (OH) 6] 2-.
Otros elementos de los grupos principales
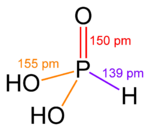 |  | 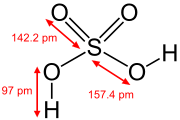 |  | 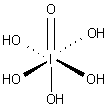 |
| Ácido fosforoso | Ácido fosfórico | Ácido sulfúrico | Ácido telúrico | orto ácido periódico |
En los estados de oxidación más altos de los elementos de los grupos 5, 6 y 7 hay oxoácidos en la que el átomo central está unido a iones de óxido e iones hidróxido. Los ejemplos incluyen ácido fosfórico , H 3 PO 4 y ácido sulfúrico , H 2 SO 4. En estos compuestos uno o más grupos de hidróxido pueden disociar con la liberación de iones de hidrógeno como en un estándar Ácido de Bronsted-Lowry. Muchos oxoácidos de azufre son conocidos y todas cuentan grupos OH que pueden disociar.
Ácido telúrico se escribe a menudo con la fórmula H 2 TeO 4 · 2H 2 O, pero está mejor descrito como estructuralmente Te (OH) 6.
Ácido -periodic Ortho puede perder todas sus protones, formando el ion peryodato, [IO 4] -. También puede estar protonado en condiciones fuertemente ácidas para dar el ion octaédrico [I (OH) 6] +, completando el serie isoelectrónico, [E (OH) 6] z, E = Sn, Sb, Te, I; z = -2, -1, 0, +1. Otros ácidos de yodo (VII) que contienen grupos hidróxido se conocen, en particular en sales, tales como el ion peryodato meso que se produce en K 4 [I 2 O 8 (OH) 2] · 8H 2 O.
Como es común fuera de los metales alcalinos, hidróxidos de los elementos en los estados de oxidación más bajos son complicadas. Por ejemplo, ácido fosforoso, H 3 PO 3, predominantemente tiene la estructura OP (H) (OH) 2, en equilibrio con una pequeña cantidad de P (OH) 3.
Los oxoácidos de cloro , bromo y yodo tienen la fórmula O (n-1) / 2 A (OH), donde n es el número de oxidación, 1, 3 o 5, y A = Cl, Br o I. La única oxoácido de flúor es F (OH). Cuando se neutralizan estos ácidos el átomo de hidrógeno se retira del grupo hidróxido.
Los metales de transición y post-transición
Los hidróxidos de los metales de transición y metales de transición post-por lo general tienen el metal en el 2 (M = Mn, Fe, Co, Ni, Co, Zn) o 3 (M = Fe, Ru, Rh, Ir) estado de oxidación. Ninguno de ellos es soluble en agua, y muchos están mal definidos. Hidróxidos de metales en el estado de oxidación +1 son también mal defnidas o inestable. Por ejemplo, hidróxido de plata, Ag (OH), se descompone espontáneamente al óxido (Ag 2 O). De cobre (I) y oro (I) hidróxidos son igualmente inestable, aunque se conocen aductos estables de CuOH y AuOH. El compuestos poliméricos M (OH) 2 y M (OH) 3 se prepara generalmente mediante el aumento del pH de una soluciones acuosas de los cationes metálicos correspondientes hasta que el hidróxido de precipita de la solución. Por el contrario, los hidróxidos se disuelven en solución ácida. Hidróxido de zinc, Zn (OH) 2, es anfótero, formando la ion zincate, Zn (OH) 4 2- en solución fuertemente alcalina.
Numerosos complejos de ligandos mixtos de estos metales con el hidróxido de iones existen, de hecho, estos son generalmente mejor definidos que los derivados más simples. Muchos se pueden hacer al provocar la disociación de una molécula de agua coordinada.
- L n M (OH 2) + B
 L n M (OH) + BH + (L = ligando, B = base)
L n M (OH) + BH + (L = ligando, B = base)
Vanádico ácido, H 3 VO 4, muestra similitudes con ácido fosfórico, H 3 PO 4, aunque tiene una forma mucho más compleja química oxoanión. Ácido crómico, H 2 CrO 4, tiene similitudes con ácido sulfúrico, H 2 SO 4; Por ejemplo, tanto en la forma sales de ácido, A + [HMO 4] -. Algunos metales, por ejemplo, V, Cr, Nb, Ta, Mo, W, tienden a existir en estados elevados de oxidación. En lugar de formar hidróxidos en solución acuosa, que se convierten en grupos oxo por el proceso de olation, formando polioxometalatos.
Las sales básicas que contienen hidróxido
En algunos casos, los productos de la hidrólisis parcial de iones metálicos, que se describe más arriba, se puede encontrar en compuestos cristalinos. Un ejemplo claro se encuentra con circonio (IV). Debido a la alto estado de oxidación, sales de Zr 4+ son ampliamente hidrolizan en agua incluso a pH bajo. El compuesto originalmente formulado como ZrOCl2 · 8H 2 O se encontró que era la sal de cloruro de una cación tetrameric, [4 Zr (OH) 8 (H 2 O) 16] 8+ en el que no es un cuadrado de iones de Zr 4+ con dos grupos hidróxido de puente entre los átomos de Zr a cada lado de la plaza y con cuatro moléculas de agua unidas a cada átomo de Zr.
El mineral malaquita es un ejemplo típico de un carbonato básico. La fórmula, Cu 2 CO 3 (OH) 2 muestra que es conceptualmente medio camino entre carbonato de cobre e hidróxido de cobre. De hecho, en el pasado, la fórmula fue escrito como CuCO3 · Cu (OH) 2. La estructura cristalina se compone de cobre, carbonato y los iones de hidróxido. El mineral atacamite es un ejemplo de un cloruro básico. Tiene la fórmula, Cu 2 Cl (OH) 3. En este caso la composición está más cerca a la del hidróxido de que el del cloruro, CuCl 2 · 3 Cu (OH) 2. Formas de fosfato de cobre (hidroxi Libethenita), arseniato ( Olivenita), sulfato ( brochantite) y compuestos de nitrato. Blanco de plomo es un elemento básico de plomo carbonato, (PbCO 3) 2 · Pb (OH) 2 que se ha utilizado como pigmento blanco debido a su calidad opaco, aunque su uso se limita ahora, ya que puede ser una fuente para envenenamiento por plomo.
La química estructural
El ion hidróxido parece rotar libremente en los cristales de los hidróxidos de metales alcalinos más pesados a temperaturas más altas con el fin de presentarse como un ión esférica, con un eficaz radio iónico de aproximadamente 153 horas. Así, las formas de alta temperatura de KOH y NaOH tienen el cloruro de sodio estructura que congela gradualmente en una estructura de cloruro de sodio monocinically distorsionada a temperaturas por debajo de aproximadamente 300 ° C. Los grupos OH todavía giran incluso a temperatura ambiente alrededor de sus ejes de simetría y por lo tanto no pueden ser detectados por Difracción de rayos X. La forma a temperatura ambiente de NaOH tiene la estructura de yoduro de talio. LiOH, sin embargo, tiene una estructura en capas, compuesto por Li tetraédrica (OH) 4 y (OH) Li 4 unidades. Esto es consistente con el carácter débilmente básico de LiOH en solución, lo que indica que el enlace Li-OH tiene mucho carácter covalente.
Las pantallas de iones de hidróxido cilíndricas simetría en hidróxidos de metales divalentes Ca, Cd, Mn, Fe y Co por ejemplo, hidróxido de magnesio, Mg (OH) 2 ( brucita) cristaliza con el estructura de la capa de yoduro de cadmio, con una especie de primer embalaje de magnesio y iones de hidróxido.
El Al hidróxido anfótero (OH) 3 tiene cuatro formas cristalinas principales: gibbsita (más estable), bayerita, nordstrandita y doyleite. Todos estos polimorfos se construyen de capas dobles de iones de hidróxido - los átomos de aluminio en dos tercios de los huecos octaédricos entre las dos capas - y sólo se diferencian en la secuencia de apilamiento de las capas. Las estructuras son similares a la estructura brucita. Sin embargo, mientras que la estructura brucite puede ser descrito como una estructura de empaquetamiento compacto en gibbsita los grupos OH en la parte inferior de una capa de resto en los grupos de la capa de abajo. Esta disposición ha llevado a pensar que hay bonos de dirección entre los grupos OH en las capas adyacentes. Esta es una forma inusual de se esperaría que el enlace de hidrógeno ya que los dos iones hidróxido involucrado al punto de distancia el uno del otro. Los átomos de hidrógeno se han situado por experimentos de difracción de neutrones en αAlO (OH) ( diaspore). La distancia OHO es muy corto, a 265 pm; el hidrógeno no es equidistante entre los átomos de oxígeno y el corto enlace OH forma un ángulo de 12 ° con la línea OO. Un tipo similar de enlace de hidrógeno ha sido propuesto para otros hidróxidos anfóteros, incluyendo Be (OH) 2, Zn (OH) 2 y Fe (OH) 3
Un número de hidróxidos mixtos son conocidos con estequiometría A 3 M III (OH) 6, A 2 M IV (OH) 6 y AM V (OH) 6. Como la fórmula sugiere que estas sustancias contienen M (OH) 6 unidades estructurales octaédricos. Hidróxidos dobles en capas pueden ser representados por la fórmula [M z + 1-x M 3+ x (OH) 2] + q (X n-) q / n · y H 2 O. Más comúnmente, z = 2, y M = 2 + Ca 2+, Mg 2+, Mn 2+, Fe 2 +, Co2 +, Ni2 +, Cu2 + o Zn 2+; por lo tanto, q = x.
En las reacciones orgánicas
El hidróxido de potasio y el hidróxido de sodio son dos bien conocidos reactivos en la química orgánica .
Catálisis básica
El ión hidróxido puede actuar como una catalizador de base. La base abstrae un protón de un ácido débil para dar un intermedio que va a reaccionar con otro reactivo. Sustratos comunes para la abstracción de protones son alcoholes , fenoles , aminas y ácidos de carbono. La pK un valor para la disociación de un enlace CH es extremadamente alto, pero el pKa hidrógenos alfa de un compuesto de carbonilo son aproximadamente 3 unidades de registro inferior. Valores de un pK típicos son el 16,7 por acetaldehído y 19 de acetona . La disociación puede ocurrir en presencia de una base adecuada.
- RC (O) CH 2 R '+ B
 RC (O) CH - R '+ BH +
RC (O) CH - R '+ BH +
La base debe tener un pK un valor no menor que alrededor de 4 unidades logarítmicas más pequeña o el equilibrio se encontrará casi completamente a la izquierda.
El ión hidróxido de por sí no es una base suficientemente fuerte, pero se puede convertir en una mediante la adición de hidróxido de sodio en etanol
- OH - + EtOH
 ETO - + H 2 O
ETO - + H 2 O
para producir el ion etóxido. El pK una para la auto-disociación de etanol es de aproximadamente 16 por lo que el ion alcóxido es una base suficientemente fuerte La adición de un alcohol a un aldehído para formar una hemiacetal es un ejemplo de una reacción que puede ser catalizada por la presencia de hidróxido. Hidróxido también puede actuar como un catalizador de base de Lewis.
Como un reactivo nucleófilo

El ión hidróxido es intermedio en nucleophilicity entre el ion fluoruro, F -, y el ion amida, NH 2 -. La hidrólisis de una éster,
- R 1 C (O) O 2 + H 2 O
 R 1 C (O) OH + HOR 2
R 1 C (O) OH + HOR 2
también conocido como saponificación es un ejemplo de una sustitución nucleófila de acilo con la actuación de iones de hidróxido como un nucleófilo. En este caso, el grupo saliente es una ion alcóxido, que elimina inmediatamente un protón de una molécula de agua para formar un alcohol . En la fabricación de jabón, se añade cloruro de sodio para sal de la sal de sodio del ácido carboxílico; este es un ejemplo de la aplicación de la efecto de ion común.
Otros casos en los que el hidróxido puede actuar como un reactivo nucleófilo son hidrólisis de la amida, la Reacción de Cannizzaro, sustitución alifática nucleófila , sustitución aromática nucleófila y en reacciones de eliminación. El medio de reacción para KOH y NaOH es generalmente agua pero con una catalizador el anión hidróxido de fase de transferencia puede ser transportados en un disolvente orgánico, así, por ejemplo, en la generación de diclorocarbeno.
Los grupos hidroxilo en compuestos orgánicos
Compuestos orgánicos tales como alcoholes , fenoles y ácidos carboxílicos contienen grupos hidroxilo. Cada clase de compuesto se somete a reacciones específicas a esa clase.

