
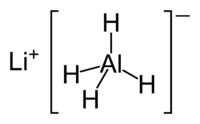
Hidruro de litio y aluminio
Antecedentes de las escuelas de Wikipedia
SOS cree que la educación da una mejor oportunidad en la vida para los niños en el mundo en desarrollo también. Una rápida conexión para el apadrinamiento de niños es http://www.sponsor-a-child.org.uk/
| Hidruro de litio y aluminio | |
|---|---|
 | |
 | |
 | |
Hidruro de litio y aluminio | |
Otros nombres LAH, alanato de litio, | |
| Identificadores | |
| CAS | 16853-85-3 |
| Número RTECS | BD0100000 |
| Propiedades | |
| Fórmula molecular | LiAlH4 |
| Masa molar | 37.95 g / mol |
| Apariencia | cristales blancos (muestras puras) polvo gris (material comercial) |
| Densidad | 0,917 g / cm 3, sólida |
| Punto de fusion | 150 ° C (423 K), descomposición |
| Solubilidad en agua | reactivo |
| Estructura | |
| Estructura cristalina | monoclínico |
| Peligros | |
| R declaración / S | R: 15 S: 07/08, 24/25, 43 |
| Principal peligros | altamente inflamable |
| NFPA 704 |  2 3
2 |
| Compuestos relacionados | |
| Conexo hidruro | hidruro de aluminio borohidruro de sodio hidruro de sodio |
| Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
Hidruro de aluminio y litio ( Li Al H 4), comúnmente abreviado como LAH, es una agente reductor utilizado en síntesis orgánica. Es más poderosa que la relacionada reactivo borohidruro de sodio debido al enlace Al-H más débil en comparación con el enlace BH. Se convertirá ésteres, ácidos carboxílicos y cetonas en los correspondientes alcoholes ; y amida, nitro, nitrilo, yo mismo, oxima, y Los compuestos de azida en las aminas .
Disponibilidad y manejo
LAH es un blanco muestras sólidas pero comerciales son casi siempre gris debido a la contaminación con trazas de aluminio metálico. Este material se puede purificar por recristalización a partir de éter dietílico. Purificaciones a gran escala emplean un Extractor Soxhlet. Comúnmente, el material gris impuro se utiliza en la síntesis, ya que las impurezas son inocuos y fácilmente separado de los productos orgánicos. El material puro es pirofórico. Algunos materiales comerciales contienen aceite mineral para inhibir reacciones con la humedad atmosférica, pero más comúnmente se empaca en sacos de plástico a prueba de humedad.
LAH reacciona violentamente con el agua , incluyendo la humedad atmosférica. La reacción transcurre según la ecuación siguiente idealizada:
- LiAlH 4 + 4 H 2 O → LiOH + Al (OH) 3 + 4 ↑ H 2
Esta reacción proporciona un método útil para generar hidrógeno en el laboratorio. Muestras envejecidas, aire expuestos a menudo aparecen de color blanco, ya que han absorbido suficiente humedad para generar una mezcla de los compuestos incoloros hidróxido de litio y hidróxido de aluminio.
Preparación
LAH se preparó primero de la reacción entre hidruro de litio (LiH) y cloruro de aluminio :
- 4 LiH + AlCl3 → LiAlH4 + 3 LiCl
Además de este método, la síntesis industrial implica la preparación inicial de hidruro de aluminio y sodio a partir de los elementos bajo alta presión y temperatura:
- Na + Al + 2 H 2 → 4 NaAlH
LAH se prepara entonces reacción de metátesis de acuerdo a:
- NaAlH 4 + LiCl → LiAlH4 + NaCl
que procede en un alto rendimiento de LAH. LiCl se elimina por filtración de una etérea solución de LAH, con la subsiguiente precipitación de LAH para producir un producto que contiene alrededor de 1% w / w LiCl.
Otros tetrahydridoaluminiumates
Una variedad de sales análogas a LAH son conocidos. NaH se puede utilizar para producir de manera eficiente hidruro de sodio y aluminio (NaAlH 4) por metátesis en THF:
- LiAlH4 + NaH → NaAlH 4 + LiH
El potasio hidruro de aluminio (Kalh 4) se puede producir de manera similar en diglima como disolvente:
- LiAlH4 + KH → Kalh 4 + LiH
El inverso, es decir, la producción de LAH de cualquiera de hidruro de sodio y aluminio o hidruro de aluminio y potasio se puede obtener por reacción con LiCl en éter dietílico o THF:
- NaAlH 4 + LiCl → LiAlH4 + NaCl
- Kalh 4 + LiCl → LiAlH4 + KCl
"Magnesio alanato" (Mg (AlH 4) 2) surge de manera similar usando MgBr 2:
- 2 LiAlH4 + MgBr2 → Mg (AlH 4) 2 + 2 LiBr
El uso en la química orgánica
Hidruro de litio y aluminio se utiliza ampliamente en química orgánica como una agente reductor. A pesar de los problemas asociados con el manejo de su reactividad, se utiliza incluso a escala industrial pequeña, aunque para las reducciones de gran escala el bis de sodio reactivo relacionado (2-metoxietoxi) hidruro de aluminio, comúnmente conocido como Red-Al, se utiliza más a menudo. Para tales fines se utiliza generalmente en solución en éter dietílico, y una tratamiento acuoso se lleva a cabo generalmente después de la reducción con el fin de eliminar los subproductos inorgánicos.
LAH es más comúnmente utilizado para la reducción de ésteres y ácidos carboxílicos a alcoholes primarios; Antes de la llegada de LiAlH4 esto era difícil que implica una conversión de sodio de metal en la ebullición de etanol (la Bouveault-Blanc reducción). Aldehídos y cetonas también se pueden reducir a los alcoholes por LAH, pero eso se hace generalmente usando reactivos más leves como NaBH4. α, β-cetonas insaturadas son reducidos a alcoholes alílicos. Cuando epóxidos se reducen usando LAH, el reactivo ataca al menos obstaculizado final del epóxido, por lo general la producción de un alcohol secundario o terciario. Epoxycyclohexanes se reducen para dar alcoholes axiales preferentemente.
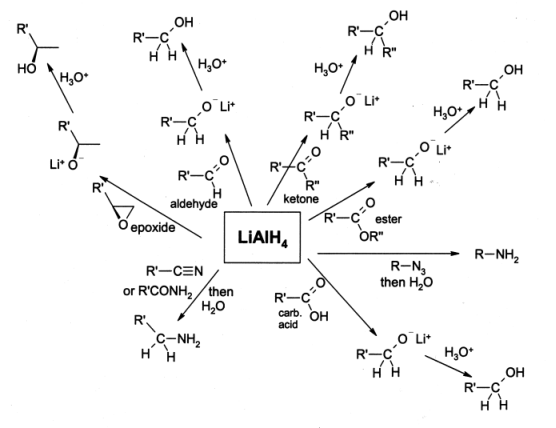
El uso de LAH, aminas se pueden preparar por la reducción de amidas ,, oximas, nitrilos, compuestos nitro o alquilo azidas.
Hidruro de litio y aluminio reduce también haluros de alquilo a alcanos , aunque esta reacción se emplea raramente. Yoduros de alquilo reaccionan el más rápido, seguido de bromuros de alquilo y cloruros luego alquilo. Haluros primarios son el más reactivo seguido de haluros secundarios. Haluros terciarios reaccionan sólo en ciertos casos.
Hidruro de litio y aluminio no reduce simples alquenos , arenos, y alquinos sólo se reducen si un alcohol grupo está cerca.
La química inorgánica
LAS es ampliamente utilizado para preparar principales hidruros de metales de transición del grupo y del metal correspondiente haluros.
La descomposición térmica
En sala de LAH temperatura es metaestable. Durante un almacenamiento prolongado puede descomponerse lentamente a Li 3 AlH 6 y LiH. Este proceso puede ser acelerado por la presencia de catalizadores , por ejemplo, elementos Ti , Fe , V .
Cuando LAH calienta se descompone en una de tres pasos mecanismo de reacción.
- LiAlH4 → ⅓ Li 3 AlH 6 + ⅔ Al + H 2 (R1)
- ⅓ Li 3 AlH 6 → LiH + ⅓ Al + ½ H 2 (R2)
- LiH + Al → LiAl + ½ H 2 (R3)
R1 se inicia generalmente por el fusión de LAH en torno a una temperatura de 150-170 ° C inmediatamente seguido por descomposición en sólida Li 3 AlH 6. De 200 a 250 o C Li 3 AlH 6 descomponen en LiH (R2), que posteriormente se descompone en LiAl por encima de 400 o C (R3). R1 es efectivamente irreversible, porque LiAlH4 es metaestable. La reversibilidad de R2 aún no se ha establecido de manera concluyente. R3 es reversible con una presión de equilibrio de aproximadamente 0,25 bar a 500 o C. R1 y R2 pueden ocurrir a temperatura ambiente con catalizadores adecuados.
De acuerdo con las reacciones R1-R3 LiAlH 4 contiene 10,6% en peso de hidrógeno haciendo así LAH un potencial de hidrógeno medio de almacenamiento para el futuro pilas de combustible vehículos. Cycling sólo R2 almacenaría 5,6% en peso en el material en un solo paso (comparable a los dos pasos de NaAlH 4).
Datos de solubilidad
LAH es soluble en muchos etéreos soluciones. Sin embargo, puede descomponerse espontáneamente debido a la presencia de impurezas catalíticas, sin embargo, parece ser más estable en THF. Por lo tanto, THF se prefiere sobre por ejemplo, éter dietílico, incluso a pesar de la menor solubilidad.
| Temperatura (° C) | |||||
| Solvente | 0 | 25 | 50 | 75 | 100 |
| Éter dietílico | - | 5.92 | - | - | - |
| THF | - | 2.96 | - | - | - |
| Monoglima | 1.29 | 1.80 | 2.57 | 3.09 | 3.34 |
| Diglime | 0.26 | 1.29 | 1.54 | 2.06 | 2.06 |
| Triglima | 0.56 | 0.77 | 1.29 | 1.80 | 2.06 |
| Tetraglima | 0.77 | 1.54 | 2.06 | 2.06 | 1.54 |
| Dioxano | - | 0.03 | - | - | - |
| Éter de dibutilo | - | 0.56 | - | - | - |
Tenga en cuenta que el hidruro de litio y aluminio no debe utilizarse con agua, que reacciona violentamente como se describe por la siguiente ecuación.
- LiAlH 4 + 4 H 2 O → Li + + Al 3+ + 4 OH - + 4 H 2
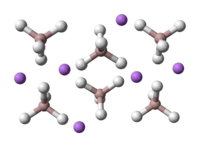
Estructura cristalina

La estructura cristalina de LAH pertenece a la sistema y el cristal monoclínico grupo espacial P2 es 1 c. La estructura cristalina de LAH se ilustra a la derecha. La estructura consta de Li átomos rodeados por cinco AlH 4 tetraedros . Los centros de Li + se unen a uno de hidrógeno átomo de cada uno de los tetraedros que rodea la creación de una disposición bipirámide. La celda unitaria se define de la siguiente manera: a = 4,82, b = 7,81, y c = 7,92 Å, α = γ = 90 ° y β = 112 °. A altas presiones (> 2.2GPa) una transición de fase se produce para dar β-LAH.
Datos termodinámicos
La tabla resume termodinámicas datos para LAH y reacciones que implican LAH, en la forma de estándar de entalpía , entropía y energía libre de Gibbs cambio, respectivamente.
| Reacción | ? H o (kJ / mol) | ? S o (J / (mol K)) | ? G o (kJ / mol) | Comentario |
| Li (s) + Al (s) + 2 H 2 (g) → LiAlH4 (s) | -116.3 | -240.1 | -44.7 | Formación estándar de los elementos. |
| LiH (s) + Al (s) + 3/2 H 2 (g) → LiAlH4 (s) | -25.6 | -170.2 | 23.6 | Utilizando? H d e (LIH) = -90,5,? S o F (LIH) = -69,9, y? G o F (LIH) = -68,3. |
| LiAlH4 (s) → LiAlH4 (l) | 22 | - | - | Calor de fusión. El valor es probablemente poco fiable. |
| LiAlH4 (l) → ⅓ Li 3 AlH 6 (s) + ⅔ Al (s) + H 2 (g) | 3.46 | 104.5 | -27.68 | ? S o calculada a partir de los valores reportados de? H O y? G o. |

