
Carbonato
Informações de fundo
Crianças SOS tentou tornar o conteúdo mais acessível Wikipedia por esta selecção escolas. Patrocínio da criança ajuda as crianças uma a uma http://www.sponsor-a-child.org.uk/ .
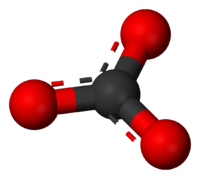
Em química , um carbonato de um sal ou éster de ácido carbônico.
Aplicações
Água da soda (também conhecida como água Seltzer) é água com CO 2 dissolvido sob pressão. O gosto de água com gás foi descoberto pelo químico do século 18 Joseph Priestley.
Para testar a presença do anião de carbonato num sal, a adição do ácido mineral diluído (por exemplo ácido clorídrico ) irá produzir gás dióxido de carbono.
Contendo carbonato sais são industrialmente e mineralogicamente onipresente. O termo "carbonato" também é geralmente utilizado para se referir a um destes sais ou minerais de carbonato. O mais comum é a calcite , ou carbonato de cálcio, o principal constituinte calcário. O processo de remoção de dióxido de carbono a partir destes sais de aquecimento, é designada calcinação.
O termo também é utilizado como um verbo, para descrever o processo de elevação e carbonato As concentrações de bicarbonato na água, ver também água carbonatada, ou pela introdução sob pressão de dióxido de carbono do gás na água, ou por dissolução de sais de carbonato ou de bicarbonato na água.
Propriedades químicas
O ião carbonato é um poliatômico anião com a fórmula empírica C O 3 2- e uma massa molecular de 60,01 Daltons; ele consiste em um centro de carbono átomo cercado por três átomos de oxigênio idênticos em um arranjo planar trigonal. O ião carbonato carrega um de dois negativo acusação formal e é o base conjugada do ião hidrogénio carbonato, HCO 3 -, que é a base conjugada de H 2 CO 3, ácido carbónico.
Forma-se um sal de carbonato, quando um ião carregado positivamente liga aos átomos de oxigénio de carga negativa do ião, que forma um iónica composto . A maioria dos sais de carbonato são insolúveis em água em temperatura padrão e pressão, com as constantes de solubilidade de menos do que 1 x 10 -8. As exceções incluem de sódio, de potássio e carbonatos de amónio.
Em solução aquosa, carbonato, bicarbonato, dióxido de carbono, e o ácido carbónico coexistir num equilíbrio dinâmico . Em condições fortemente básicas, o ião carbonato predomina, enquanto em condições fracamente básicas, o ião bicarbonato é prevalente. Em condições ácidas, mais aquosa de dióxido de carbono , CO2 (aq), é a forma principal, que, com a água, H2O, está em equilíbrio com ácido carbónico - o equilíbrio encontra-se fortemente para o dióxido de carbono. Assim carbonato de sódio é básico, bicarbonato de sódio fracamente básico é, enquanto o próprio dióxido de carbono é um ácido fraco.
Água gaseificada é formada por dissolução de CO 2 na água sob pressão. Quando a pressão parcial de CO2 está reduzida, por exemplo, quando uma lata de refrigerante é aberto, o equilíbrio para cada uma das formas de carbonato (carbonato, bicarbonato, dióxido de carbono, e o ácido carbónico) desloca até que a concentração de CO 2 na solução é igual à solubilidade do CO 2 a essa temperatura e pressão. Em sistemas vivos uma enzima, anidrase carbônica, acelera a interconversão de CO 2 e ácido carbónico.
Em química orgânica um carbonato pode também referir-se a um grupo funcional dentro de uma molécula maior que contenha um átomo de carbono ligado a três átomos de oxigénio, que é uma ligação dupla. O VSEPR forma do ião carbonato é planar trigonal ou triplanar
Química ácido-base
O ião carbonato (CO 3 2-) é uma base forte. É uma base conjugada do ácido fraco bicarbonato ( Nome IUPAC carbonato de hidrogénio e de HCO 3 -), em si uma forte base conjugada do ainda fracamente ácida ácido carbônico. Como tal, em solução aquosa, o ião carbonato de busca para recuperar átomos de hidrogénio.
Ele funciona como um tampão no sangue da seguinte forma: quando o pH é demasiado baixo, a concentração de iões de hidrogénio é demasiado elevada, para que expire CO 2. Isso fará com que a equação para desvio à esquerda, essencialmente diminuindo a concentração de íons H +, causando um pH mais básico.
Quando o pH for demasiado elevado, a concentração de iões de hidrogénio no sangue é muito baixa, de modo que os rins excretam bicarbonato (HCO 3 -). Isto faz com que a equação de deslocamento para a direita, essencialmente, o aumento da concentração de iões de hidrogénio, fazendo com que um pH mais ácido.
Sais de carbonato
- Resumo carbonato:
| H 2 CO 3 | Ele | |||||||||||||||||
| Li 2 CO 3 | BECO 3 | B | C | N | O | F | Ne | |||||||||||
| Na 2 CO 3 | MgCO3 | Al 2 (CO 3) 3 | Si | P | S | Cl | Ar | |||||||||||
| K 2 CO 3 | CaCO3 | Sc | Ti | V | Cr | MnCO 3 | FeCO 3 | Coco 3 | Nico 3 | CuCO3 | ZnCO 3 | Ga | Ge | Como | Se | Br | Kr | |
| Rb 2 CO 3 | SrCO3 | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag 2 CO 3 | CdCO 3 | Em | Sn | Sb | Te | EU | Xe | |
| Cs 2 CO 3 | BaCO3 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl 2 CO 3 | PbCO 3 | Bi | Po | Em | Rn | ||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | UUP | Lv | Uus | UUO | ||
| ↓ | ||||||||||||||||||
| La 2 (CO 3) 3 | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tuberculose | Dy | Ho | Er | Tm | Yb | Lu | ||||
| CA | Th | Pa | U | Np | Pu | Sou | Cm | Bk | Cf | Es | Fm | Md | Não | Lr | ||||
História
Acredita-se geralmente que a presença de carbonatos em rocha é evidência inequívoca da presença de água no estado líquido. Observações recentes da nebulosa planetária NGC 6302 mostra evidências de carbonatos no espaço, onde alteração aquosa semelhante ao da Terra é improvável. Outros minerais têm sido propostas que se encaixam as observações.
Significativo depósitos de carbonato não foram encontrados em Marte através de sensoriamento remoto ou em missões in situ, apesar de meteoritos marcianos conter pequenas quantidades e das águas subterrâneas pode ter existido, tanto Gusev e Meridiani Planum.
