
Reacción ácido-base
Antecedentes
Esta selección Wikipedia está disponible sin conexión de SOS Children para su distribución en el mundo en desarrollo. SOS Children ha cuidado de niños en África durante cuarenta años. ¿Puedes ayudar a su trabajo en África ?
| Ácidos y Bases |
|---|
| Constante de disociación del ácido Extracción ácido-base Reacción ácido-base Valoración ácido-base Constante de disociación Función de acidez Soluciones tampón pH Afinidad protónica Auto-ionización del agua La fuerza del ácido |
| Ácido tipos |
| Brønsted · Lewis · Mineral Orgánica · Fuerte Superácidos · Débil |
| Los tipos base |
| Brønsted · Lewis · Orgánico Fuerte · Superbases No nucleófila · Débil |
Una reacción ácido-base es una reacción química que se produce entre un ácido y una base. Existen varios conceptos que proporcionan definiciones alternativas para los mecanismos de reacción involucrados y su aplicación en la solución de problemas relacionados. A pesar de varias similitudes en las definiciones, su importancia se hace evidente como diferentes métodos de análisis cuando se aplica a reacciones ácido-base de especies gaseosas o líquidas, o cuando el ácido o la base de caracteres puede ser algo menos evidente. Históricamente, el primero de estos conceptos científicos de ácidos y bases fueron provistos por el francés químico Antoine Lavoisier , alrededor de 1776 .
Teorías ácido-base común
Definición Lavoisier
Dado que el conocimiento de Lavoisier de ácidos fuertes estaba restringido principalmente a oxiácidos, que tienden a contener átomos centrales en alto estados de oxidación rodeados de oxígeno, tales como HNO 3 y H 2 SO 4 , y ya que no estaba al tanto de la verdadera composición de los ácidos hidrácidos, HCl, HBr y HI, se definen los ácidos en términos de su contenga oxígeno , lo que a su hecho que llamó de las palabras griegas que significan "ácido-ex" (del griego οξυς (oxys) que significa "ácido" o "fuerte" y γεινομαι (geinomai) o "engendrar"). La definición Lavoisier se celebró como una verdad absoluta para más de 30 años, hasta que el artículo 1810 y conferencias posteriores por Sir Humphry Davy en la que demostraron la falta de oxígeno en H 2 S, H 2 Te, y el ácidos hidrácidos halogenados.
Definición Liebig
Esta definición fue propuesta por Justus von Liebig circa 1838 , basado en su extensa obra sobre la composición química de ácidos orgánicos. Esto terminó el cambio doctrinal de ácidos a base de oxígeno a los ácidos basados en el hidrógeno, iniciada por Davy. Según Liebig, un ácido es una sustancia que contiene hidrógeno en la que el hidrógeno podría ser sustituido por un metal. Definición de Liebig, mientras completamente empírica, se mantuvo en uso durante casi 50 años, hasta la adopción de la definición de Arrhenius.
Definición de Arrhenius

La definición de Arrhenius de las reacciones ácido-base es un concepto ácido-base más simplificada ideado por Svante Arrhenius, que se utiliza para proporcionar una definición moderna de bases que siguió de su trabajo con Friedrich Wilhelm Ostwald en el establecimiento de la presencia de iones en solución acuosa, en 1884 , y llevó a Arrhenius recibir el Premio Nobel de Química en 1903 por el "reconocimiento de los extraordinarios servicios ... prestado al avance de la química por su teoría de la disociación electrolítica"
Tal como se define en el momento del descubrimiento, reacciones ácido-base se caracterizan por los ácidos de Arrhenius, que disociar en forma de solución acuosa de hidrógeno o llamado más tarde, el oxonio (H 3 O +) iones, y las bases de Arrhenius que forman hidróxido (OH -) iones. Más reciente Recomendaciones de la IUPAC sugieren ahora el nuevo término "hidronio" se utilizará en favor del término aceptado "oxonio" más para ilustrar los mecanismos de reacción, tales como los definidos en la definición del sistema de disolvente de Brønsted-Lowry y más claramente, con la definición de Arrhenius que sirve como una simple esquema general de carácter ácido-base más sucintamente, la definición de Arrhenius se puede conjeturar como;
| " | Ácidos de Arrhenius forman iones hidrógeno en solución acuosa con bases de Arrhenius forman iones hidróxido. | " |
La definición ácido-base acuosa universal del concepto de Arrhenius se describe como la formación de agua a partir de hidrógeno y iones hidróxido o iones hidronio y iones hidróxido producido a partir de la disociación de un ácido y la base en solución acuosa (2 H 2 O → OH - + H 3 O +), que conduce a la definición de Arrhenius que en reacciones ácido-base, se forma una sal y el agua de la reacción entre un ácido y una base - en las definiciones científicas más simples, esta forma de reacción se llama una Reacción de neutralización.
- + ácido + base - → sal + agua
El ion positivo de una base puede formar una sal con el ion negativo de un ácido. Por ejemplo, dos moles de la base de hidróxido de sodio (NaOH) se pueden combinar con un mol de ácido sulfúrico (H 2 SO 4) para formar dos moles de agua y un mol de sulfato de sodio .
- 2NaOH + H 2 SO 4 → 2 H2O + Na 2 SO 4
Definición de Brønsted-Lowry
La definición de Brønsted-Lowry, formulado de forma independiente por sus dos defensores Johannes Nicolaus Brønsted y Martin Lowry en 1923 se basa en la idea de protonación de bases a través de la de-protonación de ácidos - más comúnmente conocida como la capacidad de los ácidos a "donar" iones hidrógeno (H +) o protones a las bases, que "aceptar" de ellos. En contraste con la definición de Arrhenius, la definición de Brönsted-Lowry se refiere a los productos de una reacción ácido-base como ácidos y bases conjugadas para referirse a la relación de un protón, y para indicar que se ha producido una reacción entre las dos cantidades, en lugar de una "formación" de sal y agua, como se explica en la definición de Arrhenius.
Se define que en las reacciones, no es la donación y la recepción de un protón, que se refiere esencialmente a la eliminación de un ion hidrógeno unido dentro de un compuesto y su reacción con otro compuesto, y no de la eliminación de un protón del núcleo de un átomo , lo que requeriría enormes cantidades de energía no alcanzables a través del simple disociación de ácidos. En la diferenciación de la Definición de Arrhenius, la definición de Brönsted-Lowry postula que para cada ácido, no es un ácido conjugado y la base o "par ácido-base conjugada" que se forma a través de una reacción completa, que también incluye agua, que es anfótero:
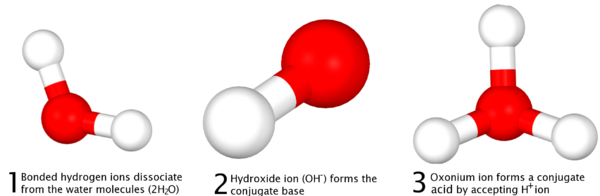
|
Definición de Lewis
La definición de Lewis de las reacciones ácido-base, ideado por Gilbert N. Lewis en 1923 es una teoría abarca a las definiciones de Brönsted-Lowry y del sistema disolvente con respecto a la premisa de un mecanismo de donación, que atribuye a la inversa de la donación de pares de electrones a partir de bases y la aceptación por los ácidos, en lugar de protones o otras sustancias y abarca tanto las reacciones acuosas y no acuosas unidas.
- Ag + + 2: NH3 → [H 3 N: Ag: NH 3] +
- Un catión plata reacciona como un ácido con amoniaco que actúa como un donante de par de electrones, formando un aducto de amoniaco y plata
En reacciones entre Ácidos de Lewis y bases, se produce la formación de un aducto cuando el ocupado más alto molecular orbital ( HOMO) de una molécula, tal como NH 3 con un par de electrones solitario disponible (s) dona pares solitarios de electrones de la molécula deficiente en electrones molecular desocupado más bajo orbital ( LUMO) a través de una enlace covalente coordinado; en tal reacción, la molécula que interactúa con HOMO actúa como una base, y la molécula de interacción LUMO actúa como un ácido. En las moléculas altamente polares, tales como el boro Tri-fluoruro (BF 3), el más elemento electronegativo tira de electrones hacia sus propios orbitales, proporcionando una carga más positiva sobre el elemento menos electronegativo-y una diferencia en su estructura electrónica debido a la posiciones axial o ecuatorial en órbita de sus electrones, causando efectos repulsivos de par solitario par de unión (Lp -Bp) las interacciones entre átomos unidos por encima de las ya previstas por par Bonding lazos de pareja (Bp-BP) interacciones. Aductos que implican iones metálicos se conocen como compuestos de coordinación.
Definición-sistema de disolvente
Esta definición se basa en una generalización de la anterior definición de Arrhenius a todos los disolventes autodissociating. En todos estos disolventes hay una cierta concentración de una especie positivas, cationes solvonium y especies negativas, aniones solvato, en equilibrio con las moléculas de disolvente neutros. Por ejemplo:
- 2H 2 O ⇌ H 3 O + ( hidronio) + OH - ( hidróxido )
- 2NH 3 ⇌ NH 4 + ( amonio) + NH 2 - ( amida)
o incluso algunos sistemas apróticos
- N 2 O 4 ⇌ NO + ( nitrosonio) + NO 3 - ( nitrato )
- 2SbCl 3 ⇌ SBCL 2 + (dichloroantimonium) + SBCL 4 - (tetrachloroantimonate)
Un soluto causando un aumento en la concentración de los iones solvonium y una disminución de los iones de solvato es un ácido y una causando la inversa es una base. Por lo tanto, en el líquido de amoníaco , KNH 2 (el suministro de NH 2 -) es una base fuerte, y NH 4 NO 3 (suministro de NH 4 +) es un ácido fuerte. En líquido dióxido de azufre (SO 2), compuestos de tionilo (suministro de SO 2 +) se comportan como ácidos, y sulfitos (que suministran SO 3 2-) se comportan como bases.
Estas son algunas de las reacciones ácido-base no acuosas en amoníaco líquido
- 2NaNH 2 (base) + Zn (NH 2) 2 ( amida anfífila) → Na 2 [Zn (NH 2) 4]
- 2NH 4 I (ácido) + Zn (NH 2) 2 ( amida anfífila) → [Zn (NH3) 4)] I 2
El ácido nítrico puede ser una base en ácido sulfúrico líquido:
- HNO 3 (base) + 2H 2 SO 4 → NO 2 + + H 3 O + + 2HSO 4 -
Y las cosas se vuelven aún más extraño en el mundo aprótico, por ejemplo, en N2 líquido O 4:
- AgNO3 (base) + NOCl (ácido) → N 2 O 4 + AgCl
Desde definición-sistema de disolvente depende del disolvente, así como en el propio compuesto, el mismo compuesto puede cambiar su función dependiendo de la elección del disolvente. Por lo tanto, HClO 4 es un ácido fuerte en agua, un ácido débil en ácido acético, y una base débil en ácido fluorosulfónico.
Otras teorías ácido-base
Definición Usanovich
La definición más general es que de la químico ruso Mikhail Usanovich, y básicamente se puede resumir como la definición de un ácido como cualquier cosa que acepta especies negativas o dona los positivos, y una base como a la inversa. Esto tiende a superponerse el concepto de redox (oxidación-reducción), y así no es altamente favorecida por los químicos. Esto se debe a las reacciones redox se centran más en los procesos de transferencia de electrones físicos, en lugar de la toma de bonos / procesos de bonos romper, aunque la distinción entre estos dos procesos es un tanto ambigua.
Definición Lux-Flood
Esta definición, propuesta por el químico alemán Hermann Lux en 1939 , mejoró aún más por Circa Håkon Flood 1947 y ahora se utiliza comúnmente en la moderna geoquímica y electroquímica de sales fundidas, describe un ácido como un aceptor de iones óxido y una base como un donador de iones óxido. Por ejemplo:
- MgO (base) + CO2 (ácido) → MgCO3
- CaO (base) + SiO2 (ácido) → CaSiO3
- NO 3 - (base) + S 2 O 7 2- (ácido) → NO 2 + + 2SO 4 2-
Definición Pearson
En 1963 Ralph Pearson propuso un concepto cualitativo avanzado conocido como Principio duro Base ácido suave, más tarde hizo cuantitativa con ayuda de Robert Parr en 1984 . 'Hard' se aplica a las especies que son pequeños, tienen estados de alta carga, y son débilmente polarizables. 'Suave' se aplica a las especies que son grandes, tienen estados de baja carga y están fuertemente polarizable. Ácidos y bases interactúan y las interacciones más estables son duro duro y blando-blando. Esta teoría ha encontrado uso en la química orgánica e inorgánica.

