
El sulfato de sodio
Acerca de este escuelas selección Wikipedia
Este contenido de Wikipedia ha sido seleccionada por SOS para su utilización en las escuelas de todo el mundo. Madres SOS cada aspecto después de un una familia de niños apadrinados .
| El sulfato de sodio | |
|---|---|
 |  |
Otros nombres Thenardita (mineral) | |
| Identificadores | |
| CAS | 7757-82-6 7727-73-3 (decahidrato) |
| PubChem | 24436 |
| Propiedades físicas | 22844 |
| UNII | 36KCS0R750 |
| ChEBI | CHEBI: 32149 |
| ChEMBL | CHEMBL233406 |
| Número RTECS | WE1650000 |
| Código ATC | A06 A12 CA02 |
| Imágenes-Jmol 3D | Image 1 |
SONRISAS
| |
InChI
| |
| Propiedades | |
| Fórmula molecular | Na 2 SO 4 |
| Masa molar | 142,04 g / mol (anhidro) 322,20 g / mol (decahidrato) |
| Apariencia | sólido cristalino blanco higroscópico |
| Olor | inodoro |
| Densidad | 2,664 g / cm 3 (anhidro) 1,464 g / cm 3 (decahidrato) |
| Punto de fusion | 884 ° C (anhidro) |
| Punto de ebullicion | 1429 ° C (anhidro) |
| Solubilidad en agua | anhidro: 4,76 g / 100 ml (0 ° C) 42,7 g / 100 ml (100 ° C) heptahidratado: 19.5 g / 100 ml (0 ° C) 44 g / 100 ml (20 ° C) |
| Solubilidad | insoluble en etanol soluble en glicerol y yoduro de hidrógeno |
| Índice de refracción (n D) | 1.468 (anhidro) 1.394 (decahidrato) |
| Estructura | |
| Estructura cristalina | ortorrómbica o hexagonal (anhidro) monoclínico (decahidrato) |
| Peligros | |
| MSDS | MSDS externa |
| Índice de la UE | No enlistado |
| Principal peligros | Irritante |
| NFPA 704 |  0 1 0 |
| Punto de inflamabilidad | No es inflamable |
| Compuestos relacionados | |
| Otros aniones | Selenato de sodio Telurato sodio |
| Otros cationes | Sulfato de litio El sulfato de potasio Sulfato de rubidio Sulfato de cesio |
| Compuestos relacionados | Bisulfato de sodio Sulfito de sodio Persulfato de sodio |
| Página de datos complementaria | |
| Estructura y propiedades | n, ε r, etc. |
| Termodinámica datos | Comportamiento de fase Sólido, líquido, gas |
| Los datos espectrales | UV, IR, RMN , MS |
Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
El sulfato de sodio es el sodio sal de ácido sulfúrico . Cuando anhidro, es un sólido blanco cristalino de fórmula Na 2 SO 4 conocido como el mineral tenardita; la decahidrato Na 2 SO 4 · 10H 2 O ha sido conocido como sal de Glauber o, históricamente, mirabilis sal desde el siglo 17. Otra sólida es la heptahidratado, que transforma a Mirabilite cuando se enfría. Con una producción anual de 6 millones toneladas, es un importante producto químico de los productos básicos.
El sulfato de sodio se utiliza principalmente para la fabricación de detergentes y en la Proceso Kraft de papel fabricación de pasta. Alrededor de dos tercios de la producción mundial es de mirabilita, lo natural mineral forma de decahidrato, y el resto de los subproductos de procesos químicos, tales como ácido clorhídrico producción.
Historia
El hidrato de sulfato de sodio se conoce como sal de Glauber después de que el holandés / alemán químico y boticario Johann Rudolf Glauber (1604-1670), que lo descubrió en 1625 en agua de manantial de Austria. Él lo nombró mirabilis sal (sal milagrosa), debido a sus propiedades medicinales: los cristales se utiliza como un propósito general laxante, hasta alternativas más sofisticadas se produjo en la década de 1900.
En el siglo 18, la sal de Glauber comenzó a ser utilizado como materia prima para la la producción industrial de carbonato de sodio ( carbonato de sodio), por reacción con potasa ( carbonato de potasio). La demanda de carbonato de sodio aumentado y suministro de sulfato de sodio tenido que aumentar en línea. Por lo tanto, en el siglo XIX, la gran escala Proceso Leblanc, produciendo sulfato de sodio sintético como un intermediario clave, se convirtió en el principal método de producción de carbonato de sodio.
Propiedades físicas y químicas
El sulfato de sodio es químicamente muy estable, siendo no reactivo hacia la mayor parte oxidantes o agentes reductores a temperaturas normales. A altas temperaturas, que se puede convertir en sulfuro de sodio por reducción carbotérmica:
- Na 2 SO 4 + 2 C → Na 2 S + 2 CO 2
Ácido-base
El sulfato de sodio es un neutral sal, que forma soluciones acuosas con pH de 7. La neutralidad de tales soluciones refleja el hecho de que el sulfato se deriva, formalmente, a partir del ácido fuerte ácido sulfúrico . Además, el ion Na +, con una única carga positiva, sólo débilmente polariza sus ligandos de agua. El sulfato de sodio reacciona con el ácido sulfúrico para dar el sal de ácido bisulfato de sodio:
- Na 2 SO 4 + H 2 SO 4 ⇌ 2 NaHSO4
La constante de equilibrio para este proceso depende de concentración y temperatura.
Solución e intercambio iónico
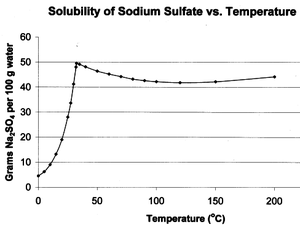
Sulfato de sodio tiene características de solubilidad inusuales en el agua. Su solubilidad en agua se eleva más de diez veces entre 0 ° C a 32.384 ° C, donde alcanza un máximo de 497 g / L. En este punto, la curva de solubilidad cambios de pendiente, y la solubilidad llega a ser casi independiente de la temperatura. Esta temperatura a 32.384 ° C, correspondiente a la liberación de agua de cristalización y de fusión de la sal hidratada, sirve como una referencia precisa de la temperatura de termómetro de calibración.
Sulfato de sodio es un típico iónica sulfato, que contiene iones Na + y SO 4 2- iones. La existencia de sulfato en solución está indicada por la fácil formación de sulfatos insolubles cuando estas soluciones se tratan con Ba 2+ o Pb 2+ sales:
- Na 2 SO 4 + BaCl 2 → 2 NaCl + BaSO4
El sulfato de sodio muestra una tendencia moderada para formar sales dobles. El único alumbres formadas con metales trivalentes comunes son NaAL (SO 4) 2 (inestable por encima de 39 ° C) y NACR (SO 4) 2, en contraste con sulfato de potasio y sulfato de amonio que forman muchos alumbres estables. Sales dobles con algunos otros sulfatos de metales alcalinos son conocidos, incluyendo Na 2 SO 4 · 3K 2 SO 4, que se produce naturalmente como el mineral glaserita. Formación de glaserita por reacción de sulfato de sodio con cloruro de potasio se ha utilizado como la base de un método para producir sulfato de potasio, un fertilizante . Otras sales dobles incluyen 3Na 2 SO 4 · CaSO4, 3Na 2 SO 4 · MgSO4 ( vanthoffite) y NaF · Na 2 SO 4.
Estructura
Los cristales consisten en [Na (OH 2) 6] + iones con geometría molecular octaédrica, como se ve por muchos sales de sulfato metálico. Estos cationes están vinculados a los aniones de sulfato a través enlaces de hidrógeno. Las distancias Na-S son 240 pm. Dos moléculas de agua por unidad de fórmula no se coordinan para Na +. Crystalline decahidrato de sulfato de sodio también es inusual entre sales hidratadas en tener un medible entropía residual (entropía en el cero absoluto ) de 6,32 J · K -1 mol -1. Esto se atribuye a su capacidad para distribuir el agua mucho más rápidamente en comparación a la mayoría de hidratos.
Producción
La producción mundial de sulfato de sodio, principalmente en la forma de la decahidrato asciende a aproximadamente 5,5 hasta 6 millones de toneladas anuales (Mt / a). En 1985, la producción fue de 4,5 Mt / a, la mitad a partir de fuentes naturales, y la mitad de la producción química. Después de 2000, en un nivel estable hasta 2006, la producción natural había aumentado a 4 Mt / a, y la producción de sustancias químicas disminuyó a 1.5 a 2 Mt / a, con un total de 5,5-6 Mt / a. Para todas las aplicaciones, producido naturalmente y sulfato de sodio producido químicamente son prácticamente intercambiables.
Industria química
Aproximadamente un tercio de sulfato de sodio en el mundo se produce como subproducto de otros procesos en la industria química. La mayor parte de esta producción es inherente químicamente al proceso de primarias, y sólo marginalmente económica. Por el esfuerzo de la industria, por lo tanto, la producción de sulfato de sodio como subproducto está disminuyendo.
El más importante de producción de sulfato de sodio durante químico es ácido clorhídrico producción, ya sea a partir de cloruro de sodio (sal) y ácido sulfúrico , en el Proceso Mannheim, o desde dióxido de azufre en el Proceso Hargreaves. El sulfato de sodio resultante de estos procesos son conocidos como torta de sal.
- Mannheim: 2 NaCl + H 2 SO 4 → 2 HCl + Na 2 SO 4
- Hargreaves: 4 NaCl + 2 SO 2 + O 2 + 2 H 2 O → 4 HCl + 2 Na 2 SO 4
La segunda gran producción de sulfato de sodio son los procesos en los que el exceso de ácido sulfúrico es neutralizado por hidróxido de sodio , tal como se aplica en gran escala en la producción de rayón. Este método es también una preparación de laboratorio aplicado de forma regular y conveniente.
- 2 NaOH ( ac) + H 2 SO 4 (ac) → Na 2 SO 4 (aq) + 2 H2O ( l )
En el laboratorio también puede ser sintetizado a partir de la reacción entre bicarbonato de sodio y sulfato de magnesio.
- 2NaHCO 3 + MgSO4 → Na 2 SO 4 + Mg (OH) 2 + 2CO 2
Anteriormente, sulfato de sodio era también un subproducto de la fabricación de dicromato de sodio, en donde se añade ácido sulfúrico a la solución de cromato de sodio formación de dicromato de sodio, o ácido crómico posteriormente. Alternativamente, se efectúa o se forma sulfato de sodio en la producción de carbonato de litio, agentes quelantes, resorcinol, ácido ascórbico, sílice pigmentos, ácido nítrico , y fenol .
Sulfato de sodio a granel generalmente se purificó por medio de la forma decahidrato, ya que la forma anhidra tiende a atraer hierro compuestos y compuestos orgánicos . La forma anhidra se produce fácilmente de la forma hidratada por calentamiento suave.
Sulfato de sodio Major subproducto productores de 50-80 Mt / a en 2006 incluyen Elementis Cromo (industria cromo, Castle Hayne, Carolina del Norte, Estados Unidos), Lenzing AG (200 Mt / a, la industria de rayón, Lenzing, Austria), Addiseo (anteriormente Rhodia, industria de la metionina, Les Roches-Roussillon, Francia), Elementis (industria cromo, Stockton-on-Tees, Reino Unido), Shikoku Químicos (Tokushima, Japón) y Visko-R (industria del rayón, Rusia).
Aplicaciones
Industrias de productos básicos
Con los precios de EE.UU. a 30 dólares por tonelada en 1970, en 2006 hasta US $ 90 por tonelada de la calidad de la torta de sal y de $ 130 para mejores calificaciones, sulfato de sodio es un material muy barato. El uso más grande es como relleno en la ropa de casa en polvo detergentes, consumiendo aproximadamente. 50% de la producción mundial. Este uso está disminuyendo ya que los consumidores domésticos se están cambiando cada vez más para compactar o detergentes líquidos que no incluyen sulfato de sodio.
Otro uso importante antes de sulfato de sodio, sobre todo en los EE.UU. y Canadá, se encuentra en la Proceso Kraft para la fabricación de pulpa de madera. Organics presentes en el "licor negro" de este proceso se queman para producir calor, necesaria para impulsar el la reducción de sulfato de sodio para sulfuro de sodio. Sin embargo, este proceso está siendo reemplazado por los procesos nuevos; uso de sulfato de sodio en los EE.UU. y la industria canadiense de pulpa disminuyó de 1,4 Mt / a en 1970 a sólo aprox. 150 000 toneladas en 2006.
El vidrio de la industria ofrece otra aplicación importante para el sulfato de sodio, como segunda aplicación más grande de Europa. El sulfato de sodio se usa como una agente clarificante, para ayudar a eliminar las pequeñas burbujas de aire de vidrio fundido. Se flujos del vidrio, y evita la formación de escoria de la masa fundida de vidrio durante el refinado. La industria del vidrio en Europa ha estado consumiendo 1970-2006 un establo 110.000 toneladas anuales.
El sulfato de sodio es importante en la fabricación de textiles , particularmente en Japón, donde es la aplicación más grande. El sulfato de sodio ayuda a "nivelación", reduciendo cargas negativas en fibras para que los tintes pueden penetrar uniformemente. A diferencia de la alternativa de cloruro de sodio , no se corroe el recipientes de acero inoxidable utilizados en el teñido. Esta aplicación en Japón y Estados Unidos consume en 2006 aproximadamente 100.000 toneladas.
El almacenamiento térmico
La elevada capacidad de almacenamiento de calor en el cambio de fase de sólido a líquido, y la temperatura de cambio de fase ventajosa de 32 ° C (90 ° F) hace que este material especialmente apropiado para el almacenamiento de calor solar de bajo grado para su posterior liberación en aplicaciones de calefacción ambiental. En algunas aplicaciones el material se incorpora en baldosas térmicas que se colocan en un espacio del ático mientras que en otras aplicaciones de la sal se incorpora en las células rodeadas de agua calentada con energía solar. El cambio de fase permite una reducción sustancial de la masa del material requerido para el almacenamiento de calor eficaz (el calor de fusión de decahidrato de sulfato de sodio es 25,53 kJ / mol o alrededor de 19 cal / g), con la ventaja adicional de una consistencia de la temperatura como larga como material suficiente en la fase apropiada está disponible.
Aplicaciones a pequeña escala
En el laboratorio, sulfato de sodio anhidro se usa ampliamente como un material inerte agente de secado, para eliminar trazas de agua a partir de soluciones orgánicas. Es más eficiente, pero más lento de acción, que el agente similar sulfato de magnesio. Sólo es eficaz por debajo de aproximadamente 30 ° C, pero puede ser utilizado con una variedad de materiales, ya que es químicamente bastante inerte. El sulfato de sodio se añade a la solución hasta que los cristales ya no se agrupan; los dos clips de vídeo (véase más arriba) muestran cómo los cristales se agrupan cuando todavía húmeda, pero algunos cristales fluyen libremente una vez que una muestra está seca.
Sal de Glauber, el decahidrato, fue utilizado históricamente como una laxante. Es eficaz para la eliminación de ciertos fármacos como acetaminofén del cuerpo, por ejemplo, después de una sobredosis.
En 1953, el sulfato de sodio fue propuesto por el calor de almacenamiento en pasivo sistemas de calefacción solar. Esto se aprovecha de sus propiedades de solubilidad inusuales, y el alto calor de cristalización (78,2 kJ / mol).
Otros usos de sulfato de sodio incluyen ventanas de-merengue, en ambientadores alfombras, la industria del almidón, y como un aditivo para la alimentación del ganado.
Últimamente, sulfato de sodio se ha encontrado eficaz en la disolución de oro micrómetro muy finamente electroplated que se encuentra en hardware electroplated oro en productos electrónicos, tales como alfileres y otros conectores e interruptores. Es más seguro y más barato que otros reactivos utilizados para la recuperación de oro, con poca preocupación por las reacciones adversas o efectos sobre la salud.
Al menos una empresa, ThermalTake, hace un chill mat ordenador portátil (iXoft Notebook Cooler) con sulfato de sodio decahidratado dentro de una almohadilla de plástico acolchado. El material se vuelve lentamente a líquido y recircula, igualando la temperatura portátil y que actúa como un aislante.
Seguridad
Aunque sulfato de sodio es generalmente considerado como no tóxico, debe manejarse con cuidado. El polvo puede causar asma temporal o irritación de los ojos; este riesgo se puede prevenir mediante el uso de protección para los ojos y una máscara de papel. El transporte no está limitada, y no Frase de riesgo o Aplica Frase de Seguridad.

