
Ácido acético
Acerca de este escuelas selección Wikipedia
Esta selección Wikipedia está disponible sin conexión de SOS Children para su distribución en el mundo en desarrollo. El patrocinio de los niños ayuda a los niños en el mundo en desarrollo para aprender también.
| Ácido acético | |
|---|---|
 |  |
El ácido acético, ácido acético | |
Otros nombres Acetil hidróxido (AcOH), acetato de hidrógeno (HAc), ácido etílico, ácido methanecarboxylic | |
| Identificadores | |
| CAS | 64-19-7 |
| PubChem | 176 |
InChI
| |
| Propiedades | |
| Fórmula molecular | CH 3 COOH |
| Masa molar | 60.05 g / mol |
| Apariencia | Líquido o cristales incoloros |
| Densidad | 1,049 g · cm -3 ( l ) 1,266 g · cm -3 ( s ) |
| Punto de fusion | 16.5 ° C (289.6 K, 61,6 ° F) |
| Punto de ebullicion | 118,1 ° C (391,2 K, 244,5 ° F) |
| Solubilidad en agua | Completamente mezclable |
| Acidez (p K a) | 4.76 a 25 ° C |
| Viscosidad | 1.22 mPa · s a 25 ° C |
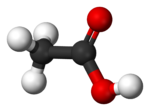
| Estructura | |
| Momento bipolar | 1.74 D (gas) |
| Peligros | |
| MSDS | MSDS externa |
| Frases R | R10, R35 |
| Frases S | (S1 / 2), S23, S26, S45 |
| NFPA 704 |  2 2 2 |
| Punto de inflamabilidad | 43 ° C |
| Compuestos relacionados | |
| Relacionado ácido carboxílico | ácido fórmico , ácido propiónico, ácido butírico |
| Compuestos relacionados | acetamida, acetato de etilo, cloruro de acetilo, anhídrido acético, acetonitrilo, acetaldehído, etanol , ácido tioacético, acetilcolina, acetilcolinesterasa |
| Página de datos complementaria | |
| Estructura y propiedades | n, ε r, etc. |
| Termodinámica datos | Comportamiento de fase Sólido, líquido, gas |
| Los datos espectrales | UV, IR, RMN , MS |
| Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
El ácido acético, también conocido como ácido etanoico, es un compuesto químico orgánico mejor reconocido para dar vinagre su sabor amargo y olor acre. Su fórmula estructural es representado como CH3COOH. Pure, agua exento de ácido acético (ácido acético glacial) es un gas incoloro líquido que atrae el agua desde el medio ambiente ( higrometría), y se congela por debajo de 16,7 ° C (62 ° F) a una incoloro cristalino sólido . Acético ácido es corrosivo , y su vapor causa irritación en los ojos, una nariz seca y ardor, dolor de garganta y congestión de los pulmones. Es un ácido débil porque en temperatura y presión de la norma ácido disociado existe en equilibrio con la forma no disociada en acuosas soluciones , en contraste con ácidos fuertes, que están completamente disociado.
El ácido acético es uno de los más simples ácidos carboxílicos (el segundo más simple, junto a ácido fórmico ). Es un importante reactivo químico y química industrial que se utiliza en la producción de tereftalato de polietileno utilizado principalmente en botellas de refrescos; acetato de celulosa, principalmente para la película fotográfica; y acetato de polivinilo para la madera pegamento, así como fibras sintéticas y tejidos. En los hogares ácido acético diluido se utiliza a menudo en descalcificadores. En el ácido acético industria alimentaria se utiliza bajo la código de aditivo alimentario E260 como una regulador de la acidez.
La demanda mundial de ácido acético es de alrededor de 6,5 millones de toneladas anuales (Mt / a), de los cuales aproximadamente 1,5 Mt / a se encuentra con el reciclaje; el resto se fabrica a partir de materias primas petroquímicas o de fuentes biológicas.
Nomenclatura
La ácido acético nombre trivial es el nombre más comúnmente usado y oficialmente preferido por el IUPAC. Este nombre deriva de acetum, el latín palabra para el vinagre. El ácido etanoico sinónimo es un nombre sistemático que se utiliza en introducciones a nomenclatura química.
El ácido acético glacial es un nombre trivial para el ácido acético libre de agua. Al igual que el alemán nombre Eisessig (literalmente, hielo y vinagre), el nombre viene de los cristales parecidos al hielo que se forman ligeramente por debajo de la temperatura ambiente a 16,7 ° C (alrededor de 62 ° F).
La abreviatura más común y oficial para el ácido acético es AcOH o HOAC donde Ac representa el acetilo grupo CH 3 -C (= O) - ;. En el contexto de reacciones ácido-base la abreviatura HAc se utiliza a menudo en lugar donde Ac representa el acetato de aniones (CH 3 COO -), aunque este uso es considerado por muchos como engañosa. En cualquier caso, el aire acondicionado no debe confundirse con la abreviatura del elemento químico actinio .
El ácido acético tiene la fórmula empírica CH 2 O y la fórmula molecular C 2 H 4 O 2 o HC 2 H 3 O 2 (para enfatizar el papel del hidrógeno "activa" en la formación de la sal de acetato de sodio). Para reflejar mejor su estructura, el ácido acético se escribe a menudo como CH 3 CO 2 H, CH 3 COOH, CH 3 CO 2 H, o HOCOCH 3. El ion resultante de la pérdida de H + a partir de ácido acético es el anión acetato. El acetato de nombre también puede referirse a un sal que contiene este anión, o una éster de ácido acético.
Historia

El vinagre es al menos tan antigua como la civilización. Bacterias productoras de ácido acético están presentes en todo el mundo, y la práctica de la culturas elaboración de la cerveza de la cerveza o el vino descubrió inevitablemente vinagre como el resultado natural de su exposición al aire.
El uso de ácido acético en la alquimia se extiende en la antigüedad. En el siglo tercero antes de Cristo, el griego filósofo Teofrasto describió cómo el vinagre actúa sobre los metales para producir pigmentos útiles en el arte, incluyendo el blanco de plomo ( carbonato de plomo) y cardenillo, una mezcla verde de cobre sales incluyendo acetato de cobre (II). Los antiguos romanos hervido agrió vino en vasijas de plomo para producir un jarabe muy dulce llamado sapa. Sapa era rica en acetato de plomo, una sustancia dulce también llamada azúcar de plomo o azúcar de Saturno, lo que contribuyó a envenenamiento por plomo entre la aristocracia romana.
En el siglo octavo, el Alquimista musulmán Jabir Ibn Hayyan (Geber) fue el primero en concentrar ácido acético del vinagre a través de la destilación . En el Renacimiento , ácido acético glacial se preparó a través de la destilación seca de acetatos de metal. El siglo 16 alemán alquimista Andreas Libavius describe un procedimiento de este tipo, y comparó el ácido acético glacial producido por este medio a vinagre. La presencia de agua en el vinagre tiene un efecto tan profundo en las propiedades del ácido acético que durante siglos los químicos creían que el ácido acético glacial y el ácido que se encuentra en el vinagre eran dos sustancias diferentes. El químico francés Pierre Adet ellos resultó ser idéntica.
En 1847 el químico alemán Hermann Kolbe sintetizada de ácido acético a partir de inorgánicos materiales para la primera vez. Esta secuencia de reacción consistió de cloración de disulfuro de carbono para el tetracloruro de carbono , seguido de pirólisis de tetracloroetileno y cloración acuosa para ácido tricloroacético, y concluyó con electrolítica reducción a ácido acético.

Por 1910 más ácido acético glacial se obtuvo de la "licor piroleñoso" de la destilación de madera. El ácido acético se aisló de este por el tratamiento con lechada de cal, y el resultante a continuación, acetato de calcio se acidificó con ácido sulfúrico para recuperar el ácido acético. En este momento Alemania estaba produciendo 10.000 toneladas de ácido acético glacial, alrededor del 30% de los cuales se utilizan para la fabricación de tinte índigo.
Propiedades químicas
El hidrógeno (H) átomo en el grupo carboxilo (-COOH) en ácidos carboxílicos tales como ácido acético se puede emitir como un ion H + ( protón ), dándoles su carácter ácido. El ácido acético es un débil, efectivamente ácido monoprótico en solución acuosa, con una pK un valor de 4,8. Su base conjugada es acetato (CH 3 COO -). Un 1,0 Solución de M (acerca de la concentración de vinagre doméstico) tiene un pH de 2,4, lo que indica que sólo el 0,4% de las moléculas de ácido acético se disocian.


La estructura cristalina de ácido acético muestra que las moléculas se emparejan en dímeros unidos por enlaces de hidrógeno. Los dímeros también pueden detectarse en el vapor a 120 ° C. Ellos también se producen en la fase líquida en soluciones diluidas en disolventes no de enlaces de hidrógeno, y en cierta medida en ácido acético puro, pero se interrumpen por disolventes de enlaces de hidrógeno. La entalpía de disociación del dímero se estima en 65,0 a 66,0 kJ / mol, y la entropía de disociación en 154-157 J mol -1 K -1. Este comportamiento dimerización es compartida por otros ácidos carboxílicos inferiores.
Líquido ácido acético es una hidrófila ( polar) disolvente prótico, similar a etanol y agua . Con un moderado constante dieléctrica de 6,2, se puede disolver no sólo compuestos polares, tales como sales inorgánicas y azúcares , sino también compuestos no polares tales como aceites y elementos tales como azufre y yodo . Se mezcla fácilmente con otros polares y no polares disolventes tales como agua, cloroformo, y hexano. Este establecimiento situado en la disolución y miscibilidad de ácido acético hace que sea un producto químico industrial utilizado ampliamente.
Reacciones químicas
El ácido acético es corrosivo para los metales incluyendo hierro , magnesio , y zinc , formando de hidrógeno gas y las sales de metal llamados acetatos. de aluminio , cuando se expone al oxígeno, se forma una fina capa de óxido de aluminio en su superficie que es relativamente resistente, de manera que los tanques de aluminio pueden ser utilizados para el transporte de ácido acético. Acetatos de metal también se pueden preparar a partir de ácido acético y un apropiado base, como en el popular " bicarbonato de sodio + vinagre de reacción ". Con la notable excepción de cromo (II) acetato de etilo, casi todos los acetatos son solubles en agua.
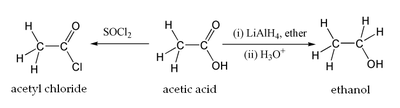
El ácido acético se somete a las típicas reacciones químicas de un ácido carboxílico , como el agua y la producción de un metal etanoato al reaccionar con álcalis, produciendo un etanoato de metal cuando se hace reaccionar con un metal, y produciendo una etanoato de metal, agua y dióxido de carbono al reaccionar con los carbonatos y bicarbonatos. Lo más notable de todos sus reacciones es la formación de etanol por reducción, y la formación de derivados tales como cloruro de acetilo a través de sustitución nucleofílica de acilo. Otros incluyen derivados de sustitución anhídrido acético; este anhídrido es producido por pérdida de agua a partir de dos moléculas de ácido acético. Ésteres del ácido acético De la misma manera se pueden formar a través de Esterificación de Fischer, y amidas también se pueden formar. Cuando se calienta por encima de 440 ° C, el ácido acético se descompone para producir dióxido de carbono y metano , o para producir cetona y agua.
El ácido acético se puede detectar por su olor característico. La reacción de color para las sales de ácido acético es cloruro de hierro (III) solución, lo que resulta en un color rojo profundo que desaparece después de la acidificación. Acetatos cuando se calienta con forma trióxido de arsénico óxido de cacodilo, que puede ser detectada por su vapores malolientes.
Producción

El ácido acético se produce sintéticamente y por tanto bacteriana fermentación. Hoy en día, la ruta biológica representa sólo alrededor del 10% de la producción mundial, pero sigue siendo importante para la producción de vinagre, como las leyes de pureza alimentaria mundial estipulan que el vinagre se utiliza en los alimentos debe ser de origen biológico. Alrededor del 75% de ácido acético hecho para el uso en la industria química se realiza mediante carbonilación de metanol, se explica a continuación. Métodos alternativos representan el resto.
La producción total mundial de ácido acético virgen se estima en 5 Mt / a (millones de toneladas por año), aproximadamente la mitad de la que se produce en el Estados Unidos . europea de producción es de aproximadamente 1 Mt / a, y está disminuyendo, y 0,7 Mt / a se produce en Japón . Otro 1,5 Mt se reciclan cada año, con lo que el mercado total mundial de 6,5 Mt / a. Los dos mayores productores de ácido acético virgen son Celanese y BP Chemicals . Otros productores importantes son Millennium Chemicals, Sterling Chemicals, Samsung, Eastman, y Svensk Etanolkemi.
Carbonilación del metanol
La mayor parte de ácido acético virgen es producido por carbonilación de metanol. En este proceso, metanol y monóxido de carbono reaccionan para producir ácido acético de acuerdo con la ecuación química:
- CH 3 OH + CO → CH3COOH
El proceso implica yodometano como un producto intermedio, y se produce en tres pasos. Un catalizador , generalmente un metal complejo, se necesita para la carbonilación (paso 2).
- (1) CH3OH + HI → CH 3 I + H 2 O
- (2) CH 3 I + CO → CH 3 COI
- (3) CH 3 COI + H2O → CH3COOH + HI
Al alterar las condiciones del proceso, anhídrido acético también se puede producir en la misma planta. Debido a que tanto el metanol y el monóxido de carbono son materias primas de los productos básicos, carbonilación del metanol a largo parecía ser un método atractivo para la producción de ácido acético. Henry Drefyus en British Celanese desarrollado una planta piloto de carbonilación de metanol ya en 1925. Sin embargo, la falta de materiales prácticos que podrían contener la mezcla de reacción corrosiva en la escuela presiones necesarias (200 atm o más) desalentado comercialización de estas rutas. El primer proceso de carbonilación de metanol comercial, que utilizó un cobalto catalizador, fue desarrollado por la compañía química alemana BASF en 1963. En 1968, una de rodio basado en catalizador (cis - [Rh (CO) 2 I 2] -) se descubrió que podría operar eficientemente a menor presión casi sin subproductos. La primera planta de esta reacción fue construido por la empresa química de Estados Unidos Monsanto en 1970, y rodio-catalizada metanol carbonilación se convirtió en el método dominante de la producción de ácido acético (ver Proceso de Monsanto). A finales de 1990, la empresa de productos químicos BP Chemicals comercializa la Catalizador Cativa ([Ir (CO) 2 I 2] -), promovido por el rutenio . Este iridio proceso -catalysed es más verde y más eficiente y ha suplantado en gran medida el proceso de Monsanto, a menudo en las mismas plantas de producción.
Oxidación del acetaldehído
Antes de la comercialización del proceso Monsanto, la mayor parte del ácido acético se produce por oxidación de acetaldehído. Este sigue siendo el segundo método de fabricación más importante, aunque no es competitiva con carbonilación del metanol. El acetaldehído se puede producir a través de oxidación de butano o nafta ligera, o por hidratación de etileno.
Cuando butano o luz nafta se calienta con aire en presencia de diversos metales iones , incluyendo los de manganeso , cobalto y cromo ; peróxidos y formulario y luego se descomponen para producir ácido acético de acuerdo con el ecuación química
- 2 C 4 H 10 + 5 O 2 → 4 CH3COOH + 2 H 2 O
Típicamente, la reacción se realiza a una combinación de temperatura y presión diseñado para ser tan caliente como sea posible mientras mantiene el butano líquido. Condiciones de reacción típicas son 150 ° C y 55 atm. Productos secundarios también pueden formar, incluyendo butanona, acetato de etilo, ácido fórmico , y ácido propiónico. Estos productos secundarios son también de gran valor comercial, y las condiciones de reacción pueden ser alterados para producir más de ellos si esto es económicamente útil. Sin embargo, la separación de ácido acético a partir de estos subproductos se añade al coste del proceso.
En condiciones similares y utilizando similares catalizadores que se utilizan para la oxidación de butano, acetaldehído puede ser oxidado por el oxígeno en el aire para producir ácido acético
- 2 CH 3 CHO + O 2 → 2 CH3COOH
El uso de catalizadores modernos, esta reacción puede tener dió un ácido acético mayor que 95%. Los productos secundarios principales son acetato de etilo, ácido fórmico , y formaldehído, todos los cuales tienen bajos puntos de ebullición que el ácido acético y se separan fácilmente por destilación .
Oxidación de etileno
El acetaldehído puede preparar a partir de etileno a través de la Proceso Wacker, y luego oxidado como anteriormente. Más recientemente una conversión de una sola etapa más barato de etileno a ácido acético fue comercializado por la empresa química Showa Denko, que abrió una planta de oxidación de etileno en Oita, Japón , en 1997. El proceso se cataliza por una paladio catalizador de metal soportado sobre una heteropoliácido como ácido tungstosilícico. Se cree que ser competitivo con la carbonilación de metanol para plantas más pequeñas (100-250 kt / a), dependiendo del precio local de etileno.
Fermentación oxidativa
Para la mayor parte de la historia humana, el ácido acético, en forma de vinagre, se ha hecho por bacterias del ácido acético del género Acetobacter. Dada oxígeno suficiente, estas bacterias pueden producir vinagre de una variedad de productos alimenticios alcohólicas. Alimentos usados comúnmente incluyen sidra de manzana , vino , y fermentado de cereales , malta, arroz o patata purés. La reacción química global facilitado por estas bacterias es:
- C 2 H 5 OH + O 2 → CH3COOH + H2O
Una solución de alcohol diluido inoculados con Acetobacter y se mantiene en un lugar bien ventilado caliente se convertirá en vinagre en el transcurso de unos pocos meses. Métodos de vinagre de decisiones industriales acelerar este proceso por mejorar el suministro de oxígeno a las bacterias.
Los primeros lotes de vinagre producidos por fermentación probablemente siguieron errores en el proceso de elaboración del vino. Si mosto se fermenta a una temperatura demasiado alta, acetobacter abrumará la levadura natural en el uvas. Como la demanda de vinagre con fines culinarios, médicas y sanitarias aumento, viticultores aprendieron rápidamente a utilizar otros materiales orgánicos para producir vinagre en los calurosos meses de verano antes de las uvas estaban maduras y listas para su transformación en vino. Este método era lento, sin embargo, y no siempre con éxito, ya que los viticultores no entendían el proceso.
Uno de los primeros procesos comerciales modernos fue el "método rápido" o "método alemán", primero se practica en Alemania en 1823. En este proceso, la fermentación se lleva a cabo en una torre llena de virutas de madera o carbón vegetal. La alimentación que contiene alcohol se goteó en la parte superior de la torre, y fresco aire suministrado desde la parte inferior por ya sea natural o forzada convección. El suministro de aire mejorado en este proceso redujo el tiempo para preparar vinagre de meses a semanas.
La mayor parte de vinagre de hoy se hace en depósito sumergido cultura, descrita por primera vez en 1949 por Otto Hromatka y Heinrich Ebner. En este método, el alcohol se fermenta a vinagre en un tanque agitado de forma continua, y el oxígeno se suministra mediante burbujeo de aire a través de la solución. Utilización de las aplicaciones modernas de este método, el vinagre de ácido acético 15% se puede preparar en sólo 24 horas en procesos por lotes, incluso 20% en 60 h de proceso discontinuo alimentado.
La fermentación anaeróbica
Las especies de bacterias anaerobias, incluyendo miembros del género Clostridium, puede convertir azúcares en ácido acético directamente, sin el uso de etanol como producto intermedio. La reacción química global llevada a cabo por estas bacterias puede representarse como:
- C 6 H 12 O 6 → 3 CH 3 COOH
Más interesante desde el punto de vista de un químico industrial, estos bacterias acetogénicas pueden producir ácido acético a partir de compuestos de un solo carbono, incluyendo metanol , monóxido de carbono , o una mezcla de dióxido de carbono y de hidrógeno :
- 2 CO 2 + 4 H 2 → CH3COOH + 2 H 2 O
Esta capacidad de Clostridium de utilizar los azúcares directamente, o para producir ácido acético a partir de las entradas menos costosos, significa que estas bacterias podrían potencialmente producir ácido acético de manera más eficiente que el etanol-oxidantes como Acetobacter. Sin embargo, las bacterias Clostridium son menos ácido tolerantes que Acetobacter. Incluso las cepas de Clostridium más tolerantes a ácido pueden producir vinagre de sólo unos pocos ácido acético por ciento, en comparación con las cepas de Acetobacter que pueden producir vinagre de ácido acético hasta un 20%. En la actualidad, sigue siendo más rentable para producir vinagre de uso de Acetobacter que producir usando Clostridium y luego concentrarla. Como resultado, aunque las bacterias acetogénicas se conocen desde 1940, su uso industrial sigue confinada a unas pocas aplicaciones de nicho.
Aplicaciones

El ácido acético es un producto químico reactivo para la producción de compuestos químicos. El uso individual más grande de ácido acético es en la producción de acetato de vinilo monómero, seguido de cerca por el anhídrido acético y la producción de ésteres. El volumen de ácido acético utilizado en el vinagre es comparativamente pequeño.
Acetato de vinilo monómero
El principal uso de ácido acético es para la producción de monómero de acetato de vinilo (VAM). Esta aplicación consume aproximadamente 40% a 45% de la producción mundial de ácido acético. La reacción es de etileno y ácido acético con oxígeno sobre un paladio catalizador .
- 2 H 3 C-COOH + 2 C 2 H 4 + O 2 → 2 H 3 C-CO-O-CH = CH 2 + 2 H 2 O
El acetato de vinilo se puede polimerizar a acetato de polivinilo o de otra polímeros, que se aplican en pinturas y adhesivos.
Producción Ester
El mayor ésteres de ácido acético se utilizan comúnmente para disolventes tintas, pinturas y recubrimientos. Los ésteres incluyen acetato de etilo, n- acetato de butilo, Acetato de isobutilo, y acetato de propilo. Se producen típicamente por catalizado de reacción de ácido acético y el correspondiente alcohol . : H 3 C-COOH + HO-R → H 3 C-CO-OR + H 2 O, donde R = un general grupo alquilo
La mayoría de los ésteres de acetato, sin embargo, se producen a partir acetaldehído usando el Reacción Tishchenko. Además, acetatos de éter se utilizan como disolventes para nitrocelulosa, lacas acrílicas, removedores de barnices y tintes para la madera. Primeros monoéteres de glicol se producen a partir óxido de etileno o óxido de propileno con alcohol, que luego se esterifica con ácido acético. Los tres principales productos son el etileno acetato de éter monoetílico (EEE), butilglicol etilo (EBA), y acetato de propilenglicol monometil éter (PMA). Esta aplicación consume alrededor de 15% a 20% de ácido acético en todo el mundo. Acetatos de éter, por ejemplo EEE, se ha demostrado que sea nocivo para la reproducción humana.
Anhídrido acético
La producto de condensación de dos moléculas de ácido acético es anhídrido acético. La producción mundial de anhídrido acético es una aplicación importante, y utiliza aproximadamente 25% a 30% de la producción mundial de ácido acético. El anhídrido acético puede ser producido directamente por carbonilación del metanol sin pasar por el ácido, y Cativa plantas se pueden adaptar para la producción de anhídrido.
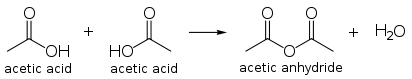
El anhídrido acético es un fuerte agente de acetilación. Como tal, su principal aplicación es para acetato de celulosa, un sintético textil también se utiliza para película fotográfica. El anhídrido acético es también un reactivo para la producción de la aspirina , heroína, y otros compuestos.
Vinagre
En forma de vinagre, soluciones de ácido acético (ácido acético típicamente de 5% a 18%, con el porcentaje general calculado en masa) se utilizan directamente como condimento, y también en el decapado de verduras y otros productos alimenticios. Vinagre de mesa tiende a ser más diluida (5% a 8% de ácido acético), mientras que el decapado de alimentos comerciales generalmente emplea soluciones más concentradas. La cantidad de ácido acético utilizado como el vinagre a escala mundial no es grande, pero históricamente, esto es, con mucho, la aplicación más antigua y más conocida.
Utilice como disolvente
El ácido acético glacial es un excelente polar disolvente prótico, como se señaló anteriormente . Se utiliza con frecuencia como un disolvente para recristalización para purificar compuestos orgánicos. Ácido acético fundido puro se utiliza como un disolvente en la producción de ácido tereftálico (TPA), la materia prima para tereftalato de polietileno (PET). Aunque en la actualidad representa el 5% y el 10% del uso de ácido acético en todo el mundo, se espera que esta aplicación específica a crecer significativamente en la próxima década, a medida que aumenta la producción de PET.
El ácido acético se utiliza a menudo como un disolvente para las reacciones que implican carbocationes, tales como Alquilación de Friedel-Crafts. Por ejemplo, una etapa en la fabricación comercial de sintética alcanfor implica una Wagner-Meerwein de canfeno al acetato de isobornilo; aquí ácido acético actúa tanto como disolvente y como una nucleófilo controlar la carbocatión reordenado. El ácido acético es el disolvente de elección cuando reducir una arilo nitro-grupo a una anilina usando paladio sobre carbono.
El ácido acético glacial se utiliza en química analítica para la estimación de sustancias débilmente alcalinos, tales como amidas orgánicas. El ácido acético glacial es un mucho más débil base de que el agua, por lo que la amida se comporta como una base fuerte en este medio. A continuación, se puede valorar usando una solución en ácido acético glacial de un ácido muy fuerte, tal como ácido perclórico.
Otras aplicaciones
Soluciones diluidas de ácidos acéticos también se utilizan para su leve acidez . Ejemplos en el ambiente doméstico incluyen el uso en una baño de paro durante el desarrollo de películas fotográficas, y en agentes de descalcificación para eliminar cal de los grifos y teteras. La acidez también se utiliza para el tratamiento de la picadura de la medusa de caja mediante la desactivación de las células urticantes de las medusas, la prevención de lesiones graves o la muerte si se aplica inmediatamente y durante el tratamiento infecciones del oído externo en personas en preparaciones tales como Vosol. De manera equivalente, se usa ácido acético como un aerosol-en conservante para el ganado ensilado, para desalentar bacteriana y fúngica crecimiento. El ácido acético glacial también se utiliza como una verruga y removedor de verruga.
Sales orgánicas o inorgánicas se producen a partir de ácido acético, incluyendo:
- Acetato de sodio, utilizado en el textil y la industria como un alimento conservante ( E262).
- Cobre (II) acetato de etilo, que se utiliza como un pigmento y una fungicida.
- Acetato de aluminio y de hierro (II) acetato de etilo usado como- mordientes para colorantes.
- Palladium (II) acetato de etilo, usado como un catalizador para reacciones de acoplamiento orgánicos tales como el Reacción de Heck.
- El acetato de plata, que se utiliza como una pesticida.
Ácidos acéticos sustituidos producidos incluyen:
- Ácido monocloroacético (MCA), ácido dicloroacético (considerado un subproducto), y ácido tricloroacético. MCA se utiliza en la fabricación de tinte índigo.
- Bromoacético ácido, que se esterifica para producir el reactivo bromoacetato de etilo.
- Ácido trifluoroacético, que es un reactivo común en síntesis orgánica.
Las cantidades de ácido acético utilizado en estas otras aplicaciones juntos (aparte de TPA) representan otro 5% -10% del uso de ácido acético en todo el mundo. Son, sin embargo, no se espera que estas aplicaciones a crecer tanto como la producción de TPA.
Seguridad
Ácido acético concentrado es corrosivo y por lo tanto debe ser manejado con cuidado apropiado, ya que puede causar quemaduras en la piel, daños permanentes en los ojos e irritación a las membranas mucosas. Estas quemaduras o ampollas pueden no aparecer hasta horas después de la exposición. Los guantes de látex no ofrecen protección, guantes de modo especialmente resistentes, tales como las hechas de caucho nitrilo, se debe utilizar para la manipulación del compuesto. Ácido acético concentrado puede ser encendido con dificultad en el laboratorio. Se convierte en un riesgo inflamable si la temperatura ambiente supera los 39 ° C (102 ° F), y puede formar mezclas explosivas con el aire por encima de esta temperatura ( límites de explosión: 5,4% -16%).
Los peligros de las soluciones de ácido acético dependen de la concentración. La siguiente tabla muestra el Clasificación de las soluciones de ácido acético de la UE:

| Concentración por peso | Molaridad | Clasificación | Frases-R |
|---|---|---|---|
| 10% -25% | 1,67 a 4,16 mol / L | Irritante (Xi) | R36 / 38 |
| 25% -90% | 4,16 a 14,99 mol / L | Corrosivo (C) | R34 |
| > 90% | > 14,99 mol / L | Corrosivo (C) | R10, R35 |
Soluciones en ácido acético superior al 25% se manejan en una campana de extracción debido a la, vapor corrosivo acre. Ácido acético diluido, en forma de vinagre, es inofensivo. Sin embargo, la ingestión de soluciones más fuertes es peligroso para la vida humana y animal. Puede causar daños graves en el sistema digestivo, y un cambio potencialmente letal en la acidez de la sangre .
Debido a incompatibilidades, se recomienda para mantener el ácido acético lejos de ácido crómico, glicol de etileno, ácido nítrico , ácido perclórico, permanganatos, peróxidos y hidroxilos.

