
Ácido sulfúrico
Sabías ...
Esta selección Wikipedia está disponible sin conexión de SOS Children para su distribución en el mundo en desarrollo. Madres SOS cada aspecto después de un una familia de niños apadrinados .
| Ácido sulfúrico | |
|---|---|
 | |
 | |
Ácido Sulfúrico | |
Otros nombres aceite de vitriolo | |
| Identificadores | |
| CAS | 7664-93-9 |
| Número RTECS | WS5600000 |
| Propiedades | |
| Fórmula molecular | H 2 SO 4 |
| Masa molar | 98.078 g / mol |
| Apariencia | claro, incoloro, líquido inodoro |
| Densidad | 1.84 g cm -3, líquido |
| Punto de fusion | 10 ° C, 283 K, 50 ° F |
| Punto de ebullicion | 290 ° C, 563 K, 554 ° F (pb de ácido puro. 98% de solución hierve a 338 ° C) |
| Solubilidad en agua | totalmente miscible (Exotérmica) |
| Viscosidad | 26.7 c P a 20 ° C |
| Peligros | |
| MSDS | MSDS externa |
| Clasificación de la UE | Altamente corrosivos (C) |
| Frases R | R35 |
| Frases S | (S1 / 2), S26, S30, S45 |
| NFPA 704 |  0 3 2 COR |
| Punto de inflamabilidad | No es inflamable |
| Compuestos relacionados | |
| Conexo ácidos fuertes | Ácido selénico Ácido clorhídrico Ácido nítrico |
| Compuestos relacionados | Sulfuro de hidrógeno Ácido sulfuroso Ácido peroxosulfúrico El trióxido de azufre Oleum |
| Página de datos complementaria | |
| Estructura y propiedades | n, ε r, etc. |
| Termodinámica datos | Comportamiento de fase Sólido, líquido, gas |
| Los datos espectrales | UV, IR, RMN , MS |
| Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
El ácido sulfúrico, (también conocido como ácido sulfúrico) H 2 S O 4, es un fuerte ácido mineral. Es soluble en agua en todas las concentraciones. Una vez se conoce como aceite de vitriolo, acuñado por el siglo octavo Alquimista musulmán Jabir Ibn Hayyan (Geber) después de su descubrimiento de la química. El ácido sulfúrico tiene muchas aplicaciones, y es uno de los mejores productos de la industria química. La producción mundial en 2001 fue de 165 millones de toneladas, con un valor aproximado de US $ 8 mil millones. Principales usos incluyen procesamiento de minerales, fertilizantes de fabricación, refinación de petróleo , procesamiento de aguas residuales y síntesis química.
Muchas proteínas están hechas de azufre aminoácidos -Con ácidos (tales como cisteína y metionina) que producen ácido sulfúrico cuando metabolizada por el cuerpo.
Aparición
Ácido puro (sin diluir) sulfúrico no se encuentra en la Tierra, debido a la gran afinidad de ácido sulfúrico para el agua. Aparte de eso, el ácido sulfúrico es un constituyente de la lluvia ácida , que está formado por atmosférica oxidación de dióxido de azufre en la presencia de agua , es decir, la oxidación de ácido sulfuroso. El dióxido de azufre es el principal subproducto producido cuando se queman combustibles que contienen azufre tales como carbón o petróleo.
El ácido sulfúrico se forma naturalmente por la oxidación de minerales de sulfuro, tales como sulfuro de hierro. El agua resultante puede ser muy ácido y se llama Drenaje Ácido de Minas (AMD). Esta agua ácida es capaz de disolver los metales presentes en los minerales de sulfuro, lo que resulta en corrientes de colores brillantes, tóxicos. La oxidación de sulfuro de hierro pirita por el oxígeno molecular produce hierro (II), o Fe 2+:
La Fe 2+ puede ser oxidado a Fe 3+ más, de acuerdo a:
y el Fe 3+ producido puede ser precipitado como el hidróxido o óxido hidratado. La ecuación para la formación del hidróxido es
- Fe 3+ + 3 H 2 O → Fe (OH) 3 + 3 H +.
El ion de hierro (III) ("hierro férrico", en la nomenclatura ocasional) también puede oxidar la pirita. Cuando se produce hierro (III) la oxidación de la pirita, el proceso puede llegar a ser rápida. valores de pH por debajo de cero se han medido en AMD producido por este proceso.
AMD también puede producir ácido sulfúrico a una velocidad más lenta, de modo que la Ácido Neutralización Capacidad (ANC) del acuífero puede neutralizar el ácido producido. En tales casos, el Total de sólidos disueltos (TDS) concentración del agua pueden aumentarse forma la disolución de los minerales de la reacción ácido-neutralización con los minerales.
Ácido sulfúrico Extraterrestre
El ácido sulfúrico se produce en la atmósfera superior de Venus por el sol de acción fotoquímica en dióxido de carbono , dióxido de azufre y agua de vapor. ultravioletas fotones de longitudes de onda inferiores a 169 nm puede photodissociate dióxido de carbono en monóxido de carbono y atómica de oxígeno . El oxígeno atómico es altamente reactivo. Cuando reacciona con dióxido de azufre, un componente traza de la atmósfera Venerian, el resultado es trióxido de azufre, que puede combinarse con el vapor de agua, otro componente traza de la atmósfera de Venus, para producir ácido sulfúrico.
En las partes altas y frías de la atmósfera de Venus, existe ácido sulfúrico como un líquido, y ácido sulfúrico gruesas nubes superficie completamente oscura del planeta cuando se ve desde arriba. La capa principal nube se extiende 45-70 km por encima de la superficie del planeta, con brumas más delgadas que se extienden tan bajas como 30 y tan alta como 90 km por encima de la superficie.
Los espectros infrarrojos de la NASA 's Galileo muestran misión absorciones distintos en Júpiter Luna 's Europa que se han atribuido a uno o más hidratos de ácido sulfúrico. La interpretación de los espectros es algo controvertido. Algunos científicos planetarios prefieren asignar las características espectrales para el ion sulfato, tal vez como parte de uno o más minerales en la superficie de Europa.
Manufactura
El ácido sulfúrico se produce a partir de azufre , oxígeno y agua a través de la proceso de contacto.
En el primer paso, el azufre se quema para producir dioxido de azufre.
Esto entonces se oxida a trióxido de azufre utilizando oxígeno en presencia de una vanadio (V) óxido de catalizador .
- (2) 2 SO 2 + O 2 (g) → 2 SO 3 (g) (en presencia de V 2 O 5)
Por último, el trióxido de azufre se trata con agua (generalmente como 97-98% H 2 SO 4 que contiene 2-3% de agua) para producir ácido sulfúrico 98-99%.
Tenga en cuenta que disolviendo directamente SO3 en el agua no es práctico debido a la gran naturaleza exotérmica de la reacción , formando una niebla corrosiva en lugar de un líquido. Alternativamente, SO3 se puede absorber H 2 SO 4 para producir oleum (H 2 S 2 O 7), que puede entonces ser mezclado con agua para formar ácido sulfúrico.
- (3) H 2 SO 4 8 ( l 8) + SO3 → H 2 S 2 O 7 (l)
Oleum se hace reaccionar con agua para formar H 2 SO 4 concentrado.
- (4) H 2 S 2 O 7 (l) + H2O (l) → 2 H 2 SO 4 (l)
Propiedades físicas
Formas de ácido sulfúrico
Aunque el ácido sulfúrico casi el 100% se puede hacer, este pierde SO 3 en el punto de ebullición para producir ácido 98,3%. El grado de 98% (18M) es más estable en almacenamiento, y es la forma habitual de lo que se describe como ácido sulfúrico concentrado. Otro las concentraciones se utilizan para diferentes propósitos. Algunas concentraciones comunes son
- 10%, ácido sulfúrico diluido para uso en laboratorio,
- 33,5%, ácido de la batería (utilizado en Las baterías de plomo),
- 62,18%, cámara o ácido fertilizante,
- 77,67%, torre o ácido Glover,
- 98%, se concentró ácido.
Diferentes grados de pureza están también disponibles. Grado H Técnica 2 SO 4 es impuro y, a menudo de color, pero es conveniente para hacer fertilizante. Grados puros, tales como Farmacopea de Estados Unidos (USP) se utilizan para la fabricación de productos farmacéuticos y colorantes.
Cuando altas concentraciones de SO3 ( g ) se añaden al ácido sulfúrico, H 2 S 2 O 7, llamado ácido pirosulfúrico, ácido sulfúrico fumante o óleum o, menos comúnmente, ácido Nordhausen, se forma. Las concentraciones de óleum se expresan en términos de% SO3 (llamado oleum%) o como% de H 2 SO 4 (la cantidad hecha si H se añadieron 2 O); concentraciones habituales son 40% óleum (109% de H 2 SO 4) y el 65% óleum (114,6% de H 2 SO 4). H Pure 2 S 2 O 7 es un sólido con punto de fusión 36 ° C.
La polaridad y la conductividad
Anhidro H 2 SO 4 es una muy líquido polar, que tiene una constante dieléctrica de alrededor de 100. Tiene una alta conductividad eléctrica, causada por la disociación a través protonación sí misma, un proceso conocido como autoprotólisis.
- 2 H 2 SO 4 ⇌ H 3 SO 4 + + HSO 4 -
La constante de equilibrio para la autoprotólisis es
- K ap (25 ° C) = [H 3 SO 4 +] [HSO 4 -] = 2,7 × 10 -4.
La constante de equilibrio para comparable agua, K w es 10 -14, un factor de 10 10 (10 mil millones) más pequeño.
A pesar de la viscosidad del ácido, la efectiva conductividades de la H + 3 SO 4 y HSO 4 - iones son altos debido a un mecanismo de protones interruptor intra-molecular (análoga a la Mecanismo de Grotthuss en agua), por lo que el ácido sulfúrico un buen conductor. También es un disolvente excelente para muchas reacciones.
El equilibrio es en realidad más compleja de lo que se muestra arriba; 100% de H 2 SO 4 contiene las siguientes especies en equilibrio (cifras muestran como milimoles por kg de disolvente): HSO 4 - (15.0), H 3 SO 4 + (11.3), H 3 O + (8,0), HS 2 O 7 - (4,4), H 2 S 2 O 7 (3.6), H 2 O (0,1).
Propiedades químicas
La reacción con el agua
La reacción de hidratación de ácido sulfúrico es altamente exotérmica. Si el agua se añade al ácido sulfúrico concentrado, puede reaccionar, ebullición y escupir peligrosamente. Uno siempre debe añadir el ácido al agua antes que el agua para el ácido. Esto puede ser recordado a través de mnemotécnicos tales como: ". Haz lo que deberías, añadir el ácido al agua", "Si usted piensa de su vida demasiado plácida, agregue el agua al ácido", "AA: Añadir Acid", o "Drop ácido, no agua", o "ácido al agua, al igual que A & W Root Beer "o" Pon el rey en el agua, no el agua en el rey ". La necesidad de esta medida de seguridad se debe a las densidades relativas de estos dos líquidos. El agua es menos densa que el ácido sulfúrico, que significa agua tenderá flotar en la parte superior de este ácido. La reacción es la mejor idea para la formación iones hidronio, por
- H 2 SO 4 + H2O → H3O + + HSO 4 -,
y luego
- HSO 4 - + H2O → H3O + + SO 4 2-.
Debido a que la hidratación de ácido sulfúrico es termodinámicamente favorable, ácido sulfúrico es un agente deshidratante excelente, y se utiliza para preparar muchos frutas secas. La afinidad de ácido sulfúrico para el agua es suficientemente fuerte que se eliminará de hidrógeno y de oxígeno átomos de otros compuestos; por ejemplo, mezclando almidón (C 6 H 12 O 6) n y el ácido sulfúrico concentrado dará elemental de carbono y agua que es absorbida por el ácido sulfúrico (que se vuelve ligeramente diluido): (C 6 H 12 O 6) n → 6C + 6H 2 O. El efecto de esto se puede ver cuando el ácido sulfúrico concentrado se derrama en el papel; la celulosa reacciona para dar una apariencia quemado, el carbono aparece mucho como el hollín sería en un incendio. Una reacción más dramática se produce cuando se añade ácido sulfúrico a una cucharada de blanco azúcar ; una columna rígida de negro, carbono poroso va a surgir rápidamente. El carbono tendrá un olor fuerte de caramelo.
Otras reacciones
Como un ácido, el ácido sulfúrico reacciona con la mayoría bases para dar el correspondiente sulfato . Por ejemplo, de cobre (II) sulfato . Esta sal azul de cobre , que se utiliza comúnmente para galvanoplastia y como fungicida, se prepara mediante la reacción de de cobre (II) óxido con ácido sulfúrico:
El ácido sulfúrico también se puede utilizar para desplazar ácidos más débiles partir de sus sales. La reacción con acetato de sodio, por ejemplo, desplaza ácido acético :
- H 2 SO 4 + CH 3 COONa → NaHSO4 + CH3COOH
Del mismo modo, la reacción de ácido sulfúrico con nitrato de potasio se puede utilizar para producir ácido nítrico y un precipitado de bisulfato de potasio. Cuando se combina con el ácido nítrico , ácido sulfúrico actúa tanto como un ácido y un agente deshidratante, formando la ion nitronio NO + 2, que es importante en reacciones de nitración que implican sustitución electrofílica aromática. Este tipo de reacción, donde se produce la protonación en una de oxígeno átomo, es importante en muchas de química orgánica , tales como reacciones Esterificación de Fischer y deshidratación de alcoholes.
El ácido sulfúrico reacciona con la mayoría de los metales a través de una reacción de desplazamiento único para producir hidrógeno gas y el sulfato de metal. Diluir H 2 SO 4 ataques de hierro , aluminio , zinc , manganeso , magnesio y níquel , pero las reacciones con estaño y cobre requiere el ácido a ser caliente y se concentró. plomo y de tungsteno , sin embargo, son resistentes al ácido sulfúrico. La reacción con el hierro (que se muestra) es típico para la mayoría de estos metales, pero la reacción con el estaño es inusual, ya que produce dióxido de azufre en lugar de hidrógeno.
- Sn (s) + 2 H 2 SO 4 (ac) → SnSO 4 (aq) + 2 H 2 O (l) + SO 2 (g)
El ácido sulfúrico se somete sustitución aromática electrofílica con compuestos aromáticos para dar el correspondiente ácidos sulfónicos:
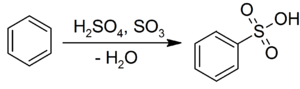
Usos

El ácido sulfúrico es un muy importante química de los productos básicos, y de hecho, la producción de ácido sulfúrico de una nación es un buen indicador de su fuerza industrial. El uso principal (60% de la producción mundial total) para el ácido sulfúrico se encuentra en el "método húmedo" para la producción de ácido fosfórico , que se utiliza para la fabricación de fosfato de fertilizantes , así como fosfato trisódico para detergentes. En este método, se utiliza la roca de fosfato, y más de 100 millones de toneladas se procesan anualmente. Esta materia prima se muestra a continuación como fluorapatite, aunque la composición exacta puede variar. Esto se trata con 93% de ácido sulfúrico para producir sulfato de calcio, fluoruro de hidrógeno (HF) y ácido fosfórico . El HF se elimina como acido hidrofluorico. El proceso global se puede representar como:
El ácido sulfúrico se utiliza en grandes cantidades por el hierro y la fabricación de acero industria para eliminar la oxidación, el óxido y la escala de la hoja y palanquillas anteriores laminado para la venta al automóvil y la industria de los electrodomésticos. Ácido utilizado a menudo se reciclan utilizando un ácido Regeneración (SAR) planta gastado. Estas plantas combustión pasaron ácido con gas natural, gas de refinería, aceite combustible o otras fuentes de combustible. Este proceso de combustión produce dióxido de azufre gaseoso (SO 2) y trióxido de azufre (SO3) que luego se utiliza para la fabricación de ácido sulfúrico "nuevo". Plantas SAR son adiciones comunes a plantas de fundición de metal, refinerías de petróleo y otras industrias en las que el ácido sulfúrico se consume en grandes cantidades, como operar una planta de SAR es mucho más barato que los costos recurrentes de la eliminación del ácido gastado y nuevas compras de ácido.
El sulfato de amonio, un fertilizante nitrogenado importante, se produce más comúnmente como un subproducto de las coquerías que suministran el hierro y plantas de fabricación de acero. Hacer reaccionar el amoniaco producido en la descomposición térmica de carbón con ácido sulfúrico residual permite que el amoniaco que se cristalizó como una sal (a menudo de color marrón debido a la contaminación de hierro) y vendido en la industria de productos agroquímicos.
Otro uso importante para el ácido sulfúrico es para la fabricación de sulfato de aluminio, también conocido como alumbre del fabricante de papel. Este puede reaccionar con pequeñas cantidades de jabón en fibras de pasta de papel de aluminio para dar gelatinosa carboxilatos, que ayudan a coagular las fibras de pasta en una superficie de papel duro. También se utiliza para hacer hidróxido de aluminio, que se utiliza en plantas de tratamiento de agua a filtrar impurezas, así como para mejorar el sabor de la agua . Sulfato de aluminio se prepara haciendo reaccionar bauxita con ácido sulfúrico:
El ácido sulfúrico se utiliza para una variedad de otros usos en la industria química. Por ejemplo, es habitual el catalizador ácido para la conversión de cyclohexanoneoxime a caprolactama, utilizado para la fabricación nylon. Se utiliza para la fabricación de ácido clorhídrico de sal a través de la Proceso Mannheim. Mucho H 2 SO 4 se utiliza en petróleo refinación, por ejemplo, como un catalizador para la reacción de isobutano con isobutileno para dar isooctano, un compuesto que eleva la octanaje de gasolina (gasolina). El ácido sulfúrico también es importante en la fabricación de soluciones colorantes y es el "ácido" en plomo-ácido (coche) baterías.
El ácido sulfúrico también se utiliza como un agente deshidratante en general en su forma concentrada. Ver reacción con el agua .
Ciclo de azufre yodo
La ciclo de azufre de yodo es una serie de procesos termoquímicos utilizados para obtener hidrógeno . Se compone de tres reacciones químicas cuyo importe neto de reactivo es agua y cuyos productos netos son el hidrógeno y el oxígeno .
-
2 H 2 S O 4 → 2 S O 2 + 2 H 2 O + O 2 (830 ° C) I 2 + S O 2 + 2 H 2 O → 2 H I + H 2 S O 4 (120 ° C) 2 H I → I 2 + H 2 (320 ° C)
Los azufre y yodo compuestos son recuperados y reutilizados, por lo tanto, la consideración del proceso como un ciclo. Este proceso es endotérmica y debe producirse a altas temperaturas, por lo que la energía en forma de calor tiene que ser suministrado.
El ciclo de azufre de yodo se ha propuesto como una forma de suministro de hidrógeno para una economía basada en el hidrógeno. No requiere hidrocarburos como los métodos actuales de reformado con vapor.
El ciclo de azufre de yodo se está investigando actualmente como un método viable de obtención de hidrógeno, pero el concentrado, ácido corrosivo a altas temperaturas plantea momento, los riesgos de seguridad insuperables si el proceso se basa en gran escala.
Historia

El descubrimiento del ácido sulfúrico se acredita en el siglo octavo Químico y alquimista árabe, Jabir Ibn Hayyan (Geber). El ácido se estudió más tarde por siglo noveno Médico persa y alquimista Ibn Zakariya al-Razi (Rhazes), que obtuvo la sustancia por destilación seca de minerales incluyendo hierro (II) heptahidratado sulfato, FeSO4 • 7H 2 O, y de cobre (II) sulfato pentahidratado, CuSO4 • 5H 2 O. Cuando se calienta, estos compuestos se descomponen a de hierro (II) y óxido de cobre (II) óxido, respectivamente, emitiendo agua y trióxido de azufre, que se combinan para producir una solución diluida de ácido sulfúrico. Este método se popularizó en Europa a través de las traducciones de árabe y tratados persas, así como libros de alquimistas europeos, como el siglo 13 alemán Alberto Magno.
El ácido sulfúrico se conoce a los alquimistas medievales europeos como aceite de vitriolo, espíritu de vitriolo, o simplemente vitriolo, entre otros nombres. La palabra vitriolo deriva de la vitreus América, "vidrio", en referencia a la apariencia vidriosa de las sales de sulfato, que también lleva el nombre de vitriolo. Las sales llamados por este nombre incluidos (II) sulfato de cobre (vitriolo azul, o raramente romana vitriolo), sulfato de zinc (vitriolo blanco), de hierro (II) sulfato (vitriolo verde), de hierro (III) sulfato (vitriolo de Marte), y cobalto (II) sulfato (vitriolo rojo).
Vitriolo fue ampliamente considerado como el más importante alquímico sustancia, destinado a ser utilizado como un la piedra filosofal. Altamente vitriolo purificada se utiliza como un medio para la reacción de otras sustancias. Esto fue en gran parte debido a que el ácido no reacciona con el oro , cuya producción era a menudo el objetivo final de los procesos alquímicos. La importancia de vitriolo a la alquimia se pone de relieve en el lema alquímico, Visita Interiora Terrae Rectificando Invenies Occultum Lapidem que es un significado backronym ('Visita el interior de la tierra y rectificar (es decir, purificar) encontrarás la piedra oculta / secreto'), que se encuentra en L'Azoth des philosophes por el alquimista siglo 15 Basilio Valentín,.
En el siglo 17, el químico alemán-holandés Johann Glauber preparó ácido sulfúrico por la quema de azufre junto con salitre ( nitrato de potasio , KNO 3), en presencia de vapor de agua. Como salitre se descompone, se oxida el azufre a SO 3, que se combina con agua para producir ácido sulfúrico. En 1736, Joshua Ward, un Londres farmacéutico, utiliza este método para iniciar la primera producción a gran escala de ácido sulfúrico.
En 1746 en Birmingham , John Roebuck adaptó este método para producir ácido sulfúrico en plomo cámaras -lined, que eran más fuertes, menos costoso, y se podría hacer más grande que los envases de vidrio utilizados anteriormente. Este proceso de cámaras de plomo permitido la industrialización efectiva de la producción de ácido sulfúrico. Después de varias mejoras, este método sigue siendo el estándar para la producción de ácido sulfúrico durante casi dos siglos.
El ácido sulfúrico creado por el proceso de John Roebuck sólo se acercó a una concentración de 35 a 40%. Refinamientos posteriores al proceso de plomo-cámara por el químico francés Joseph-Louis Gay-Lussac y químico británico John Glover mejoró el rendimiento al 78%. Sin embargo, la fabricación de algunos colorantes y otros procesos químicos requieren un producto más concentrado. A lo largo del siglo 18, esto sólo podría hacerse por minerales de destilería secos en una técnica similar a los originales alquímicos procesos. Pirita ( disulfuro de hierro , FeS 2) se calentó al aire para dar de hierro (II) sulfato, FeSO 4, que fue oxidado por calentamiento adicional en el aire para formar de hierro (III) sulfato, Fe 2 (SO 4) 3, que, cuando se calienta a 480 ° C, descompuesto a de hierro (III) y óxido trióxido de azufre, que podría pasar a través de agua para producir ácido sulfúrico en cualquier concentración. Sin embargo, el gasto de este proceso impide el uso a gran escala de ácido sulfúrico concentrado.
En 1831, British comerciante vinagre Peregrine Phillips patentó el proceso de contacto, que era un proceso mucho más económico para producir trióxido de azufre y ácido sulfúrico concentrado. Hoy en día, casi todos de ácido sulfúrico del mundo se produce utilizando este método.
Seguridad
Riesgos de laboratorio

Las propiedades corrosivas de ácido sulfúrico se acentúan por su altamente reacción exotérmica con agua . Por lo tanto se quema a partir de ácido sulfúrico son potencialmente más graves que los de ácidos fuertes comparables (por ejemplo, ácido clorhídrico ), ya que no hay daño tisular adicional debido a la deshidratación y, en particular debido al calor liberado por la reacción con agua; es decir, el daño térmico secundario. El peligro es obviamente mayor con las preparaciones más concentradas de ácido sulfúrico, pero se debe recordar que incluso el laboratorio normal "diluir" grado (aprox. 1 M, 10%) se charla de papel por la deshidratación si se deja en contacto durante un tiempo suficiente. Soluciones igual o más fuerte que 1,5 M se deben etiquetar corrosivos, irritantes, mientras que las soluciones de más de 0,5 M, pero menos de 1,5 M deben ser etiquetados. El ácido sulfúrico fumante (óleum) no se recomienda para su uso en las escuelas debido a que es muy peligroso. El tratamiento estándar de primeros auxilios en caso de derrames de ácido en la piel es, como para otros corrosivos agentes, riego con grandes cantidades de agua: El lavado debe continuarse durante al menos diez o quince minutos para enfriar el tejido que rodea la quemadura de ácido y para prevenir daño secundario. La ropa contaminada debe ser removido inmediatamente y la piel subyacente lava a fondo.
Preparación del ácido diluido también puede ser peligroso debido al calor liberado en el proceso de dilución. Es esencial que el ácido concentrado se añade al agua y no al revés, para tomar ventaja de la relativamente alta capacidad calorífica del agua. La adición de agua al ácido sulfúrico concentrado conduce en el mejor a la dispersión de un ácido sulfúrico aerosol, en el peor, a una explosión. Preparación de las soluciones de más de 6 M (35%) de la concentración es la más peligrosa, ya que el calor producido puede ser suficiente para hervir el ácido diluido: agitación mecánica y refrigeración eficientes externa (por ejemplo, un baño de hielo) son esenciales.
Los riesgos industriales
Aunque el ácido sulfúrico no es inflamable, póngase en contacto con metales en el caso de derrame puede conducir a la liberación de hidrógeno gas. La dispersión de aerosoles ácidos y gaseoso dióxido de azufre es un peligro adicional de fuegos en que el ácido sulfúrico.
El ácido sulfúrico no se considera tóxico, además de su peligro corrosivo obvio, y los principales riesgos laborales son el contacto de la piel dando lugar a quemaduras (véase más arriba) y la inhalación de aerosoles. La exposición a aerosoles a altas concentraciones conduce a la irritación inmediata y grave de los ojos, tracto respiratorio y las membranas mucosas: este cesa rápidamente después de la exposición, aunque hay un riesgo de posterior edema pulmonar si el daño tisular ha sido más grave. A concentraciones más bajas, el síntoma más frecuente de la exposición crónica a aerosoles de ácido sulfúrico es la erosión de los dientes, que se encuentra en casi todos los estudios: indicios de un posible daño crónico a la tracto respiratorio no son concluyentes a partir de 1997. En el Estados Unidos , la límite de exposición permisible (PEL) para el ácido sulfúrico se fija en 1 mg / m³: límites en otros países son similares. Curiosamente se ha informado acerca de la ingesta de ácido sulfúrico que lleva a La deficiencia de vitamina B12 con degeneración combinada subaguda. La médula espinal está afectada con más frecuencia en estos casos, pero los nervios ópticos puede mostrar desmielinización, pérdida de axones y gliosis.
Las restricciones legales
El comercio internacional de ácido sulfúrico está controlado por la Convención de Naciones Unidas contra el Tráfico Ilícito de Estupefacientes y Sustancias Psicotrópicas, 1988, que enumera ácido sulfúrico en la Tabla II de la convención como un producto químico utilizado frecuentemente para la fabricación ilícita de estupefacientes o sustancias psicotrópicas.
En el Estados Unidos de América , el ácido sulfúrico se incluye en Lista II de la lista de productos químicos esenciales o precursores establecido en virtud de la Ley sobre la trata de desvío y químicas. En consecuencia, las transacciones de ácido sulfúrico tales como ventas, transferencias, las exportaciones e importaciones a los Estados Unidos-están sujetas a la regulación y supervisión de la Administración de Control de Drogas.
En la ficción
En varias películas, dibujos animados y programas de televisión, especialmente los de ciencia-ficción, ácido sulfúrico normalmente se representan como un líquido humeante verde burbujeante, a veces capaz de disolver casi cualquier cosa en un instante. Esto es puramente para el atractivo visual, ya que el ácido verde ebullición es más de aspecto peligroso que la forma clara y almibarado real lo que realmente es. El uso de ácido sulfúrico como un arma en los delitos de asalto, conocida como " vitriolo tirar ", ha sido a veces suficientemente común (si es sensacional) para hacer su camino en novelas y cuentos. Los ejemplos incluyen El cliente ilustre, por Arthur Conan Doyle, El amor de hace mucho tiempo, por Guy de Maupassant y Brighton Rock por Graham Greene. Una banda, My Vitriol, toma su nombre de su uso como arma en Brighton Rock. Un episodio de Sábado Noche alojado en vivo por Mel Gibson incluía un bosquejo occidental parodia de "Sheriff Jeff Acid", que lleva un frasco de ácido en lugar de un niño de seis disparos. La DC Comics villano Dos Caras fue desfigurado como consecuencia de un tiro de vitriolo. Este delito también se menciona en Mil novecientos ochenta y cuatro por George Orwell; el protagonista Winston Smith se compromete a lanzar vitriolo en la cara de un niño si eso sería el fin "de la Hermandad", y enemigo de Winston O'Brien después utiliza esas palabras bárbaras para socavar su lógica. La novela Veronika decide morir por Paulo Coelho habla de una chica que ha intentado suicidarse y termina con una intoxicación vitriolo. El médico / terapeuta en esta novela también escribe una tesis sobre la curación de la intoxicación vitriolo. La sustancia también fue utilizado por un joven gángster en Temporada 6B, Episodio 5 de Los Soprano como una forma de tortura.

