
Réaction acide-base
Renseignements généraux
Cette sélection Wikipedia est déconnecté disponibles à partir enfants SOS pour la distribution dans le monde en développement. SOS Enfants a regardé des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
| Acides et Bases |
|---|
| Constante de dissociation acide Extraction acide-base Réaction acide-base Titrage acide-base Constante de dissociation fonction d'acidité solutions tampons pH Proton affinité Autoprotolyse Force de l'acide |
| Acide types |
| Brønsted · Lewis · Minéral Organic · Fort Superacides · Faible |
| Les types de base |
| Brønsted · Lewis · Organique Forte · Superbases Non nucléophile · Faible |
Une réaction acide-base est une réaction chimique qui se produit entre un acide et un base. Plusieurs concepts existent qui fournissent des définitions alternatives pour les mécanismes réactionnels impliqués et leur application dans la résolution des problèmes connexes. Malgré plusieurs similitudes dans les définitions, leur importance devient évident que les différentes méthodes d'analyse lorsqu'il est appliqué à des réactions acide-base pour les espèces gazeux ou liquides, ou lorsque le caractère acide ou basique peut être un peu moins évident. Historiquement, le premier de ces concepts scientifiques d'acides et de bases ont été fournis par le français chimiste Antoine Lavoisier , circa 1776 .
Théories acide-base commune
Définition Lavoisier
Depuis la connaissance de Lavoisier acides forts a été essentiellement limitées à oxyacides, qui ont tendance à contenir des atomes centraux en haute états d'oxydation entourés par de l'oxygène, tels que HNO 3 et H 2 SO 4 , et comme il ne était pas au courant de la véritable composition des acides halohydriques, HCl, HBr et HI, il définis acides en termes de leur contenant de l'oxygène , ce qui fait-il nommé des mots grecs signifiant «acide-anciens» (du grec οξυς (oxys) signifie «acide» ou «forte» et γεινομαι (geinomai) ou "engendrer"). La définition Lavoisier a eu lieu comme une vérité absolue pour les plus de 30 ans, jusqu'à ce que l'article 1810 et des conférences ultérieures par Sir Humphry Davy dans lequel il prouvé le manque d'oxygène dans H 2 S, H 2 Te, et la les acides halohydriques.
Définition Liebig
Cette définition a été proposée par Justus von Liebig circa 1838 , sur la base de ses importants travaux sur la composition chimique de des acides organiques. Ce terminé le changement de doctrine à partir d'acides à base d'oxygène aux acides à base d'hydrogène, a commencé par Davy. Selon Liebig, un acide est une substance contenant de l'hydrogène dont l'hydrogène peut être remplacé par un métal. La définition de Liebig, tout en étant complètement empirique, est resté en service pendant près de 50 ans jusqu'à l'adoption de la définition d'Arrhenius.
Définition d'Arrhenius

La définition d'Arrhenius des réactions acide-base est un concept acide-base simplifié conçu par Svante Arrhenius, qui a été utilisé pour fournir une définition moderne de bases qui a suivi de son travail avec Friedrich Wilhelm Ostwald dans l'établissement de la présence d'ions en solution aqueuse en 1884 , et a conduit à la réception de la Arrhenius Prix Nobel de chimie en 1903 pour "reconnaissance des services extraordinaires ... rendu à l'avancement de la chimie par sa théorie de la dissociation électrolytique"
Tel que défini au moment de la découverte, réactions acide-base se caractérisent par des acides Arrhenius, qui dissocier dans sous forme de solution aqueuse hydrogène ou le tard-appelé oxonium (H 3 O +) des ions, et les bases d'Arrhenius qui forment l'hydroxyde (OH -) ions. Plus récent Recommandations IUPAC suggèrent maintenant le nouveau terme "hydronium" être utilisé en faveur du terme accepté "oxonium" plus pour illustrer mécanismes réactionnels tels que ceux définis dans le Brønsted-Lowry et définitions du système de solvants plus clairement, avec la définition d'Arrhenius servir comme un simple aperçu général de caractère acido-basique Plus succinctement, la définition d'Arrhenius peut supposer que;
| " | Arrhenius acides forment des ions hydrogène en solution aqueuse avec des bases formant des ions hydroxydes d'Arrhenius. | " |
La définition acide-base aqueuse universel de la notion d'Arrhenius est décrite comme la formation d'eau à partir de l'hydrogène et des ions hydroxyde ou ions hydronium et les ions hydroxyde produits à partir de la dissociation d'un acide et une base en solution aqueuse (2 H 2 O → OH - 3 O + H +), ce qui conduit à la définition qui en Arrhenius réactions acide-base, un sel et de l'eau est formé à partir de la réaction entre un acide et une base - dans les définitions scientifiques les plus simples, cette forme de réaction est appelée réaction de neutralisation.
- + acide + base de - → sel + eau
L'ion positif à partir d'une base peut former un sel avec l'ion négatif d'un acide. Par exemple, deux moles de la base hydroxyde de sodium (NaOH) peuvent se combiner avec une mole d'acide sulfurique (H 2 SO 4) pour former deux moles d' eau et d'une mole de sulfate de sodium .
- 2NaOH + H 2 SO 4 → 2 H 2 O + Na 2 SO 4
Définition de Brønsted-Lowry
La définition de Brønsted-Lowry, formulé de façon indépendante par ses deux promoteurs Johannes Nicolaus Brønsted et Martin Lowry en 1923 est basée sur l'idée de protonation des bases à travers le de-protonation des acides - plus communément appelés la capacité des acides à "faire un don" ions hydrogène (H +) ou protons à des bases, qui "accepte" eux. Contrairement à la définition d'Arrhenius, la définition de Bronsted-Lowry se réfère à des produits d'une réaction acide-base que les acides conjugués et des bases de se référer à la relation d'un proton et d'indiquer qu'il ya eu une réaction entre les deux quantités, plutôt que d'une «formation» de sel et de l'eau, comme il est expliqué dans la définition d'Arrhenius.
Il définit que dans les réactions, il est le don et la réception d'un proton, ce qui fait essentiellement référence à l'élimination d'un ion d'hydrogène lié au sein d'un composé et sa réaction avec un autre composé, et non l'élimination d'un proton à partir du noyau d'un atome , ce qui nécessiterait des quantités excessives d'énergie réalisables pas par la simple dissociation des acides. Dans la différenciation de la Définition d'Arrhenius, la définition de Bronsted-Lowry postule que, pour chaque acide, il est un acide conjugué de la base et ou "paire conjuguée acide-base" qui est formée par une réaction complète, qui inclut également de l'eau, qui est amphotère:
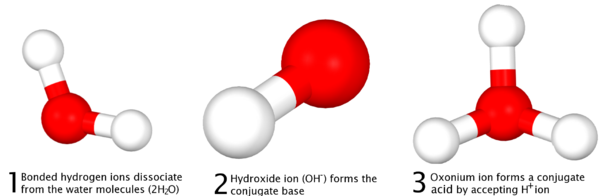
|
Définition de Lewis
La définition de Lewis de réactions acide-base, conçue par Gilbert Lewis en 1923 est une théorie englobant les définitions de Bronsted-Lowry et de solvant au système en ce qui concerne le principe d'un mécanisme de donation, qui attribue à l'inverse du don de paires d'électrons à partir de bases et de l'acceptation par les acides, plutôt que des protons ou d'autres substances et portées à la fois des réactions aqueuses et non aqueuses liés.
- Ag + + 2: NH 3 → [H 3 N: Ag: NH 3] +
- Un cation argent réagit comme un acide avec de l'ammoniac qui agit comme un donneur de paire d'électrons, en formant un produit d'addition d'ammoniac et d'argent
Dans les réactions entre Des acides de Lewis et bases, on observe la formation d'un produit d'addition lorsque le orbitale moléculaire occupée la plus élevée ( HOMO) d'une molécule, tels que NH 3 avec disponible paire (s) d'électrons seul don de paires d'électrons célibataires à la molécule de déficient en électrons orbitale moléculaire vacante la plus basse ( LUMO) à travers un liaison covalente coordonnée; Dans une telle réaction, la molécule interagissant avec HOMO agit comme une base, et la molécule interagissant LUMO agit comme un acide. Dans les molécules fortement polaires, tels que le fluorure de bore-Tri (BF 3), le plus élément électronégatif tire électrons vers ses propres orbitales, fournir une charge plus positive sur l'élément moins électronégatif et une différence dans sa structure électronique en raison de la position axiale ou orbite équatoriales de ses électrons, entraînant des effets de répulsion de Lone paire de liaison paire (Lp -Bp) les interactions entre les atomes liés au-delà de celles déjà prévues par collage paire de liaison paire (BP-BP) interactions. Produits d'addition impliquant les ions métalliques sont considérés comme des composés de coordination.
Définition solvant système
Cette définition est basée sur une généralisation de la définition antérieure Arrhenius à tous les solvants autodissociating. Dans tous ces solvants il ya une certaine concentration d'une espèce, les cations solvonium positives et négatives, des espèces anions solvate, en équilibre avec les molécules de solvant neutres. Par exemple:
- 2H 2 O ⇌ H 3 O + ( hydronium) + OH - ( hydroxyde )
- 2NH 3 ⇌ NH 4 + ( ammonium) + NH 2 - ( amide)
ou même certains systèmes aprotiques
- N 2 O 4 ⇌ NO + ( nitrosonium) + NO 3 - ( nitrate )
- 2SbCl 3 ⇌ SbCl 2 + (dichloroantimonium) + SbCl 4 - (tetrachloroantimonate)
Un soluté provoquant une augmentation de la concentration des ions solvonium et une diminution des ions de produit de solvatation est un acide et une causant l'inverse est une base. Ainsi, dans le liquide de l'ammoniac , KNH 2 (introduction de NH 2 -) est une base forte, et NH 4 NO 3 (introduction de NH 4 +) est un acide fort. En liquide le dioxyde de soufre (SO 2), composés de thionyle (SO fournir 2+) se comportent comme des acides, et sulfites (fournissant SO 3 2-) se comportent comme des bases.
Voici quelques réactions acide-base non aqueux dans l'ammoniac liquide
- 2NaNH 2 (base) + Zn (NH 2) 2 ( amide amphiphile) → Na 2 [Zn (NH 2) 4]
- 2NH 4 I (acide) + Zn (NH 2) 2 ( amide amphiphile) → [Zn (NH 3) 4)] I 2
L'acide nitrique peut être une base dans l'acide sulfurique liquide:
- HNO 3 (base) + 2H 2 SO 4 → NO 2 + + H 3 O + + 2HSO 4 -
Et les choses deviennent encore plus étrange dans le monde aprotique, par exemple dans le liquide N 2 O 4:
- AgNO 3 (base) + NOCl (acide) → N 2 O 4 + AgCl
Comme solvant définition du système dépend du solvant ainsi que sur le composé lui-même, le même composé peut changer son rôle en fonction du choix du solvant. Ainsi, HClO 4 est un acide fort dans l'eau, un acide faible en acide acétique et une base faible dans l'acide fluorosulfonique.
D'autres théories acide-base
Définition Usanovich
La définition la plus générale est celle du chimiste russe Mikhail Usanovich, et peut essentiellement se résumer comme définissant un acide comme tout ce qui accepte espèces négatives ou positives don, et une base que l'inverse. Ceci tend à se chevaucher le concept de redox (oxydation-réduction), et ne est donc pas très favorable par les chimistes. Ce est parce que les réactions d'oxydoréduction se concentrent davantage sur les processus de transfert d'électrons physiques, plutôt que de décision obligataire / processus obligataires rupture, bien que la distinction entre ces deux processus est quelque peu ambiguë.
Définition Lux-Flood
Cette définition, proposé par le chimiste allemand Hermann Lux en 1939 , encore améliorée par Circa Håkon Flood 1947 et maintenant couramment utilisé dans moderne géochimie et électrochimie de sels fondus, décrit un acide comme accepteur d'ions oxyde et d'une base en tant que donneur d'ions oxyde. Par exemple:
- MgO (base) + CO 2 (acide) → MgCO 3
- CaO (base) + SiO 2 (acide) → CaSiO 3
- NO 3 - (base) + S 2 O 7 2- (acide) → NO 2 + + 2SO 4 2-
Définition Pearson
En 1963 Ralph Pearson a proposé un concept connu sous le nom avancée qualitative Principe disque acide base souple, plus tard a fait quantitative avec l'aide de Robert Parr en 1984 . 'Hard' applique à des espèces qui sont de petite taille, ont des états de charge élevés et sont faiblement polarisable. 'Soft' applique à des espèces qui sont grandes, avoir des états de charge faible et sont fortement polarisable. Les acides et les bases interagissent et les interactions les plus stables sont difficiles dur et mou-mou. Cette théorie a trouvé une utilisation à la fois dans la chimie organique et inorganique.

