Fluoruro de cesio
Acerca de este escuelas selección Wikipedia
Esta selección se hace para las escuelas por caridad para niños leer más . SOS Children trabaja en 45 países africanos; puede ayudar a un niño en África ?
| Fluoruro de cesio | |
|---|---|
 | |
 | |
Fluoruro de cesio | |
Otros nombres Fluoruro de cesio | |
| Identificadores | |
| CAS | 13400-13-0 |
| Propiedades físicas | 24179 |
| Número RTECS | FK9650000 |
| Imágenes-Jmol 3D | Image 1 |
SONRISAS
| |
InChI
| |
| Propiedades | |
| Fórmula molecular | CsF |
| Masa molar | 151,90 g / mol |
| Apariencia | sólido cristalino blanco |
| Densidad | 4,115 g / cm 3 |
| Punto de fusion | 682 ° C (955 K) |
| Punto de ebullicion | 1251 ° C (1524 K) |
| Solubilidad en agua | 367 g / 100 ml (18 ° C) |
| Estructura | |
| Estructura cristalina | cúbico, CF8 |
| Grupo espacial | Fm 3 m, N ° 225 |
| Coordinación geometría | Octaédrico |
| Momento bipolar | 7.9 D |
| Peligros | |
| MSDS | MSDS externa |
| Índice de la UE | No enlistado |
| Punto de inflamabilidad | No es inflamable |
| Compuestos relacionados | |
| Otros aniones | Cloruro de cesio Bromuro de cesio Yoduro de cesio |
| Otros cationes | El fluoruro de litio El fluoruro de sodio Fluoruro de potasio Fluoruro de rubidio |
Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
Fluoruro de cesio (fluoruro de cesio en América del Norte), es un compuesto inorgánico normalmente encontrado como un sólido blanco higroscópico. Es más soluble y más fácilmente disociado de fluoruro de sodio o fluoruro de potasio. Está disponible en forma anhidra, y si el agua ha sido absorbida es fácil de secar mediante calentamiento a 100 ° C durante dos horas al vacío. Como todos los fluoruros solubles, es ligeramente básica. Un dato interesante de este compuesto es que es el compuesto más iónico. Cesio tiene el más bajo electronegatividad (aparte de francio, un elemento radiactivo extremadamente raro inestable), y el flúor tiene la más alta electronegatividad.
Síntesis y propiedades
Fluoruro de cesio se prepara por la acción de ácido fluorhídrico en o hidróxido de cesio carbonato de cesio, seguido de la eliminación de agua.
Fluoruro de cesio reacciona por lo general como una fuente de ion fluoruro, F -. Por lo tanto, se somete a todas las reacciones habituales asociados con fluoruros solubles, por ejemplo:
- 2 CSF + CaCl 2 → 2 CsCl + CaF 2
Estructura cristalina
Fluoruro de cesio tiene la estructura halita, lo que significa que el Cs + y F - Pack en una cúbico conjunto empaquetado más cercana al igual que Na + y Cl - en cloruro de sodio. Cationes de cesio son más grandes que los aniones fluoruro, mientras que en los haluros de litio, sodio, potasio, y rubidio, los cationes son más pequeños que el anión.
Aplicaciones
En síntesis orgánica
Ser altamente disociado es una fuente más reactivo de fluoruro que las sales relacionados. CsF es menor higroscópico alternativa a fluoruro de tetra-n-butilamonio (TBAF) y TAS-fluoruro (TASF) cuando anhidro "desnudo" fluoruro de iones se necesita.
Como una base
Al igual que con otros fluoruros solubles, CsF es moderadamente básica, porque HF es un ácido débil. El bajo nucleophilicity de fluoruro significa que puede ser una base útil en fluoruro de chemistry.Caesium orgánico es una base útil en la química orgánica , por el hecho de que el fluoruro de iones es un relativamente pobre nucleófilo. CsF da mayores rendimientos en Reacciones de condensación de Knoevenagel que KF o NaF.
La formación de enlaces CF.
Fluoruro de cesio es también una popular fuente de fluoruro en química organofluorine. Por ejemplo, reacciona con CsF hexafluoroacetona para formar una sal de cesio perfluoroalkoxide, que es estable hasta 60 ° C, a diferencia de los correspondientes de sodio o de potasio sal. Se convertirá deficiente en electrones cloruros de arilo a fluoruros de arilo ( reacción halex).
Agente de desprotección
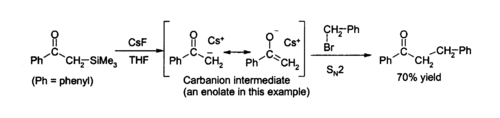
Debido a la fuerza del Si - F enlace, ion fluoruro es útil para reacciones desililación (eliminación de los grupos Si) en la química orgánica ; fluoruro de cesio es una excelente fuente de fluoruro anhidro para tales reacciones. La eliminación de los grupos de silicio ( desililación) es un importante recurso de la PPC en el laboratorio, como su naturaleza anhidra permite la formación limpia de agua intermedios -sensibles. Soluciones de fluoruro de cesio en THF o DMF atacan una amplia variedad de compuestos orgánicos de silicio para producir un fluoruro orgánico de silicio y una carbanión, que puede entonces reaccionar con electrófilos, por ejemplo:
La desililación también es útil para la eliminación de sililo grupos protectores.
Otros usos
Cristales sueltos de la sal son transparentes en lo profundo infrarrojos. Por esta razón, se utiliza a veces como las ventanas de células utilizadas para espectroscopia infrarroja.
Precauciones
Al igual que otros fluoruros solubles, CsF es moderadamente tóxico. El contacto con ácido se debe evitar, ya que esta forma altamente tóxica / corrosivo acido hidrofluorico. Cesio ion (Cs +), o cloruro de cesio, generalmente no se considera tóxico.