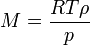Masa molar
Acerca de este escuelas selección Wikipedia
SOS cree que la educación da una mejor oportunidad en la vida para los niños en el mundo en desarrollo también. SOS Children ha cuidado de niños en África durante cuarenta años. ¿Puedes ayudar a su trabajo en África ?
Masa molar, símbolo M, es la masa de una mol de una sustancia ( elemento químico o compuesto químico ). Es un propiedad física que es característica de cada sustancia pura. La base Unidad del SI para masa es el kilogramo , pero, por razones prácticas e históricas, las masas molares son casi siempre expresados en gramos por mol (g / mol o g mol -1), especialmente en la química .
Masa molar está estrechamente relacionado con el peso de la fórmula (FW) o pariente masa molar (M r) de un compuesto, y al masas atómicas relativas o la pesos atómicos estándar de sus elementos constitutivos. Sin embargo, debe distinguirse de la masa molecular , que es la masa de una molécula (de cualquier composición isotópica individual) y no está directamente relacionada con la masa atómica, la masa de un átomo (de un solo isótopo). La dalton, símbolo Da, también se utiliza a veces como una unidad de masa molar, especialmente en bioquímica , con la definición 1 Da = 1 g / mol, a pesar del hecho de que es una unidad de masa molecular estrictamente (1 Da = 1.660 538 782 (83) × 10 -27 kg).
Masas molares casi nunca se miden directamente. Ellos pueden ser calculados a partir pesos atómicos estándar, ya menudo se enumeran en catálogos químicas y sobre hojas de datos de seguridad de materiales (MSDS). Masas molares suelen variar entre:
- 1-238 g / mol de átomos de elementos de origen natural;
- 10-1000 g / mol de compuestos químicos simples;
- 1000-5,000,000 g / mol para polímeros, proteínas , ADN fragmentos, etc.
Masas molares de los elementos
La masa molar de átomos de un elemento viene dada por la peso atómico estándar del elemento multiplicado por el constante masa molar, M u = 1 × 10 -3 kg / mol = 1 g / mol:
- M (H) = 1,007 97 (7) × 1 g / mol = 1,007 94 (7) g / mol
- M (S) = 32.065 (5) × 1 g / mol = 32,065 (5) g / mol
- M (Cl) = 35.453 (2) × 1 g / mol = 35,453 (2) g / mol
- M (Fe) = 55,845 (2) × 1 g / mol = 55,854 (2) g / mol
Multiplicando por la constante de masa molar se asegura de que el cálculo es dimensionalmente correcta: los pesos atómicos son magnitudes adimensionales (es decir, los números puros) mientras que las masas molares tienen unidades (en este caso, g / mol).
Algunos elementos se encuentran generalmente como moléculas , por ejemplo, hidrógeno (H 2), azufre (S 8), cloro (Cl 2). La masa molar de moléculas de estos elementos es la masa molar de los átomos multiplicado por el número de átomos en cada molécula:
- M (H 2) = 2 × 1,007 97 (7) × 1 g / mol = 2,015 88 (14) g / mol
- M (S 8) = 8 × 32.065 (5) × 1 g / mol = 256,52 (4) g / mol
- M (Cl 2) = 2 × 35.453 (2) × 1 g / mol = 70.906 (4) g / mol
Masas molares de los compuestos
La masa molar de un compuesto viene dada por la suma de la pesos atómicos estándar de los átomos que forman el compuesto multiplicado por el constante masa molar, M u:
- M (NaCl) = [22.989 769 28 (2) + 35.453 (2)] × 1 g / mol = 58,443 (2) g / mol
- M (C 12 H 22 O 11) = ([12 × 12,0107 (8)] + [22 × 1,007 94 (7)] + [11 × 15,9994 (3)]) x 1 g / mol = 486,424 (10) g / mol
Una masa molar media puede definirse para las mezclas de compuestos. Esto es particularmente importante en ciencia de los polímeros, donde las diferentes moléculas de polímero pueden contener diferentes números de unidades monoméricas (polímeros no uniforme).
Inmuebles relacionados
El peso molecular (MW) y peso de la fórmula (FW) son términos mayores de lo que ahora se denomina más correctamente la relación masa molar (M r). Esto es un cantidad adimensional (es decir, un número puro, sin unidades) igual a la masa molar dividida por el constante de masa molar.
Masa molecular
La masa molecular (m) es la masa de una molécula dada: se mide en daltons (Da) o unidades de masa atómica (u), donde 1 Da = 1 u = 1,660 538 782 (83) × 10 -27 kg). Diferentes moléculas del mismo compuesto pueden tener diferentes masas moleculares, ya que contienen diferentes isótopos de un elemento. La masa molar es una medida de la masa molecular promedio de todas las moléculas en una muestra, y es generalmente la medida más apropiada cuando se trata de macroscópicas (ponderables) las cantidades de una sustancia.
Las masas moleculares se calculan a partir de la masas atómicas relativas de cada nucleido, mientras que las masas molares se calculan a partir de la pesos atómicos de cada elemento . El peso atómico tiene en cuenta la distribución isotópica del elemento en una muestra dada (por lo general supone que es "normal"). Por ejemplo, el agua tiene una masa molar de 18,0153 (3) g / mol, pero las moléculas de agua individuales tienen masas moleculares que oscilan entre 18.010 564 6.863 (15) u (1 H 2 O) y 16 22,027 7,364 (9) u (2 H 2 18 O).
La distinción entre la masa molar y la masa molecular es importante porque masas moleculares relativas pueden ser medidos directamente por espectrometría de masas , a menudo con una precisión de unos pocos partes por millón. Esto es lo suficientemente precisa para determinar directamente la fórmula química de una molécula.
La precisión y la incertidumbre
La precisión con la que se conoce una masa molar depende de la precisión de la los pesos atómicos de la que fue calculada. La mayoría de los pesos atómicos son conocidos con una precisión de al menos una parte en diez mil, a menudo mucho mejor (el peso atómico del litio es un notable, y serio, excepción). Esto es adecuado para casi todos los usos normales de la química: es más precisa que la mayoría de los análisis químicos , y excede la pureza de la mayoría de los reactivos de laboratorio.
La precisión de Atomics pesos, y por lo tanto de las masas molares, está limitada por el conocimiento de la distribución isotópica del elemento. Si se requiere un valor más exacto de la masa molar, es necesario determinar la distribución isotópica de la muestra en cuestión, que puede ser diferente de la distribución estándar que se utiliza para calcular el peso atómico estándar. Las distribuciones isotópicas de los diferentes elementos en una muestra no son necesariamente independientes uno de otro: por ejemplo, una muestra que ha sido destilada será enriquecido en los más ligeros isótopos de todos los elementos presentes. Esto complica el cálculo de la incertidumbre estándar en la masa molar.
Una convención útil para el trabajo normal de laboratorio es citar masas molares de dos decimales para todos los cálculos. Esto es más exacto que se requiere normalmente, pero evita errores de redondeo durante los cálculos. Cuando la masa molar es mayor que 1.000 g / mol, rara vez es apropiado utilizar más de un lugar decimal. Estas convenciones se siguen en valores más tabulados de pesos moleculares.
Medición
Mientras masas molares son casi siempre, en la práctica, calculada a partir de los pesos atómicos, también pueden ser medidos en ciertos casos. Estas mediciones son mucho menos precisos que modernas de espectrometría de masas mediciones de pesos atómicos y masas moleculares, y son de interés principalmente histórico. Todos los procedimientos se basan en propiedades coligativas, y cualquier disociación del compuesto debe ser tenida en cuenta.
Densidad de vapor
La medición de la masa molar por la densidad de vapor se basa en el principio, primero enunciada por Amadeo Avogadro, que volúmenes iguales de gases bajo condiciones idénticas contienen el mismo número de partículas. Este principio está incluido en el ecuación de los gases ideales:
donde n es el cantidad de sustancia. La densidad de vapor (ρ) viene dada por
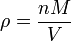 .
.
La combinación de estas dos ecuaciones da una expresión para la masa molar en términos de la densidad de vapor para las condiciones de conocida la presión y la temperatura .
Descenso crioscópico
El punto de congelación de una solución es menor que la de la pura disolvente , y la depresión del punto de congelación (Δ T) es directamente proporcional a la concentración cantidad para las soluciones diluidas. Cuando la concentración de cantidad se expresa como una molalidad, la constante de proporcionalidad se conoce como la crioscópico constante (K f) y es característico para cada disolvente. Si w representa la fracción de masa de la soluto en solución, y suponiendo que no hay disociación del soluto, la masa molar está dada por
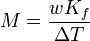 .
.
La elevación del punto de ebullición
El punto de ebullición de una solución de un no volátil soluto es mayor que el de la pura disolvente , y la elevación del punto de ebullición (Δ T) es directamente proporcional a la concentración cantidad para las soluciones diluidas. Cuando la concentración de cantidad se expresa como una molalidad, la constante de proporcionalidad se conoce como la ebulloscópica constante (K b) y es característico para cada disolvente. Si w representa la fracción de masa del soluto en solución, y suponiendo que no hay disociación del soluto, la masa molar está dada por
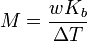 .
.