Tetracloruro de carbono
Sabías ...
SOS Children han producido una selección de artículos de la Wikipedia para escuelas desde 2005. SOS Children ha cuidado de niños en África durante cuarenta años. ¿Puedes ayudar a su trabajo en África ?
| Tetracloruro de carbono | |
|---|---|
 |  |
Tetracloruro de carbono | |
Otros nombres Benziform, cloruro de carbono, tetracloruro de metano, perchloromethane, Carbon tet, Benzinoform, Tetraform, Tetrasol, Freón 10, Halon 104, ONU 1846 | |
| Identificadores | |
| CAS | 56-23-5 |
| PubChem | 5943 |
| Número CE | 200-262-8 |
| KEGG | C07561 |
| ChEBI | CHEBI: 27385 |
| Número RTECS | FG4900000 |
| Imágenes-Jmol 3D | Image 1 |
SONRISAS
| |
InChI
| |
| Propiedades | |
| Fórmula molecular | CCl4 |
| Masa molar | 153,82 g / mol |
| Apariencia | Líquido incoloro |
| Densidad | 1,5842 g / cm 3, líquidos 1,831 g.cm -3 a -186 ° C (sólido) |
| Punto de fusion | -22,92 ° C (250 K) |
| Punto de ebullicion | 76,72 ° C (350 K) |
| Solubilidad en agua | 0,8 g / L a 25 ° C |
| log P | 2.64 |
| Presión del vapor | 11,94 kPa a 20 ° C |
| k H | 365 kJ.mol -1 a 24,8 ° C |
| Estructura | |
| Estructura cristalina | Monoclínico |
| Forma molecular | Tetraédrica |
| Peligros | |
| MSDS | MSDS externa |
| Clasificación de la UE | Tóxico (T), Carc. Gato. 2B, Peligroso para el medio ambiente (N) |
| Frases R | R23 / 24/25, R40, R48 / 23, R59, R52 / 53 |
| Frases S | (S1 / 2), S23, S36 / 37, S45, S59, S61 |
| NFPA 704 |  0 3 0 |
| Punto de inflamabilidad | No inflamable |
| Página de datos complementaria | |
| Estructura y propiedades | n, ε r, etc. |
| Termodinámica datos | Comportamiento de fase Sólido, líquido, gas |
| Los datos espectrales | UV, IR, RMN , MS |
| Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
El tetracloruro de carbono, también conocido por muchos otros nombres (véase el cuadro) es el compuesto químico con la fórmula CCl 4. Es un reactivo en química sintética y fue antiguamente utilizado ampliamente en extintores y como un precursor a refrigerantes. Es un líquido incoloro con un olor "dulce" que puede ser detectada en niveles bajos.
Tanto el tetracloruro de carbono y tetracloruro de carbono son nombres aceptables bajo la nomenclatura de la IUPAC . Coloquialmente, se llama "tet de carbono".
Historia y síntesis
La producción de tetracloruro de carbono ha disminuido abruptamente desde la década de 1980 debido a las preocupaciones ambientales y la disminución de la demanda de CFC, que se deriva de tetracloruro de carbono. En 1992, la producción en los EE.UU.-Europa-Japón se estimó en 720 millones kg.
El tetracloruro de carbono se sintetizó originalmente en 1839 por reacción de cloroformo con cloro, desde el químico francés Henri Victor Regnault, pero ahora se sintetiza principalmente de metano:
- CH 4 + 4 Cl 2 → CCL 4 + 4 HCl
La producción a menudo utiliza subproductos de otros reacciones de cloración, tales como las síntesis de diclorometano y cloroformo. Clorocarbonos más altos también son sometidos a "chlorinolysis:"
- C 2 Cl 6 + Cl 2 → 2 CCl4
Antes de los años 1950, tetracloruro de carbono fue fabricado por la cloración de disulfuro de carbono a 105 a 130 ° C:
- CS 2 + 3 Cl 2 → CCl4 + S 2 Cl 2
Propiedades
En el tetracloruro de carbono molécula , cuatro de cloro átomos están colocados simétricamente como esquinas en un tetraédrica configuración unido a un carbono átomo, en el centro, por sola enlaces covalentes. Debido a esta geometría simétrica, la molécula tiene ninguna red de momento bipolar; es decir, CCl 4 es no polar. Como disolvente , es muy adecuado para disolver otros compuestos no polares, grasas y aceites. Es algo volátil, emitiendo vapores que tiene un olor característico de otros disolventes clorados, algo similar a la tetracloroetileno olor que recuerda a tiendas tintorerías.
Tetraclorometano sólido tiene 2 alótropos : cristalina II siguiente -47,5 ° C (225,6 K) y cristalinas I anterior -47,5 ° C.
En -47,3 ° C tiene estructura cristalina monoclínica con grupo espacial C2 / c y celosía constantes A = 20.3, b = 11.6, c = 19,9 (0,10 -1 nm), β = 111 °.
Usos
En el siglo 20, el tetracloruro de carbono se utiliza ampliamente como un limpieza en seco solvente , como refrigerante, y en extintores. Sin embargo, una vez que se hizo evidente que la exposición tetracloruro de carbono tuvo graves efectos adversos para la salud, alternativas más seguras, como tetracloroetileno se encontraron resultados para estas aplicaciones, y su uso en estos papeles se redujo de unos 1.940 en adelante. El tetracloruro de carbono persistió como una pesticida para matar insectos en granos almacenados, pero en 1970 , que fue prohibida en los productos de consumo en el Estados Unidos .
Antes de la Protocolo de Montreal, se usaron grandes cantidades de tetracloruro de carbono para producir el refrigerantes freón R-11 ( triclorofluorometano) y R-12 ( diclorodifluorometano). Sin embargo, estos refrigerantes ahora se cree que desempeñan un papel en el agotamiento del ozono y se han eliminado. El tetracloruro de carbono aún se utiliza para la fabricación de refrigerantes menos destructivas.
El tetracloruro de carbono también se ha utilizado en la detección de neutrinos. El tetracloruro de carbono es uno de los más potentes hepatotoxinas, y se utiliza widly en la investigación científica para evaluar agentes hepatoprotectores 7,8
Reactividad
El tetracloruro de carbono no tiene prácticamente ninguna inflamabilidad a temperaturas más bajas. En virtud de las altas temperaturas en el aire, se forma venenosa fosgeno.
Debido a que no tiene enlaces CH, tetracloruro de carbono no sufre fácilmente reacciones de radicales libres. Por lo tanto, es un disolvente útil para halogenaciones ya sea por el halógeno elemental, o por un reactivo de halogenación tal como N -bromosuccinimida.
En química orgánica , tetracloruro de carbono sirve como una fuente de cloro en el Reacción Appel.
Solvente
Se utiliza como disolvente en la investigación de la química sintética, pero debido a sus efectos adversos para la salud, es utilizado ya no comúnmente, y los químicos en general, tratar de sustituirlo con otros disolventes. A veces es útil como un disolvente para espectroscopia infrarroja porque no hay bandas de absorción significativas> 1600 cm -1. Debido a que el tetracloruro de carbono no tiene ningún átomo de hidrógeno, fue utilizado históricamente en protones espectroscopía de RMN . Sin embargo, el tetracloruro de carbono es tóxico, y su poder de disolución es baja. Su uso ha sido sustituida en gran parte por disolventes deuterados, que ofrecen propiedades de solvatación superiores y permiten la estabilización del deuterio por el espectrómetro.
Seguridad
La exposición a altas concentraciones de tetracloruro de carbono (incluyendo vapor) puede afectar a la sistema nervioso central, degenere el hígado y los riñones y puede resultar (después de la exposición prolongada) en coma e incluso la muerte . La exposición crónica al tetracloruro de carbono puede causar hígado y daño renal y podría resultar en cáncer Más información se puede encontrar en Hojas de datos de seguridad de los materiales.
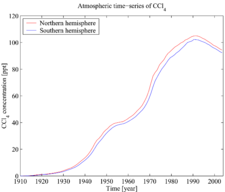
El tetracloruro de carbono es también tanto que agotan el ozono y un gas de efecto invernadero . Sin embargo, desde 1992 las concentraciones atmosféricas han estado en declive por las razones descritas anteriormente (véase también la figura de series de tiempo atmosférico).