Cobre (II) cloruro de
Acerca de este escuelas selección Wikipedia
Voluntarios SOS ayudaron a elegir artículos e hicieron otro material curricular Apadrinar un niño para hacer una diferencia real.
| Cobre (II) cloruro de | |
|---|---|
 | |
 | |
 | |
Cobre (II) cloruro de | |
Otros nombres Cloruro cúprico | |
| Identificadores | |
| CAS | 7447-39-4 10125-13-0 (dihidrato) |
| PubChem | 169664 |
| Propiedades físicas | 148374 |
| UNII | P484053J2Y |
| Número RTECS | GL7000000 |
| Imágenes-Jmol 3D | Image 1 Image 2 |
SONRISAS
| |
InChI
| |
| Propiedades | |
| Fórmula molecular | CuCl 2 |
| Masa molar | 134,45 g / mol (anhidro) 170,48 g / mol (dihidrato) |
| Apariencia | amarillo-marrón sólido (anhidro) sólido azul-verde (dihidrato) |
| Densidad | 3,386 g / cm 3 (anhidro) 2,51 g / cm 3 (dihidrato) |
| Punto de fusion | 498 ° C (anhidro) |
| Punto de ebullicion | 993 ° C (anhidro, descomp) |
| Solubilidad en agua | 70,6 g / 100 ml (0 ° C) 75,7 g / 100 ml (25 ° C) |
| Estructura | |
| Estructura cristalina | distorsionado CdI estructura 2 |
| Coordinación geometría | Octaédrico |
| Peligros | |
| MSDS | Fischer Scientific |
| Clasificación de la UE | No enlistado |
| NFPA 704 |  0 2 1 |
| Punto de inflamabilidad | No es inflamable |
| Compuestos relacionados | |
| Otros aniones | Copper (II) de fluoruro Cobre (II) bromuro de |
| Otros cationes | De cobre (I) cloruro de El cloruro de plata Cloruro de oro (III) |
Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
Cobre (II) es el cloruro de compuesto químico con la fórmula CuCl 2. Este es un sólido marrón claro, que absorbe lentamente humedad para formar un color azul-verde dihidrato. El cobre (II) cloruros son algunos de los más comunes de cobre (II) compuestos, después de sulfato de cobre.
Estructura
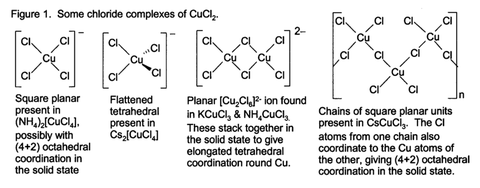
Anhidro CuCl 2 adopta una distorsionada estructura de yoduro de cadmio. En este motivo, los centros de cobre son octaédrica. La mayoría de cobre (II) Los compuestos exhiben distorsiones de la geometría octaédrica idealizado, debido a la Efecto Jahn-Teller, que en este caso se describe la localización de un D-electrón en una orbital molecular antienlazante que está fuertemente con respecto a un par de ligandos de cloruro. En CuCl 2 · 2H 2 O, el cobre de nuevo adopta una geometría octaédrica altamente distorsionado, el Cu (II) Centros de estar rodeado por dos ligandos de agua y cuatro ligandos de cloruro, la cual puente asimétricamente a otros centros de Cu.
Copper (II) de cloruro es paramagnético. De interés histórico, CuCl2 · 2H 2 O se utilizó en la primera mediciones de resonancia paramagnética de electrones por Yevgeny Konstantinovich Zavoisky en 1944.
Propiedades y reacciones

Solución acuosa preparada a partir de cobre (II) cloruro contiene una gama de cobre (II) dependiendo de la concentración, la temperatura, y la presencia de iones cloruro adicionales. Estas especies incluyen el color azul de [Cu (H 2 O) 6] 2+ y de color amarillo o rojo de los complejos de haluro de la fórmula [CuCl 2 + x] x-.

Se descompone a CuCl y Cl 2 a 1000 ° C:
- 2 CuCl 2 → 2 Cl 2 + CuCl
Reacciona con HCl u otro fuentes de cloruro para formar iones complejos: el CuCl rojo 3 -, y el amarillo CuCl 4 2-.
- CuCl 2 + 2 Cl -
 CuCl -
CuCl -
3 + Cl - CuCl 2-
CuCl 2-
4
Algunos de estos complejos se pueden cristalizar de la solución acuosa, y adoptan una amplia variedad de tipos estructurales (Fig. 1).
Cobre (II) precipita hidróxido sobre el tratamiento de (II) soluciones de cloruro de cobre con la base de:
- CuCl 2 + 2 NaOH → Cu (OH) 2 + 2 NaCl
Cobre (II) cloruro de forma también una variedad de complejos de coordinación con ligandos tales como piridina y óxido de trifenilfosfina:
- CuCl 2 + 2 C 5 H 5 N → [CuCl 2 (C 5 H 5 N) 2] (tetragonal)
- CuCl 2 + 2 (C 6 H 5) 3 P = O → [CuCl2 ((C 6 H 5) 3 P = O) 2] (tetraédrico)
Sin embargo ligandos "blandos" como fosfinas (por ejemplo, trifenilfosfina), yoduro, y cianuro, así como algunos terciarias aminas causa reducción para dar complejos de cobre (I). Para convertir de cobre (II) cloruro de cobre (I) derivados que generalmente es más conveniente para reducir una solución acuosa con dióxido de azufre como reductor:
- 2 CuCl 2 + SO 2 + 2 H 2 O → 2 CuCl + 2 HCl + H 2 SO 4
La hidrólisis dan el oxicloruro de cobre, Cu 2 Cl (OH) 3, un fungicida popular.
Preparación
Cobre (II) cloruro se prepara comercialmente por la acción de cloración de cobre:
- Cu + Cl 2 + 2 H 2 O → CuCl2 (H 2 O) 2
También se puede generar mediante el tratamiento del hidróxido, óxido, o de cobre (II) de carbonato con ácido clorhídrico. La electrólisis de cloruro de sodio acuosa con electrodos de cobre produce (entre otras cosas) una espuma de color azul-verde que se puede recoger y se convierte en el hidrato.
CuCl2 anhidro puede prepararse directamente por unión de los elementos, cobre y cloro .
CuCl2 se puede purificar por cristalización en caliente diluida de ácido clorhídrico , por enfriamiento en un CaCl 2 baño del hielo.
Presencia natural
Cobre (II) cloruro se produce naturalmente como el tolbachite mineral muy raro y el dihidrato eriochalcite. Ambos se encuentran cerca fumarolas. Más comunes son oxihidróxido-cloruros mixtas como atacamita Cu2 (OH) 3 Cl, que surjan entre camas de mineral de zonas de oxidación de Cu en clima árido (también conocido a partir de algunas escorias alterados).
Usos
Co-catalizador en proceso Wacker
Una aplicación industrial importante para el cobre (II) cloruro es como un co-catalizador con paladio (II) cloruro en el Proceso Wacker. En este proceso, eteno (etileno) se convierte en etanal (acetaldehído) usando agua y aire. Durante la reacción, PdCl 2 es reduce a Pd , y la CuCl 2 sirve para volver a oxidar esto de nuevo a PdCl 2. Aire a continuación, puede oxidar la resultante CuCl volver a CuCl 2, completando el ciclo.
- C 2 H 4 + PdCl 2 + H 2 O → CH 3 CHO + Pd + 2 HCl
- Pd + 2 CuCl 2 → 2 CuCl + PdCl 2
- 4 CuCl + 4 HCl + O 2 → 4 CuCl 2 + 2 H 2 O
El proceso general es:
- 2 C 2 H 4 + O 2 → 2 CH 3 CHO
Cloraciones
Cobre (II) cloruro cataliza la cloración en la producción de cloruro de vinilo y dicloroetano.
Otras aplicaciones sintéticas orgánicas
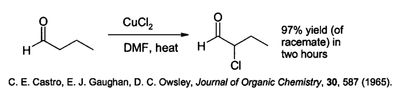
Cobre (II) cloruro tiene una variedad de aplicaciones especializadas en la síntesis de compuestos orgánicos. Efectúa cloración de hidrocarburos- aromático esto se realiza a menudo en la presencia de óxido de aluminio . Es capaz de clorar la posición alfa de compuestos de carbonilo:
Esta reacción se lleva a cabo en un disolvente polar tal como dimetilformamida (DMF), a menudo en presencia de cloruro de litio, lo que acelera la reacción.
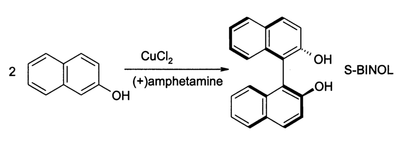
CuCl 2, en presencia de oxígeno , también puede oxidar fenoles. El producto principal se puede dirigir ya sea para dar una quinona o un producto acoplado de dimerización oxidativa. El último proceso proporciona una ruta de alto rendimiento para 1,1-binaftol:
Tales compuestos son intermedios en la síntesis de BINAP y sus derivados
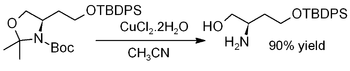
De cobre (II) dihidrato de cloruro promueve la hidrólisis de acetónidos, es decir, para la desprotección para regenerar dioles o aminoalcoholes, como en este ejemplo (donde TBDPS = terc -butildifenilsililo):
CuCl 2 también cataliza la adición de radicales libres de cloruros de sulfonilo a alquenos ; la alfa-chlorosulfone puede entonces someterse eliminación con base para dar un vinilo producto sulfona.
Usos de nicho
Cobre (II) cloruro también se utiliza en pirotecnia como un agente colorante azul / verde. En un prueba de la llama, cloruros de cobre, al igual que todos los compuestos de cobre, emiten verde-azul.
Seguridad
Se concentraciones tóxicas y sólo por debajo de 5 ppm se permite en el agua potable por parte de la Agencia de Protección Ambiental de Estados Unidos.