
Henipavirus
Acerca de este escuelas selección Wikipedia
SOS Children ha intentado que el contenido de Wikipedia más accesible por esta selección escuelas. patrocinio SOS Niño es cool!
| Henipavirus | |
|---|---|
| Clasificación Virus | |
| Grupo: | Grupo V ( (-) SsRNA) |
| Orden: | Mononegavirales |
| Familia: | Paramyxoviridae |
| Género: | Henipavirus |
| Especie tipo | |
| Hendravirus | |
| Especies | |
Henipavirus es un género de la familia Paramyxoviridae, orden Mononegavirales contienen dos miembros, Hendravirus y Nipahvirus. Los henipaviruses son naturalmente albergaban por Pteropid murciélagos frugívoros (zorros voladores) y se caracterizan por una gran genoma, una amplia gama de huéspedes y su reciente aparición como patógenos zoonóticos capaces de causar enfermedad y muerte en los animales domésticos y los seres humanos .
Estructura Virus


Henipavirus son pleomórficos (en forma variable), que varían en tamaño desde 40 hasta 600 nm de diámetro. Poseen un lípido de membrana que recubre una cáscara de viral proteína de la matriz. En el núcleo es un solo filamento helicoidal de origen genómico ARN fuertemente unido a la proteína N (nucleocápside) y asociado con el L (grande) y P (fosfoproteína) proteínas que proporcionan Actividad de la polimerasa de ARN durante la replicación.
En el interior de la membrana lipídica son picos de F (fusión) trímeros de proteínas y G (apego) tetrámeros de proteínas. La función de la proteína G es para unir el virus a la superficie de una célula huésped a través de ephrin B2, una proteína altamente conservada presente en muchos mamíferos. La proteína F de la membrana viral se fusiona con la membrana de la célula huésped, liberando el contenido del virión a la célula. También hace que las células infectadas para fusionar con las células vecinas para formar grandes, multinucleadas sincitios.
La estructura del genoma
Como con todos los virus en el orden Mononegavirales, el virus Hendra y de genomas de virus Nipah son no segmentado, de cadena sencilla- ARN de sentido negativo. Ambos genomas son 18,2 kb de tamaño y contienen seis genes correspondientes a seis proteínas estructurales.
En común con otros miembros de la subfamilia Paramyxovirinae, el número de nucleótidos en el genoma henipavirus es un múltiplo de seis, conocida como la "regla de los seis '. La desviación de la regla de seis años, a través de mutaciones o la síntesis del genoma incompleto, conduce a la replicación viral ineficiente, probablemente debido a las limitaciones estructurales impuestas por la unión entre el ARN y la proteína N.
Henipavirus emplean un proceso inusual llamada La edición de ARN para generar múltiples proteínas a partir de un solo gen. El proceso consiste en la inserción de adicional residuos de guanosina en el gen P mRNA antes de traducción. El número de residuos añadidos determina si el P, V o W proteínas se sintetizan. Las funciones de las proteínas V y W son desconocidas, pero pueden estar implicados en la interrupción de mecanismos antivirales host.
Virus Hendra
Aparición
Virus Hendra (originalmente Equina morbilivirus) fue descubierto en septiembre de 1994 cuando causó la muerte de catorce caballos , y un entrenador en un complejo de entrenamiento en Hendra, un suburbio de Brisbane en Queensland, Australia .
El caso índice, una yegua, se encuentra con otros 23 caballos después de caer enfermo y murió dos días después. Posteriormente, el 19 de los caballos restantes sucumbieron con 13 moribundos. Tanto el entrenador y un mozo de cuadra estaban involucrados en la enfermería del caso índice y ambos cayeron enfermos dentro de una semana de la muerte del caballo con una enfermedad similar a la influenza. El mozo de cuadra se recuperó mientras que el entrenador murió de insuficiencia respiratoria y renal. La fuente de virus era más probable descarga nasal espumosa del caso índice.
Un segundo brote se produjo en agosto de 1994 (cronológicamente anterior al primer brote) en Mackay 1000 kilometros al norte de Brisbane que resulta en la muerte de dos caballos y su propietario. El propietario asistido en autopsias de los caballos y el plazo de tres semanas fue ingresado en hospital con meningitis . Se recuperó, pero 14 meses después desarrolló signos neurológicos y murió. Este brote fue diagnosticado a posteriori por la presencia de virus Hendra en el cerebro del paciente.
Una encuesta de la vida silvestre en las zonas de brote se llevó a cabo y se identificó murciélagos de la fruta pteropid como la fuente más probable del virus de Hendra con un seroprevalencia del 47%. Todas las otras 46 especies muestreadas fueron negativos. Virus aislamientos del tracto reproductivo y la orina de los murciélagos silvestres indican que la transmisión a los caballos puede haber ocurrido a través de la exposición al bate de orina o fluidos de parto ..
Brotes
Un total de ocho brotes de virus de Hendra se han producido desde 1994, todas relacionadas con la infección de los caballos. Cuatro de estos brotes se han extendido a los seres humanos como resultado del contacto directo con los caballos infectados.
- Agosto de 1994, Mackay, Queensland: La muerte de dos caballos y una persona.
- Septiembre de 1994, Brisbane, Queensland: 14 caballos murió de un total de 20 infectados. Dos personas infectadas con una muerte.
- Enero de 1999, Cairns, Queensland: Muerte de un caballo.
- Octubre de 2004, Cairns, Queensland: Muerte de un caballo. Un veterinario involucrado en la autopsia del caballo estaba infectado con el virus de Hendra y sufrió una enfermedad leve.
- Diciembre de 2004, Townsville, Queensland: Muerte de un caballo.
- Junio de 2006, Sunshine Coast, Queensland: Muerte de un caballo.
- Julio de 2008, Brisbane, Queensland: Infección de tres caballos con una muerte. Un trabajador de veterinaria de la propiedad afectada dio positivo a los anticuerpos contra el virus de Hendra.
- Julio de 2008, Cannonvale, Queensland: Muerte de un caballo.
La distribución de los zorros voladores negro y anteojos cubre los focos de la enfermedad, y el momento de los incidentes indica un patrón estacional de los brotes posiblemente relacionados con la estacionalidad de murciélago de la fruta de parto. Como no hay evidencia de transmisión a los seres humanos directamente de los murciélagos, se piensa que la infección humana sólo se produce a través de un huésped intermediario.
Patología
Los zorros voladores no son afectados por la infección por el virus de Hendra. Los síntomas de la infección por el virus de Hendra de las personas puedan ser respiratoria, incluyendo hemorragia y edema de los pulmones, o encephalitic resultando en meningitis . En los caballos, la infección suele causar edema pulmonar y congestión.
Virus Nipah
Aparición

Virus Nipah fue identificado en 1999 cuando causó un brote de enfermedad neurológica y respiratoria en las granjas de cerdos en la península de Malasia , lo que resulta en 105 muertes humanas y el sacrificio de un millón de cerdos. En Singapur , 11 casos, incluyendo una muerte ocurrieron en trabajadores de mataderos expuestos a cerdos importados de las granjas de Malasia afectados. El virus Nipah ha sido clasificado por el CDC como agente Categoría C ( http://www.bt.cdc.gov/agent/agentlist-category.asp).
Los síntomas de la infección por el brote de Malasia fueron principalmente encefalitis en humanos y respiratoria en cerdos. Brotes posteriores han causado enfermedades respiratorias en los seres humanos, lo que aumenta la probabilidad de transmisión de humano a humano y que indica la existencia de cepas más peligrosas del virus.
Con base en los datos de seroprevalencia y aislamientos de virus, el principal reservorio para el virus de Nipah fue identificado como murciélagos de la fruta Pteropid incluyendo Pteropus vampyrus (malayo zorro volador) y Pteropus hypomelanus (Isla zorro volador), ambos de los cuales se producen en Malasia.
La transmisión del virus de Nipah de zorros voladores a los cerdos se cree que es debido a una creciente superposición entre los hábitats de murciélagos y porquerizas en la península de Malasia. En la granja índice, huertos frutales estaban en las proximidades de la pocilga, permitiendo que el derrame de orina, las heces y la fruta parcialmente comido en los cerdos. Los estudios retrospectivos demuestran que spillover viral en cerdos puede haber estado ocurriendo en Malasia desde 1996 sin ser detectado. Durante 1998, la propagación viral fue ayudada por la transferencia de los cerdos infectados a otras granjas donde se produjeron nuevos brotes.
Brotes
Ocho brotes de virus de Nipah más han ocurrido desde 1998 , todo dentro de Bangladesh y vecinos partes de la India . Los focos de la enfermedad se encuentran dentro de la gama de especies de Pteropus (Pteropus giganteus). Al igual que con el virus de Hendra, el calendario de los brotes indica un efecto estacional.
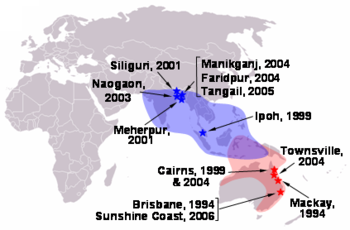
- 2001 enero 31 a febrero 23, Siliguri, India: 66 casos con una tasa de mortalidad del 74%. 75% de los pacientes eran o personal del hospital o había visitado uno de los otros pacientes en el hospital, lo que indica la transmisión de persona a persona.
- 2001 abril-mayo, Distrito Meherpur, Bangladesh: 13 casos con nueve muertes (mortalidad 69%).
- 2003 enero Distrito Naogaon, Bangladesh: 12 casos con ocho muertes (mortalidad 67%).
- 2004 enero-febrero, Manikganj y Provincias Rajbari, Bangladesh: 42 casos con 14 muertes (mortalidad 33%).
- 2004 19 de febrero - 16 de abril de El distrito de Faridpur, Bangladesh: 36 casos con 27 muertes (mortalidad 75%). La evidencia epidemiológica sugiere fuertemente que este brote afectó a la transmisión de persona a persona del virus de Nipah, que anteriormente no había sido confirmado. 92% de los casos involucrado estrecho contacto con al menos otra persona infectada con el virus Nipah. Dos casos se trataba de una sola exposición corta a un paciente enfermo, incluyendo un conductor de rickshaw que transportaba a un paciente al hospital. Además, al menos seis casos se trataba de síndrome de dificultad respiratoria aguda que no se ha informado anteriormente para la enfermedad por el virus Nipah en seres humanos. Este síntoma es probable que hayan asistido de humano a humano de transmisión a través de gran dispersión de las gotas.
- 2005 Enero, Distrito de Tangail, Bangladesh: 12 casos con 11 muertes (mortalidad 92%). El virus fue probablemente contrajo a partir de jugo de palma fecha potable contaminada por excrementos de murciélagos de la fruta o la saliva.
- 2007 febrero a mayo, Nadia District, India: hasta 50 casos sospechosos con 5.3 muertes. El foco de la enfermedad limita con el distrito de Bangladesh Kushtia donde ocurrieron ocho casos de encefalitis por el virus Nipah con cinco víctimas mortales durante marzo y abril de 2007. Esto fue precedido por un brote en Thakurgaon durante enero y febrero que afecta a siete personas, con tres muertes. Los tres brotes mostraron evidencia de transmisión de persona a persona.
- 2008 febrero-marzo, Manikganj y Rajbari provincias, Bangladesh: Nueve casos con ocho víctimas mortales.
Once casos aislados de encefalitis por el virus Nipah también se han documentado en Bangladesh desde 2001.
Virus Nipah se ha aislado de zorro volador de Lyle (Pteropus lylei) en Camboya y el ARN viral se encuentra en la orina y la saliva de P. lylei y de Horsfield bate roundleaf (Hipposideros larvartus) en Tailandia . Virus infeccioso también se ha aislado de muestras ambientales de murciélago orina y fruta parcialmente comido en Malasia. Los anticuerpos a henipaviruses también se han encontrado en murciélagos de la fruta (Pteropus rufus, Eidolon dupreanum) en Madagascar que indica una amplia distribución geográfica de los virus. No hay infección de los seres humanos u otras especies se han observado en Camboya, Tailandia o Madagascar.
Patología
En los seres humanos, la infección se presenta como fiebre, dolor de cabeza y somnolencia. Tos, dolor abdominal, náuseas, vómitos, debilidad, problemas para tragar y visión borrosa son relativamente comunes. Alrededor de una cuarta parte de los pacientes tienen convulsiones y alrededor del 60% se convierten en estado de coma y podría necesitar ventilación mecánica. En los pacientes con enfermedad grave, su estado consciente puede deteriorarse y que puede desarrollar hipertensión grave, ritmo cardíaco rápido, y muy alta temperatura.
Virus Nipah es también conocido por causar encefalitis recaída. En el brote de Malasia inicial, un paciente presentó recidiva de la encefalitis de unos 53 meses después de su infección inicial. No existe un tratamiento definitivo para la encefalitis Nipah, aparte de las medidas de apoyo, como la ventilación mecánica y la prevención de la infección secundaria. La ribavirina, un medicamento antiviral, se puso a prueba en el brote de Malasia y los resultados fueron alentadores, aunque todavía se necesitan más estudios.
En los animales, especialmente en cerdos, el virus causa respiratorio porcino y síndrome neurológico también conocido como síndrome de ladrar cerdo o una milla de la tos.
Las causas de la Aparición
La aparición de henipaviruses paralela a la aparición de otros virus zoonóticos en las últimas décadas. Coronavirus del SRAS, Lisavirus del murciélago australiano, Virus Menangle y, probablemente, Virus Ébola y Virus Marburg también se albergaba por murciélagos y son capaces de infectar a una gran variedad de otras especies. La aparición de cada uno de estos virus se ha relacionado con un aumento de contacto entre los murciélagos y los seres humanos, a veces con un huésped animal doméstico intermedio. El aumento de los contactos es impulsado tanto por la invasión humana en el territorio de los murciélagos (en el caso de Nipah, pocilgas específicamente en dicho territorio) y por el movimiento de los murciélagos hacia las poblaciones humanas debido a cambios en la distribución de alimentos y la pérdida de hábitat.
Hay evidencia de la pérdida de hábitat para zorros, tanto en el sur de Asia y Australia que vuelan (en particular a lo largo de la costa este), así como la invasión de las viviendas humanas y la agricultura en los hábitats restantes, creando una mayor superposición de humano y volar distribuciones zorro.

