
Chromatographie
Contexte des écoles Wikipédia
Cette sélection écoles a été choisi par SOS Enfants pour les écoles dans le monde en développement ne ont pas accès à Internet. Il est disponible en téléchargement intranet. SOS Enfants a regardé des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?

Chromatographie [| krəʊmə | tɒgrəfi] (de grec χρῶμα chroma «couleur» et graphein γράφειν «écrire») est le terme collectif pour un ensemble de techniques de laboratoire pour le la séparation de mélanges. Le mélange est dissous dans un liquide appelé la phase mobile, ce qui le transporte à travers une structure de maintien d'un autre matériau appelé la phase stationnaire. Les différents constituants du mélange de Voyage à des vitesses différentes, ce qui les séparent. La séparation est basée sur le partitionnement différentiel entre les phases mobile et stationnaire. Des différences subtiles dans un composé de Résultat de coefficient de partage de la rétention différentiel sur la phase stationnaire et en changeant ainsi la séparation.
La Chromatographie peut être préparative ou analytique. Le but de la chromatographie préparative est de séparer les composants d'un mélange pour une utilisation plus avancée (et est donc une forme de purification). Chromatographie analytique se fait normalement avec de plus petites quantités de matière et est destiné à mesurer les proportions relatives d'analytes dans un mélange. Les deux ne sont pas mutuellement exclusives.
Histoire

Chromatographie, littéralement «écriture de couleur", a d'abord été employé par le scientifique russe Mikhail Tsvet en 1900. Il a continué à travailler avec la chromatographie dans la première décennie du 20ème siècle, principalement pour la séparation des plantes pigments tels que chlorophylle, carotènes, et xanthophylles. Étant donné que ces composants ont des couleurs différentes (vert, orange, et jaune, respectivement) ils ont donné la technique son nom. De nouveaux types de chromatographie développés au cours des années 1930 et 1940 ont fait la technique utile pour beaucoup les procédés de séparation.
technique de chromatographie développée sensiblement à la suite des travaux de Archer John Porter Martin et Richard Laurence Millington Synge pendant les années 1940 et 1950. Ils ont établi les principes et techniques de base de chromatographie de partage, et leur travail ont encouragé le développement rapide de plusieurs méthodes chromatographiques: chromatographie sur papier, chromatographie en phase gazeuse, et ce qui allait devenir connu sous le nom haute performance de chromatographie en phase liquide. Depuis, la technologie a progressé rapidement. Les chercheurs ont constaté que les grands principes de la chromatographie de Tsvet pourraient être appliquées dans de nombreuses façons différentes, résultant dans les différentes variétés de chromatographie décrites ci-dessous. Les progrès sont continuellement améliorer la performance technique de chromatographie, permettant la séparation de molécules de plus en plus similaires.
Conditions de chromatographie
- L'analyte est la substance à séparer au cours de la Chromatographie.
- Chromatographie analytique est utilisée pour déterminer l'existence et éventuellement la concentration d'analyte (s) dans un échantillon.
- Une phase greffée est une phase stationnaire qui est lié par covalence à des particules de support ou à la paroi intérieure du tube de colonne.
- Un chromatogramme est la sortie visuelle du chromatographe. Dans le cas d'une séparation optimale, ou des motifs différents pics sur le chromatogramme correspondent aux différents composants du mélange séparé.
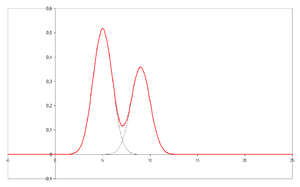
- Représentée sur l'axe des x est le temps de rétention et tracée sur l'axe y d'un signal (par exemple obtenue par un spectrophotomètre, un spectromètre de masse ou une variété d'autres détecteurs) correspondant à la réponse produite par les analytes de sortir du système. Dans le cas d'un système optimal du signal est proportionnelle à la concentration de l'analyte spécifique séparé.
- Un chromatographe est un équipement qui permet une séparation par exemple chromatographie en phase gazeuse sophistiqués ou séparation chromatographique liquide.
- La chromatographie est un procédé physique de séparation qui distribue des composants à séparer entre deux phases, l'une fixe (phase stationnaire), tandis que l'autre (la phase mobile) se déplace dans une direction définie.
- L'éluat est la phase mobile sortant de la colonne.
- L'éluant est le solvant qui transporte l'analyte.
- Une éluotropique série est une liste de solvants classés en fonction de leur pouvoir élution.
- Une phase immobilisée est une phase stationnaire qui est immobilisé sur les particules de support, ou sur la paroi intérieure du tube de colonne.
- La phase mobile est la phase qui se déplace dans une direction définie. Il peut être un liquide (LC et électrochromatographie capillaire (CEC)), un gaz (GC), ou un fluide supercritique (chromatographie supercritique fluide, SFC). La phase mobile est constituée de l'échantillon étant séparé / analysé et le solvant qui se déplace l'échantillon à travers la colonne. Dans le cas de La phase mobile HPLC est constitué d'un solvant non polaire (s) tel que l'hexane en phase normale ou inverse dans des solvants polaires chromatographie en phase et étant séparée de l'échantillon. La phase mobile se déplace à travers la colonne de chromatographie (phase stationnaire) dans laquelle l'échantillon interagit avec la phase stationnaire et est séparée.
- Chromatographie préparative est utilisée pour purifier des quantités suffisantes d'une substance pour une utilisation ultérieure, au lieu de l'analyse.
- Le temps de rétention est le temps caractéristique nécessaire pour un analyte particulier à passer à travers le système (à partir de l'entrée de la colonne au détecteur) dans des conditions définies. Voir aussi: L'indice de rétention de Kovats
- L'échantillon est analysé la question en chromatographie. Il peut être constitué d'un seul composant ou il peut être un mélange de composants. Lorsque l'échantillon est traité dans le cadre d'une analyse, la phase ou les phases contenant les analytes d'intérêt est / sont considérés comme l'échantillon alors que tout par intérêt séparé de l'échantillon avant ou au cours de l'analyse est appelée comme des déchets.
- Le soluté se réfère aux composants de l'échantillon à la chromatographie de partage.
- Le solvant se réfère à toute substance capable de solubiliser une autre substance, et en particulier la phase mobile liquide en chromatographie liquide.
- La phase stationnaire est la substance fixée à la place de la procédure de Chromatographie. Des exemples comprennent la silice en couche Chromatographie en couche mince
La chromatographie est basée sur le concept du coefficient de partage. Les partitions de solutés entre deux solvants non miscibles. Lorsque nous faisons une immobile solvant (par adsorption sur une matrice de support solide) et un autre mobile, il en résulte dans les applications les plus courantes de Chromatographie. Si le support de matrice est polaire (par exemple du papier, de la silice, etc.), il est avant la chromatographie de phase, et si elle est polaire (C-18) non il est en phase inverse.
Techniques de forme de lit chromatographique
Une Chromatographie sur colonne
La Chromatographie sur colonne est une technique de séparation dans laquelle le lit est stationnaire à l'intérieur d'un tube. Les particules de la phase stationnaire solide ou le support revêtu avec une phase stationnaire liquide peut remplir tout le volume intérieur du tube (colonne garnie) ou être porté sur ou le long de la paroi du tube intérieur en laissant un chemin libre ouverte de la phase mobile dans la partie médiane du tube (colonne tubulaire ouverte). Les différences de taux de mouvement à travers le milieu sont calculées à différents temps de rétention de l'échantillon.
En 1978, WC Still a présenté une version modifiée de la chromatographie colonne appelée flash chromatographie sur colonne (flash). La technique est très similaire à la Chromatographie sur colonne classique, à l'exception de ce que le solvant est entraîné à travers la colonne en appliquant une pression positive. Cela a permis à la plupart des séparations à effectuer en moins de 20 minutes, avec des séparations améliorée par rapport à l'ancienne méthode. Les systèmes de Chromatographie flash modernes sont vendus comme des cartouches préemballées en plastique, et le solvant est pompé à travers la cartouche. Les systèmes peuvent également être liés avec des détecteurs et des collecteurs de fractions fournissant automatisation. L'introduction de pompes gradient conduit à des séparations plus rapides et une utilisation moins de solvant.
En adsorption en lit expansé, d'un lit fluidisé est utilisé, plutôt que d'une phase solide constituée par un lit tassé. Cela permet l'omission d'étapes initiales de défrichage telles que la centrifugation et la filtration, pour bouillons de culture ou des suspensions de cellules rompues.
La Chromatographie sur phosphocellulose utilise l'affinité de liaison de plusieurs protéines de liaison d'ADN de phosphocellulose. La plus forte de l'interaction de la protéine avec de l'ADN, plus la concentration en sel nécessaire pour éluer cette protéine.
Chromatographie Planar
Chromatographie planaire est une technique de séparation dans lequel la phase stationnaire est présent sous la forme ou dans un avion. L'avion peut être un papier, servant en tant que telle ou imprégné par une substance que le lit fixe ( Chromatographie sur papier) ou une couche de particules solides réparties sur un support tel qu'une plaque de verre ( chromatographie sur couche mince). Différents composés dans le mélange de l'échantillon se déplacent des distances différentes selon la façon dont ils interagissent fortement avec la phase stationnaire par rapport à la phase mobile. Le spécifique facteur de rétention (Rf) de chaque produit chimique peut être utilisé pour aider à l'identification d'une substance inconnue.
La chromatographie sur papier
La chromatographie sur papier est une technique qui consiste à placer un petit point ou une ligne de solution de l'échantillon sur une bande de papier de chromatographie. Le papier est placé dans un bocal contenant une couche peu profonde de solvant et scellé. Comme solvant se élève à travers le papier, il rencontre le mélange de l'échantillon, qui commence à se déplacer le papier avec le solvant. Ce papier est fait de cellulose, une substance polaire, et les composés entrant dans le mélange de Voyage plus loin se ils sont non-polaire. Plus substances polaires lien avec le papier de cellulose plus rapidement, et donc de ne pas voyager aussi loin.
Chromatographie en couche mince
Chromatographie sur couche mince (CCM) est une technique largement utilisée en laboratoire et est similaire à chromatographie sur papier. Cependant, au lieu d'utiliser une phase stationnaire de papier, il se agit d'une phase stationnaire d'une couche mince de adsorbant comme gel de silice, l'alumine , ou cellulose sur un plat, inerte substrat. Par rapport au papier, il a l'avantage de pistes plus rapides, de meilleures séparations, et le choix entre les différents adsorbants. Pour encore mieux résolution et pour permettre une quantification, haute performance TLC peut être utilisé.
Chromatographie Déplacement
Le principe de base de Chromatographie déplacement est la suivante: Une molécule avec une affinité élevée pour la matrice de chromatographie (le plongeur) participe efficacement à des sites de liaison, et ainsi de déplacer toutes les molécules ayant des affinités moindres. Il existe des différences distinctes entre le déplacement et la Chromatographie d'élution. En mode d'élution, substances apparaissent généralement à partir d'une colonne, pics gaussiennes étroites. Séparation large de pics, de préférence au niveau de référence, est souhaitée pour la purification maximale. La vitesse à laquelle l'un des composants d'un mélange se déplace vers le bas de la colonne en mode d'élution dépend de nombreux facteurs. Mais pour deux substances de voyager à des vitesses différentes, et de ce fait être résolus, il doit y avoir des différences substantielles dans une certaine interaction entre les biomolécules et la matrice de chromatographie. Les paramètres de fonctionnement sont ajustées pour maximiser l'effet de cette différence. Dans de nombreux cas, la séparation des pics de référence peut être obtenu seulement avec un gradient d'élution de la colonne et des charges faibles. Ainsi, deux inconvénients à la Chromatographie en mode d'élution, en particulier à l'échelle preparative, la complexité des opérations sont, en raison de pompage gradient de solvant, et un faible débit, du fait de charges de colonne basse. Chromatographie de déplacement a des avantages sur chromatographie d'élution dans que les composants sont résolus en zones consécutives de substances pures plutôt que de «pics». Étant donné que le procédé tire profit de la non-linéarité des isothermes, une plus grande colonne d'alimentation peut être séparée sur une colonne donnée aux composants purifiés récupérés à des concentrations nettement plus élevées.
Techniques de l'état physique de la phase mobile
Chromatographie en phase gazeuse
Chromatographie en phase gazeuse (GC), parfois aussi appelée Chromatographie gaz-liquide (GLC), est une technique de séparation dans lequel la phase mobile est un gaz. chromatographie en phase gazeuse est toujours effectuée dans une colonne, qui est généralement «emballé» ou «capillaire» (voir ci-dessous).
Chromatographie en phase gazeuse est basée sur un partition de l'analyte équilibre entre une phase stationnaire solide (souvent un matériau à base de silicone liquide) et un gaz portable (le plus souvent de l'hélium). La phase stationnaire est collée à l'intérieur d'un tube de verre de petit diamètre (une colonne capillaire) ou une matrice solide à l'intérieur d'un tube métallique plus grande (une colonne à garnissage). Il est largement utilisé en chimie analytique ; bien que les températures élevées utilisées dans GC rendent impropre pour des biopolymères à poids moléculaire élevé ou des protéines (les dénature chaleur), fréquemment rencontrées dans la biochimie , il est bien adapté pour une utilisation dans le la pétrochimie, surveillance de l'environnement et assainissement, et domaines de produits chimiques industriels. Il est aussi largement utilisé dans la recherche de la chimie.
Chromatographie liquide
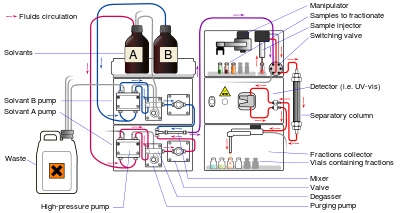
Chromatographie liquide (LC) est une technique de séparation dans lequel la phase mobile est un liquide. Chromatographie en phase liquide peut être effectuée soit dans une colonne ou un avion. Chromatographie liquide à jour actuelle qui utilise en général de très petites particules d'emballage et une pression relativement élevée est appelée Chromatographie en phase liquide à haute performance (HPLC).
En HPLC de l'échantillon est forcé par un liquide sous haute pression (la phase mobile) à travers une colonne qui est garnie d'une phase stationnaire constituée de particules de forme irrégulière ou sphérique, un couche monolithique poreux ou une membrane poreuse. HPLC est historiquement divisée en deux sous-classes différentes en fonction de la polarité des phases mobile et stationnaire. Modes dans lequel la phase stationnaire est plus polaire que la phase mobile (par exemple, le toluène comme phase mobile, de la silice comme phase stationnaire) sont appelés Chromatographie normale en phase liquide (NPLC) et le (par exemple, un mélange eau-méthanol opposé comme le mobile phase et C18 = octadécylsilylé comme phase stationnaire) est appelé inversés chromatographie liquide en phase (RPLC). Ironiquement, la "phase normale" a moins d'applications et RPLC est donc utilisé beaucoup plus.
Techniques spécifiques sous ce chapitre sont énumérés ci-dessous.
La Chromatographie d'affinité
La Chromatographie d'affinité est basée sur l'interaction non covalente sélective entre un analyte et des molécules spécifiques. Il est très spécifique, mais pas très robuste. Elle est souvent utilisée en biochimie dans la purification des protéines liés à des mots clés. Ces des protéines de fusion sont marquées avec des composés tels que Ses balises, biotine ou des antigènes, qui se lient à la phase stationnaire spécifique. Après purification, certaines de ces balises sont habituellement retirés et la protéine pur est obtenu.
La Chromatographie d'affinité utilise souvent l'affinité pour une biomolécule un métal (Zn, Cu, Fe, etc.). Les colonnes sont souvent préparés manuellement. Colonnes d'affinité traditionnels sont utilisés comme une étape préparatoire à débusquer biomolécules indésirables.
Cependant, les techniques HPLC existent qui ne utilisent propriétés d'affinité chromatogaphy. Métal chromatographie d'affinité immobilisée (IMAC) est utile pour séparer les molécules susmentionnées basée sur l'affinité relative pour le métal (Ie Dionex IMAC). Souvent, ces colonnes peuvent être chargés avec des métaux différents pour créer une colonne d'affinité avec une cible.
Chromatographie fluide supercritique
Chromatographie fluide supercritique est une technique de séparation dans lequel la phase mobile est un fluide au-dessus et relativement proche de sa température critique et la pression.
Techniques de mécanisme de séparation
Chromatographie d'échange d'ions
Chromatographie d'échange d'ions (généralement dénommé chromatographie ionique) utilise un mécanisme d'échange d'ions pour séparer les analytes en fonction de leurs charges respectives. Elle est généralement réalisée dans des colonnes mais peut aussi être utile en mode planaire. Chromatographie d'échange d'ions utilise une phase stationnaire chargée de séparer des composés chargés, y compris des anions , des cations , des acides aminés , peptides et protéines . Dans les procédés classiques de la phase stationnaire est un résine échangeuse d'ions qui transporte chargé des groupes fonctionnels qui interagissent avec les groupes de charge opposée du composé à conserver. Chromatographie d'échange d'ions est couramment utilisé pour purifier des protéines à l'aide FPLC.
Chromatographie par exclusion de taille
Chromatographie d'exclusion stérique (SEC) est également connu comme la Chromatographie par permeation de gel (GPC) ou par Chromatographie de filtration sur gel et sépare les molécules selon leur taille (ou plus exactement en fonction de leur diamètre hydrodynamique ou le volume hydrodynamique). Les petites molécules sont capables de pénétrer dans les pores des médias et, par conséquent, les molécules sont piégés et retirés de la circulation de la phase mobile. Le temps de séjour moyen dans les pores dépend de la taille efficace des molécules d'analyte. Cependant, les molécules de taille supérieure à la taille moyenne des pores du garnissage sont exclus et donc souffrent essentiellement pas de rétention; ces espèces sont les premiers à être élué. Il se agit généralement d'une technique chromatographique à basse résolution et par conséquent il est souvent réservée à la dernière étape, "polissage" d'une purification. Il est également utile pour la détermination du structure tertiaire et structure quaternaire des protéines purifiées, d'autant plus qu'il peut être réalisé sous natifs solution conditions.
Adsorption élargi de lit (EBA) Séparation chromatographique
Expanded Bed Adsorption (TSA) Séparation chromatographique capture d'une protéine cible à partir d'un courant d'alimentation brut quand il passe à travers un système de colonne de chromatographie contenant des billes d'adsorbant. Avec cette technique, la charge brute peut être traitée directement dans la colonne chromatographique, en évitant les étapes traditionnelles de clarification et de pré-traitement. EBA Séparation chromatographique est hautement évolutive, de diamètre de 1 cm colonnes à base de laboratoire à de grandes colonnes de production jusqu'à 2 mètres de diamètre. Ces colonnes peuvent généralement gérer stock d'alimentation débit de plus de 1.000.000 litres par jour d'une capacité de 1 000 protéines de tonnes par année de production.
Techniques spéciales
Chromatographie en phase inverse
Chromatographie en phase inverse est un procédé d'élution utilisé dans la Chromatographie liquide dans lequel la phase mobile est sensiblement plus polaire que la phase stationnaire.
Chromatographie bidimensionnelle
Dans certains cas, la composition chimique dans une colonne donnée peut être insuffisante pour séparer certains analytes. Il est possible de diriger une série de pics non résolus sur une deuxième colonne avec différentes propriétés physico-chimiques ( classification chimique) des propriétés. Étant donné que le mécanisme de maintien sur ce nouveau support solide est différente de la première séparation dimensionnelle, il peut être possible de séparer des composés qui sont indiscernables par chromatographie unidimensionnelle. L'échantillon est repéré dans un coin d'une plaque carrée, développé, séché à l'air, puis tourné de 90 ° et généralement aménagé dans un deuxième système de solvant.
Chromatographie à lit mobile simulé
Chromatographie en phase gazeuse pyrolyse
La pyrolyse chromatographie en phase gazeuse par spectrométrie de masse est une méthode d'analyse chimique dans lequel l'échantillon est chauffé jusqu'à décomposition pour produire des molécules plus petites qui sont séparés par chromatographie en phase gazeuse et par spectrométrie de masse détectées.
La pyrolyse est la décomposition thermique des matériaux dans une atmosphère inerte ou sous vide. L'échantillon est mis en contact direct avec un fil de platine, ou placé dans un tube d'échantillon de quartz et chauffé rapidement à 600-1000 ° C. Selon l'application, des températures encore plus élevées sont utilisées. Trois techniques de chauffage différents sont utilisés dans pyrolyzers réels: four isotherme, chauffage par induction (Point de Curie filament), et chauffage utilisant des filaments de platine résistifs. Les grosses molécules clivent à leurs points faibles et produisent des fragments plus petits, les plus volatiles. Ces fragments peuvent être séparés par chromatographie en phase gazeuse. Chromatogrammes GC pyrolyse sont généralement complexes car un large éventail de produits de décomposition est formé. Les données peuvent être utilisées soit comme empreinte digitale pour établir l'identité de la matière ou des données GC / MS est utilisée pour identifier des fragments individuels afin d'obtenir des informations structurales. Pour augmenter la volatilité des fragments polaires, divers réactifs de méthylation peuvent être ajoutés à un échantillon avant pyrolyse.
Outre l'utilisation de pyrolyzers dédiés, pyrolyse GC d'échantillons solides et liquides peut être effectuée directement à l'intérieur température programmable Vaporisateur (PTV) injecteurs qui fournissent chauffage rapide (jusqu'à 30 ° C / s) et des températures maximales élevées de 600-650 ° C. Cela est suffisant pour certaines applications de pyrolyse. Le principal avantage est qu'aucun instrument dédié doit être acheté et la pyrolyse peut être effectuée dans le cadre de l'analyse de GC routine. Dans ce GC quartz cas doublures d'entrée doivent être utilisées. Les données quantitatives peuvent être acquises, et de bons résultats de dérivation intérieur de l'injecteur PTV sont publiées ainsi.
Chromatographie liquide de protéine rapide
Chromatographie liquide rapide des protéines (FPLC) est un terme appliqué à plusieurs techniques de chromatographie qui sont utilisés pour purifier des protéines. Beaucoup de ces techniques sont identiques à celles menées sous la chromatographie liquide à haute performance, cependant utiliser des techniques FPLC sont généralement pour préparer de grands lots à l'échelle d'un produit purifié.
Chromatographie contrecourant

Chromatographie à contre-courant (CCC) est un type de Chromatographie en phase liquide-liquide, où les deux phases stationnaire et mobile sont des liquides. Le principe de fonctionnement de l'équipement de CCC nécessite une colonne constituée d'un tube ouvert enroulé autour d'une bobine. La bobine est entraînée en rotation dans un mouvement giratoire à double axe (a cardioïde), ce qui provoque un champ gravité variable (G) à agir sur la colonne au cours de chaque rotation. Ce mouvement provoque la colonne de voir une étape de séparation par tour et composants de l'échantillon séparé dans la colonne en raison de leur coefficient de partage entre les deux phases liquides non miscibles utilisés. Il existe de nombreux types de CCC disponibles aujourd'hui. Il se agit notamment HSCCC (CCC haute vitesse) et HPCCC (CCC haute performance). HPCCC est la version la plus récente et la plus performante de l'instrumentation disponible pour le moment.
Chromatographie chirale
Chromatographie chirale implique la séparation de stéréoisomères. Dans le cas des énantiomères, ceux-ci ne ont pas de différences chimiques ou physiques en plus d'être des images en miroir en trois dimensions. Chromatographie classique ou d'autres procédés de séparation sont incapables de les séparer. Pour activer séparations chirales avoir lieu, soit la phase mobile ou la phase stationnaire doivent être elles-mêmes chiral, donnant différentes affinités entre les analytes. Des colonnes chirales de CLHP Chromatographie (avec une phase stationnaire chirale) en phase normale et inverse les deux sont disponibles dans le commerce.

