Spectrométrie de masse
À propos de ce écoles sélection Wikipedia
SOS Enfants, un organisme de bienfaisance de l'éducation , a organisé cette sélection. Cliquez ici pour plus d'informations sur les enfants SOS.
La spectrométrie de masse (MS) est la science de l'affichage de la spectre (spectre singulier) de la masse des molécules comprenant un échantillon de matériau. Il est utilisé pour déterminer la composition élémentaire d'un échantillon, la masse des particules et des molécules et pour élucider les structures chimiques de molécules, telles que peptides et d'autres composés chimiques . Spectrométrie de masse par ionisation fonctionne composés chimiques pour générer des molécules chargées ou fragments de molécules et de mesurer leur masse-charge ratios. Dans un mode opératoire typique MS:
- Un échantillon (qui peut être solide, liquide ou gaz) est ionisé.
- Les ions sont séparés en fonction de leur rapport masse-charge. Ce est l'étape clé.
- Les ions sont détectés dynamiquement par un mécanisme capable de détecter des particules chargées énergétiques.
- Le signal est traité dans le spectre (spectre singulier) de la masse des particules de cet échantillon.
Les éléments ou de molécules sont identifiées par corrélation masses connues par les masses identifiées.
Un instrument de spectromètre de masse sera composé de quatre modules:
1. ioniseur convertit une partie de l'échantillon en ions. Il existe une grande variété de techniques pour ce, en fonction de la phase (solide, liquide, gaz) de l'échantillon, et l'efficacité des divers mécanismes d'ionisation de l'espèce cible en question. Les spectromètres de masse sont généralement nommés d'après la source d'ions utilisée. Certains exemples sont les suivants:
- Electron ionisation
- Glow spectrométrie de masse à décharge luminescente (GDMS)
- ICPMS
- Ionisation de résonance spectrométrie de masse (RIMS)
- SIMS
- TIMS
2. Un système d'extraction qui élimine les ions de l'échantillon et leur donne une trajectoire qui permet à l'analyseur de masse pour les transmettre.
3. Un analyseur de masse trie les ions en masse. Les méthodes utilisées incluent:
- Secteur magnétique
- Quadripolaire
- Temps de vol
4. Un détecteur qui mesure la valeur d'une grandeur d'indicateur et fournit des données pour le calcul de l'abondance de chaque ion présente ainsi. Certains détecteurs donnent également des informations spatiale, par exemple une plaque multicanal. La technique a à la fois qualitative et Utilisations quantitatives. Il se agit notamment d'identifier des composés inconnus, la détermination de la isotopique composition d'éléments dans une molécule, et la détermination de la la structure d'un composé en observant sa fragmentation. D'autres utilisations incluent quantifier la quantité d'un composé dans un échantillon ou d'étudier les fondements de la chimie des ions en phase gazeuse (la chimie des ions et des neutres dans le vide). MS est actuellement en usage très courant dans les laboratoires analytiques qui étudient les propriétés biologiques d'une grande variété de composés physiques, chimiques ou.
Étymologie
Le mot spectrographe était devenu une partie de la vocabulaire scientifique internationale en 1884. Le racines linguistiques sont une combinaison et l'élimination des morphèmes liés et morphèmes libres qui se rapportent aux modalités SPECTR ographie plaque -ic -um et phot-. Premiers appareils de spectrométrie qui ont mesuré le rapport de masse sur charge des ions ont été appelés spectrographes de masse qui consistaient en instruments qui ont enregistré une spectre des valeurs de masse sur un plaque photographique. Un spectroscope de masse est similaire à un spectrographe de masse, sauf que le faisceau d'ions est dirigé sur un écran luminescent. Une configuration de spectroscope de masse a été utilisée dans les premiers instruments quand on voulait que les effets des ajustements soient observés rapidement. Une fois que l'instrument a été correctement réglé, une plaque photographique a été inséré et exposé. Le spectroscope de masse terme a continué à être utilisé même si l'éclairage direct d'un écran de phosphore a été remplacé par des mesures indirectes avec un oscilloscope. L'utilisation de la spectrométrie de masse de terme est maintenant déconseillée en raison de la possibilité de confusion avec la lumière spectroscopie . La spectrométrie de masse est souvent abrégé en masse spec ou simplement comme MS.
Histoire

En 1886, Eugen Goldstein observée en rayons les rejets de gaz sous basse pression qui a voyagé loin de l'anode et à travers les canaux dans un perforée cathode, opposée à la direction de charge négative rayons cathodiques (qui se déplacent de la cathode vers l'anode). Goldstein a appelé ces chargé positivement rayons anodiques "Kanalstrahlen"; la traduction standard de cette expression en anglais est " rayons canaux ". Wilhelm Wien a constaté que les champs électriques ou magnétiques puissants déviés les rayons canaux et, en 1899, un dispositif construits avec des champs électriques et magnétiques parallèles qui séparaient les rayons positifs selon leur charge à la masse rapport (Q / m). Wien trouvé que le rapport charge-masse dépend de la nature du gaz dans le tube à décharge. Scientifique anglais JJ Thomson tard améliorée sur les travaux de Wien en réduisant la pression pour créer le spectrographe de masse.
La première application de la spectrométrie de masse pour l'analyse des acides aminés et des peptides a été rapportée en 1958. Carl-Ove Andersson a mis en évidence les principaux ions fragments observés dans l'ionisation des esters méthyliques.
Certaines des techniques modernes de spectrométrie de masse ont été conçus par Arthur Jeffrey Dempster et FW Aston en 1918 et 1919 respectivement. En 1989, la moitié du prix Nobel de physique a été décerné à Hans et Dehmelt Wolfgang Paul pour le développement de la technique de piège à ions dans les années 1950 et 1960. En 2002, le prix Nobel de chimie a été décerné à John Bennett Fenn pour le développement de ionisation par électropulvérisation (ESI) et Koichi Tanaka pour le développement de désorption laser douce (SLD) et leur application à l'ionisation des macromolécules biologiques, en particulier les protéines.
Exemple simplifié

L'exemple suivant décrit le fonctionnement d'un analyseur de masse du spectromètre, ce qui est de la Type de secteur. (Autres types d'analyseurs sont traités ci-dessous.) Considérons un échantillon de chlorure de sodium (sel de table). Dans la source d'ions, l'échantillon est vaporisé (transformé en gaz ) et ionisé (transformé en particules chargées électriquement) en sodium (Na +) et chlorure (Cl -) ions. des atomes de sodium et des ions sont monoisotopique, avec une masse d'environ 23 amu. atomes de chlore et les ions sont de deux isotopes de masses d'environ 35 amu (à une abondance naturelle d'environ 75 pour cent) et environ 37 amu (à une abondance naturelle d'environ 25 pour cent). La partie de l'analyseur du spectromètre contient électrique et champs magnétiques, qui exercent des forces sur les ions traversent ces domaines. La vitesse d'une particule chargée peut être augmentée ou diminuée en passant par le champ électrique, et la direction peut être modifiée par le champ magnétique. L'ampleur de la déviation de la trajectoire de l'ion déplacement dépend de son rapport masse-charge. Ions légers se déviés par la force magnétique plus des ions plus lourds (basées sur la deuxième loi du mouvement de Newton , F = ma). Les flux d'ions trié passent de l'analyseur vers le détecteur, qui enregistre l'abondance relative de chaque type d'ion. Cette information est utilisée pour déterminer la composition chimique de l'élément de l'échantillon initial (ce est à dire qu'à la fois le sodium et le chlore sont présents dans l'échantillon) et la composition isotopique de ses constituants (le rapport de 35 à 37 Cl Cl).
Création d'ions
La source d'ions est la partie du spectromètre de masse qui ionise le matériau à analyser (analyte). Les ions sont ensuite transportés par magnétiques ou des champs électriques à l'analyseur de masse.
Techniques pour ionisation ont été la clé de déterminer quels types d'échantillons peuvent être analysés par spectrométrie de masse. Electron ionisation et ionisation chimique sont utilisés pour les gaz et vapeurs. En sources d'ionisation chimiques, l'analyte est ionisé par des réactions chimiques ion-molécule au cours de collisions dans la source. Deux techniques souvent utilisés avec liquides et solides échantillons biologiques comprennent ionisation par électronébulisation (inventé par John Fenn) et laser assistée par matrice de désorption / ionisation (MALDI, initialement développée comme une technique similaire "Soft désorption laser (SLD)" par K. Tanaka pour lesquels un prix Nobel a été attribué et que MALDI par M. Karas et Hillenkamp F.).
Plasma à couplage inductif
Plasma à couplage inductif (ICP) sources sont principalement utilisés pour l'analyse de cations d'un large éventail de types d'échantillons. Dans ce type de Ion Source Technology, une «flamme» de plasma qui est électriquement neutre dans l'ensemble, mais qui a eu une fraction substantielle de ses atomes ionisés par haute température, est utilisé pour atomiser molécules de l'échantillon introduites et de dépouiller davantage les électrons externes de ces atomes. Le plasma est généralement produite à partir de gaz d'argon, étant donné que la première énergie d'ionisation des atomes d'argon est supérieure à la première des autres éléments sauf He, O, F et Ne, mais inférieure à la seconde énergie d'ionisation de tous sauf les métaux plus électropositifs. Le chauffage est réalisé par un courant à haute fréquence passé à travers une bobine entourant le plasma.
D'autres techniques d'ionisation
D'autres incluent décharge luminescente, désorption de champ (FD), bombardement atomique rapide (FAB), thermospray, la désorption / ionisation sur silicium (DIOS), Analyse directe en temps réel (DART), ionisation chimique à pression atmosphérique (APCI), ions secondaires spectrométrie de masse (SIMS), allumage et ionisation ionisation thermique (TIMS). Ion fixation ionisation est une technique d'ionisation qui permet une analyse libres de fragmentation.
La sélection de masse
Analyseurs de masse séparer les ions en fonction de leur rapport masse-charge. Les deux lois suivantes régissent la dynamique des particules chargées dans des champs électriques et magnétiques dans le vide:
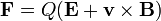 ( Lorentz de loi de force);
( Lorentz de loi de force);
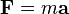 ( deuxième loi de Newton du mouvement en cas de non-relativiste, ce est à dire valable uniquement à une vitesse bien inférieure à la vitesse de la lumière d'ions).
( deuxième loi de Newton du mouvement en cas de non-relativiste, ce est à dire valable uniquement à une vitesse bien inférieure à la vitesse de la lumière d'ions).
Ici, F est la force appliquée à l'ion, m est la masse de l'ion, a est l'accélération, Q est la charge ionique, E est le champ électrique, et v × B est le produit vecteur transversale de la vitesse des ions et la champ magnétique
Assimiler les expressions ci-dessus pour la force appliquée sur les rendements d'ions:
Cette équation différentielle est l'équation classique de motion particules chargées. Avec les conditions initiales de la particule, il détermine complètement le mouvement de la particule dans l'espace et le temps en termes de m / Q. Ainsi spectromètres de masse pourraient être considérés comme des "masse-charge spectromètres". Lors de la présentation des données, il est courant d'utiliser le (officiellement) sans dimension m / z, où z est le nombre de charges élémentaires (e) sur l'ion (z = Q / e). Cette quantité, même si elle est officieusement appelé le rapport de masse sur charge, parlant plus de précision représente le rapport entre le nombre de masse et le nombre de charge, z.
Il existe de nombreux types d'analyseurs de masse, en utilisant soit des champs statiques ou dynamiques, et les champs magnétiques ou électriques, mais tous fonctionnent selon l'équation différentielle ci-dessus. Chaque type d'analyseur a ses forces et faiblesses. Beaucoup de spectromètres de masse utilisent deux ou plusieurs analyseurs de masse pour spectrométrie de masse tandem (MS / MS). En plus des analyseurs de masse les plus courants énumérés ci-dessous, il ya d'autres conçues pour des situations particulières.
Il existe plusieurs caractéristiques importantes de l'analyseur. Le pouvoir de résolution de masse est la mesure de la capacité de distinguer deux pics de légèrement différent m / z. La précision de masse est le rapport entre l'erreur de mesure m / z pour la vraie m / z. Précision de la masse est généralement mesurée en ppm ou milli unités de masse. La gamme de masse est la gamme de m / z prêtant à une analyse par un analyseur donné. Le domaine de linéarité est la plage sur laquelle le signal d'ions est linéaire avec la concentration de l'analyte. Vitesse se réfère à la période de l'expérience et en fin de compte est utilisé pour déterminer le nombre de spectres par unité de temps qui peut être générée.
instruments sectoriels
Un champ de secteur analyseur de masse utilise un champ électrique et / ou magnétique pour influer sur le trajet et / ou la vitesse des accusés de particules d'une certaine façon. Comme indiqué ci-dessus, instruments du secteur plier les trajectoires des ions lors de leur passage à travers l'analyseur de masse, selon leurs rapports masse-charge, dévier les ions plus chargée et se déplaçant plus rapidement, plus légers plus. L'analyseur peut être utilisé pour sélectionner une gamme étroite de m / z ou de parcourir une gamme de m / z au catalogue les ions présents.
Temps de vol
Le à temps de vol (TOF) analyseur utilise un champ électrique pour accélérer les ions à travers le même potentiel, puis mesure le temps qu'ils prennent pour atteindre le détecteur. Si les particules ont tous la même accusation , les énergies cinétiques seront identiques, et leurs vitesses dépendra uniquement sur leurs masses . Ions légers atteindront d'abord le détecteur.
Filtre de masse quadripolaire
Analyseurs de masse quadripolaires utilisent des champs électriques oscillants pour stabiliser ou déstabiliser de manière sélective les trajets d'ions passant à travers une fréquence radio (RF) champ quadripolaire créé entre quatre tiges parallèles. Seuls les ions dans une plage de rapport masse / charge sont passés à travers le système à tout moment, mais les modifications apportées aux potentiels sur les tiges permettent une large gamme de valeurs m / z pour balayer rapidement, en continu ou en une succession de houblon discrets. Analyseur de masse quadrupolaire agit comme un filtre sélectif en masse et est étroitement liée à la quadripolaire piège à ions, en particulier le piège à ions quadripolaire linéaire sauf qu'il est conçu pour laisser passer les ions non piégés plutôt que recueillir ceux qui sont pris au piège, et est pour cette raison appelé un quadripôle de transmission. Une variation commune du quadripôle de transmission est le spectromètre de masse triple quadripôle. Le "triple quad" comporte trois étapes consécutives, quadripolaires le premier agissant comme un filtre de masse pour transmettre un ion entrant particulière à la seconde quadripolaire, une chambre de collision, dans lequel l'ion qui peut être divisé en fragments. Le troisième quadripole agit également comme un filtre de masse, pour transmettre un ion de fragment particulier au détecteur. Si un quadripôle est fait pour faire défiler rapidement et de façon répétitive à travers une gamme de réglages de filtre de masse, spectres complet peut être rapporté. De même, un triple quad peut être fait pour effectuer diverses types de scan caractéristique de spectrométrie de masse tandem.
Les pièges à ions
Tridimensionnelle piège à ions quadripolaire
Le piège à ions quadripolaire fonctionne sur les mêmes principes physiques que l'analyseur de masse quadripolaire, mais les ions sont piégés et séquentiellement éjecté. Les ions sont piégés dans un champ de quadrupôle RF principalement, dans un espace défini par une électrode annulaire (habituellement reliée au potentiel RF principal) entre deux électrodes d'extrémités (typiquement connecté à courant continu ou à courant alternatif potentiels auxiliaires). L'échantillon est ionisé soit en interne (par exemple avec un électron ou faisceau laser), ou à l'extérieur, dans ce cas, les ions sont souvent introduits à travers une ouverture dans une électrode d'embout.
Il existe de nombreux / CHARGE séparation et d'isolement méthodes de masse mais le plus couramment utilisé est le mode d'instabilité masse dans laquelle le potentiel de RF est une rampe de sorte que l'orbite des ions d'une masse a> b sont stables tandis que les ions dont la masse b deviennent instables et sont éjecté sur l'axe z sur un détecteur. Il existe également des méthodes d'analyse non destructive.
Les ions peuvent aussi être éjectés par le procédé d'excitation de résonance, grâce à quoi une tension d'excitation oscillatoire supplémentaire est appliquée aux électrodes d'extrémités, et l'amplitude de tension de piégeage et / ou la fréquence de la tension d'excitation est modifiée pour amener des ions dans une condition de résonance en fonction de leur rapport masse / charger rapport.
Le cylindrique spectromètre de masse à piège à ions est un dérivé de la ions quadripolaire spectromètre de masse à piège.
Linear piège à ions quadripolaire
Un linéaire piège à ions quadripolaire est similaire à un piège à ions quadripolaire, mais il piège des ions dans un champ quadripolaire à deux dimensions, au lieu d'un champ quadripolaire tridimensionnel dans un piège à ions quadripolaire 3D. LTQ de Thermo Fisher («linéaire piège de quadripôle») est un exemple de piège à ions linéaire.
Un piège à ions toroïdale peut être visualisé comme un quadripôle linéaire courbé autour et relié à l'extrémité ou dans une section transversale d'un piège à ions 3D en rotation sur le bord pour former le tore, en forme de beignet piège. Le piège peut stocker de grandes quantités d'ions en les distribuant dans toute la structure de piège en forme d'anneau. Ce piège en forme toroïdale est une configuration qui permet la miniaturisation accrue d'un analyseur de masse à piège à ions. En outre tous les ions sont stockés dans le même champ de piégeage et en simplifiant ainsi éjectées détection qui peut être compliquée avec des configurations de réseau due à des variations dans l'alignement du détecteur et l'usinage des matrices.
Orbitrap
Ils sont semblables à Transformée de Fourier résonance cyclotron d'ions spectromètres de masse (voir texte ci-dessous). Les ions sont électrostatiquement piégé dans une orbite autour d'un, en forme de broche électrode centrale. L'électrode confine les ions de telle sorte qu'ils orbite autour de l'électrode centrale et osciller d'avant en arrière long du grand axe de l'électrode centrale. Cette oscillation produit un courant d'image dans les plaques de détection qui est enregistrée par l'instrument. Les fréquences de ces courants de l'image dépendent du rapports masse sur charge des ions. Les spectres de masse sont obtenus par transformation de Fourier des courants d'image enregistrées.
Orbitraps ont une précision de masse élevée, une haute sensibilité et une bonne gamme dynamique.
Transformée de Fourier résonance cyclotron d'ions
Transformée de Fourier spectrométrie de masse (FTMS), ou plus précisément Transformée de Fourier MS de résonance de cyclotron d'ions, mesure de masse en détectant la actuelle de l'image produite par des ions cyclotroning en présence d'un champ magnétique. Au lieu de mesurer la déviation d'ions d'un détecteur tel qu'un Multiplicateur d'électrons, les ions sont injectés dans une Penning piège (une électricité statique magnétique / piège à ions) où ils forment effectivement partie d'un circuit. Détecteurs à des positions fixes dans l'espace mesurer le signal électrique d'ions qui passent près d'eux au fil du temps, la production d'un signal périodique. Depuis la fréquence du cyclisme un ion est déterminée par sa masse à la charge, cela peut être l'exécution d'une déconvolution par Transformée de Fourier sur le signal. FTMS a l'avantage de haute sensibilité (depuis chaque ion est "compté" plus d'une fois) et beaucoup plus la résolution et donc la précision.
Résonance cyclotronique ionique (ICR) est une technique d'analyse de masse âgé FTMS similaire à l'exception que les ions sont détectés avec un détecteur classique. Ions piégés dans un Penning piège sont excités par un champ électrique RF jusqu'à ce qu'ils influent sur la paroi du piège, où le détecteur est situé. Ions de masses différentes sont résolus en fonction du temps d'impact.
Détecteurs

L'élément final du spectromètre de masse est le détecteur. Les dossiers de détection soit la charge induite ou le courant produit quand un ion passe ou frappe une surface. Dans un instrument de balayage, le signal produit dans le détecteur au cours du balayage par rapport à laquelle l'instrument est dans le balayage (quelle m / Q) va produire un spectre de masse, un record d'ions en fonction de m / Q.
Typiquement, un certain type de multiplicateur électrons est utilisé, bien que d'autres détecteurs, y compris Faraday et les détecteurs d'ions à photons sont également utilisés. Parce que le nombre d'ions laissant l'analyseur de masse à un instant particulier est généralement assez petite, l'amplification considérable est souvent nécessaire pour obtenir un signal. des détecteurs de galette de microcanaux sont couramment utilisés dans les instruments commerciaux modernes. En FTMS et Orbitraps, le détecteur se compose d'une paire de surfaces métalliques à l'intérieur de la région de masse à piège analyseur / ion de laquelle les ions ne passent près comme ils oscillent. Aucun courant continu est produit, seul un courant de l'image à courant alternatif faible est produite dans un circuit entre les électrodes. D'autres détecteurs inductifs ont également été utilisés.
Spectrométrie de masse tandem
Un spectromètre de masse en tandem est capable de multiples cycles de spectrométrie de masse, généralement séparées par une certaine forme de fragmentation molécule. Par exemple, un analyseur de masse peut isoler une peptide à partir de la saisie d'un grand nombre spectromètre de masse. Un deuxième analyseur de masse se stabilise ensuite les ions peptidiques tandis qu'ils entrent en collision avec un gaz, en les faisant fragment par dissociation induite par collision (CID). Un troisième analyseur de masse trie ensuite les fragments produits à partir des peptides. Tandem MS peut également être effectuée dans un seul analyseur de masse au cours du temps, comme dans un piège à ions quadripolaire. Il existe différentes méthodes pour fragmenter molécules pour tandem MS, y compris dissociation induite par collision (CID), capture d'électrons dissociation (DPE), transfert d'électrons dissociation (ETD), dissociation multiphotonique infrarouge (IRMPD), noir dissociation radiatif infrarouge (BIRD), électrons détachement dissociation (EDD) et dissociation induite par surface (SID). Une application importante en utilisant spectrométrie de masse tandem est dans l'identification des protéines .
Spectrométrie de masse tandem permet une variété de séquences expérimentales. Beaucoup de spectromètres de masse commerciaux sont conçus pour accélérer l'exécution de ces séquences de routine que surveillance de réaction sélectionnée (MRS) et balayage d'ions précurseurs. Pour SRM, le premier analyseur ne permet qu'une seule masse à travers et les secondes de l'analyseur pour moniteurs multiples ions fragments définis par l'utilisateur. SRM est le plus souvent utilisé avec des instruments d'analyse où le deuxième événement d'analyse de masse est cycle de service limitée. Ces expériences sont utilisés pour augmenter la spécificité de la détection de molécules connues, notamment dans les études pharmacocinétiques. Balayage d'ions précurseur se réfère à la surveillance d'une perte spécifique l'ion précurseur. Les premier et deuxième analyseurs de masse balaient l'ensemble du spectre comme partitionnée par une valeur m / z défini par l'utilisateur. Cette expérience est utilisée pour détecter des motifs spécifiques au sein des molécules inconnues.
Un autre type de spectrométrie de masse tandem utilisé pour datation au radiocarbone est Accélérateur de spectrométrie de masse (AMS), qui utilise des tensions très élevées, habituellement dans la gamme méga volts, afin d'accélérer les ions négatifs dans un type de spectromètre de masse en tandem.
Configurations de spectrométrie de masse communs et techniques
Quand une configuration spécifique de la source, un analyseur et détecteur devient classique dans la pratique, souvent un composé acronyme se pose pour le désigner, et l'acronyme composé peut-être mieux connu parmi nonspectrometrists que les acronymes composants. La quintessence de ce est MALDI-TOF, qui se réfère simplement à la combinaison d'un la source laser désorption / ionisation assistée par matrice avec un analyseur à temps de vol de masse. Le surnom MALDI-TOF est plus largement reconnu par les spectrometrists non-masse MALDI ou que TOF individuellement. D'autres exemples comprennent couplage inductif spectrométrie de masse à plasma (ICP-MS), spectrométrie de masse par accélérateur (SMA), spectrométrie de masse thermique-ionisation (TIMS) et source d'étincelle spectrométrie de masse (SSMS). Parfois, l'utilisation du générique "MS" connote en fait un très spécifique analyseur de masse et le système de détection, comme ce est le cas avec AMS, qui est toujours en fonction du secteur.
Certaines applications de la spectrométrie de masse ont développé surnoms que bien que strictement parlant semble se référer à une large application, dans la pratique, sont venus à la place pour désigner un particulier ou un nombre limité de configurations de l'appareil. Un exemple de ceci est isotope par spectrométrie rapport de masse (IRMS), qui fait référence dans la pratique de l'utilisation d'un nombre limité de secteur sur la base des analyseurs de masse; ce nom est utilisé pour désigner à la fois la demande et l'appareil utilisé pour l'application.
Les techniques chromatographiques couplée à la spectrométrie de masse
Une amélioration importante à la masse et la masse résoudre déterminer les capacités de spectrométrie de masse est de l'utiliser en tandem avec chromatographiques techniques de séparation.
Chromatographie en phase gazeuse

Une combinaison commune est le gaz chromatographie-spectrométrie de masse (GC / MS ou GC-MS). Dans cette technique, un chromatographe en phase gazeuse est utilisé pour séparer les différents composés. Ce flux de composés séparés est alimenté en ligne dans l' ion source, une métallique filament pour lequel une tension est appliquée. Ce filament émet des électrons qui ionisent les composés. Les ions peuvent alors autre fragment, produisant des modèles prévisibles. Ions intacts et des fragments passent dans la analyseur du spectromètre de masse et sont finalement détectées.
Chromatographie liquide
Similaire à chromatographie en phase gazeuse MS (GC / MS), la chromatographie liquide spectrométrie de masse (LC / MS ou LC-MS) sépare composés par chromatographie avant qu'ils ne soient introduits à la source d'ions et spectromètre de masse. Elle diffère de GC / MS en ce que la phase mobile est liquide, habituellement un mélange de l'eau et organiques solvants , au lieu de gaz et les fragments des ions ne peut pas donner des modèles prévisibles. Le plus souvent, un source d'ionisation par électropulvérisation est utilisée en LC / MS. Il ya aussi quelques techniques d'ionisation nouvellement développés comme pulvérisation laser.
La mobilité Ion
Spectrométrie de mobilité ionique / spectrométrie de masse (IMS / MS ou IMMS) est une technique où les ions sont d'abord séparés par le temps de dérive grâce à un peu de gaz neutre sous un gradient de potentiel électrique appliquée avant d'être introduit dans un spectromètre de masse. La dérive du temps est une mesure du rayon par rapport à la charge de l'ion. Le cycle de service d'IMS (le temps pendant lequel l'expérience a lieu) est plus longue que la plupart des techniques de spectrométrie de masse, tels que le spectromètre de masse peut déguster le long du parcours de la séparation IMS. Ce produit des données sur la séparation IMS et le rapport masse sur charge des ions d'une manière similaire à LC / MS.
Le cycle de service d'IMS est courte par rapport à la Chromatographie ou la Chromatographie en phase gazeuse des séparations de liquide et peut donc être couplé à de telles techniques, produisant triples modalités telles que LC / IMS / MS.
Et analyse des données

représentations de données
Spectrométrie de masse produit différents types de données. La représentation de données la plus commune est la spectre de masse.
Certains types de données de spectrométrie de masse sont le mieux représentées en tant que chromatogramme de masse. Types de chromatogrammes sélectionnés comprennent la surveillance d'ions (SIM), le courant ionique total (TIC), et la réaction de surveillance chromatogramme (SRM) sélectionnés, parmi beaucoup d'autres.
D'autres types de données de spectrométrie de masse sont bien représentés comme une tridimensionnel carte contour. Sous cette forme, la masse-charge, m / z est sur le axe x, l'intensité axe des y, et un paramètre supplémentaire expérimentale, comme le temps, est enregistrée sur l'axe z.
L'analyse des données
Notions de base
Masse analyse des données de spectrométrie est un sujet complexe qui est très spécifique pour le type d'essai produisant des données. Il ya subdivisions générales de données qui sont essentielles à la compréhension des données.
Beaucoup de spectromètres de masse fonctionnent en mode d'ions négatifs ou en mode ion positif. Il est très important de savoir si les ions observés sont chargé négativement ou positivement. Ce est souvent important dans la détermination de la masse neutre, mais il indique également quelque chose à propos de la nature des molécules.
Différents types de source d'ions entraînent différents tableaux de fragments produits à partir des molécules d'origine. Une source d'ionisation d'électrons produit de nombreux (1-) radicaux seule charge (nombre impair d'électrons) et la plupart des fragments, alors une source électrospray produit habituellement ions quasimolecular non radicaux qui sont fréquemment à charges multiples. Spectrométrie de masse tandem produit volontairement ions fragments post-source et peut changer radicalement le type de données obtenus par une expérience.
Par la compréhension de l'origine d'un échantillon, certaines attentes peuvent être considérées comme les molécules constitutives de l'échantillon et leurs fragmentations. Un échantillon provenant d'un processus / de fabrication de synthèse sera probablement contenir des impuretés chimiquement liés au composant cible. Un échantillon biologique relativement grossièrement préparé contiendra probablement une certaine quantité de sel, qui peut former produits d'addition avec les molécules d'analyte dans certaines analyses.
Les résultats peuvent également dépendra fortement de la façon dont l'échantillon a été préparé et comment il a été exécuté / introduit. Un exemple important est la question de la matrice qui est utilisé pour MALDI spotting, puisqu'une grande partie de l'énergétique de l'événement désorption / ionisation est contrôlée par la matrice plutôt que la puissance du laser. Parfois échantillons sont dopés avec du sodium ou un autre ion porteurs espèces pour produire les produits d'addition plutôt qu'une espèce protonés.
La plus grande source d'ennuis quand spectrometrists non-masse essaient de mener spectrométrie de masse sur leurs propres ou collaborer avec un en spectrométrie de masse est insuffisante définition de l'objectif de la recherche de l'expérience. Définition adéquate de l'objectif expérimental est une condition préalable pour la collecte des données appropriées et avec succès l'interpréter. Parmi les décisions qui peuvent être atteints avec la spectrométrie de masse sont la masse moléculaire, la structure moléculaire, et la pureté échantillon. Chacune de ces questions nécessite une procédure expérimentale différente. Il suffit de demander un "spectre de masse" sera très probablement pas répondre à la vraie question à portée de main.
Interprétation des spectres de masse
Depuis le précise la structure ou séquence peptidique d'une molécule est déchiffré à travers l'ensemble des masses de fragments, l'interprétation de spectres de masse nécessite l'utilisation combinée de différentes techniques. Habituellement, la première stratégie pour identifier un composé inconnu est de comparer son spectre de masse expérimental contre une bibliothèque de spectres de masse. Si la recherche est en place vide, alors l'interprétation manuelle ou logiciel interprétation assistée de spectres de masse sont effectuées. La simulation par ordinateur de ionisation et processus de fragmentation survenant dans le spectromètre de masse est le principal outil pour affecter la structure ou la séquence peptidique à une molécule. Une une information structurelle priori est fragmenté in silico et le motif résultant est comparé au spectre observé. Cette simulation est souvent soutenue par une bibliothèque de fragmentation qui contient des motifs publiés de réactions de décomposition. Logiciel profiter de cette idée a été développée pour les petites molécules et protéines.
Une autre façon d'interpréter les spectres de masse implique spectres masse précise. Une valeur Rapport masse sur charge (m / z) avec seulement une précision entier peut représenter un nombre immense de structures d'ions théoriquement possibles. Chiffres de masse plus précises de réduire considérablement le nombre de candidats formules moléculaires , mais chacun peut encore représenter un grand nombre de composés structurellement divers. Un algorithme informatique appelé générateur de formule calcule toutes les formules moléculaires qui correspondent à une donnée théoriquement masse avec la tolérance spécifiée.
Une technique récente pour élucidation de la structure en spectrométrie de masse, appelé empreintes digitales précurseur d'ions identifie morceaux individuels de l'information structurelle en effectuant une recherche de la spectres tandem de la molécule à l'étude avec une bibliothèque de la Les spectres d'ions produit des ions précurseurs structurellement caractérisés.
Applications
rapport isotopique MS: la datation isotopique et le suivi

La spectrométrie de masse est également utilisé pour déterminer la isotopique composition d'éléments au sein d'un échantillon. Différences de masse entre les isotopes d'un élément sont très petites, et les isotopes moins abondantes d'un élément sont généralement très rares, donc un instrument très sensible est nécessaire. Ces instruments, parfois appelés spectromètres rapport isotopique de masse (IR-MS), utilisent généralement un seul aimant à plier un faisceau de particules ionisées vers une série de cages de Faraday qui convertissent les impacts de particules à courant électrique. une analyse rapide en ligne de contenu en deutérium de l'eau peut être fait en utilisant la spectrométrie de masse rémanence Circuler, FA-MS. Probablement spectromètre de masse le plus sensible et précis à cet effet est le spectromètre de masse par accélérateur (SMA). les rapports isotopiques sont des marqueurs importants d'une variété de procédés. Certains rapports isotopiques sont utilisées pour déterminer l'âge des matériaux par exemple comme dans datation au carbone. l'étiquetage avec des isotopes stables est également utilisé pour la quantification des protéines. (Voir la caractérisation des protéines ci-dessous)
l'analyse des gaz de trace
Plusieurs techniques utilisent des ions créés dans une source d'ions dédié injecté dans un tube d'écoulement ou un tube de dérive:tube d'écoulement d'ions sélectionnés (SIFT-MS), etla réaction de transfert de proton (PTR-MS), sont des variantes del'ionisation chimique dédiés pour l'analyse de traces de gaz de l'air, souffle ou espace de tête liquide en utilisant un temps de réaction bien défini permettant les calculs de concentrations d'analyte à partir de la cinétique de réaction connues, sans la nécessité de l'étalon interne ou d'étalonnage.
sonde Atom
Une sonde atomique est un instrument qui combinespectrométrie de temps de vol de masse etmicroscopie ionique de champ (FIM) à cartographier l'emplacement des atomes individuels.
Pharmacocinétique
Pharmacocinétique est souvent étudiée en utilisant la spectrométrie de masse à cause de la nature complexe de la matrice (souvent du sang ou de l'urine) et la nécessité d'une haute sensibilité pour observer faible dose et des données de point de longues périodes. L'instrumentation la plus couramment utilisée dans cette application est LC-MS avec un spectromètre de masse triple quadripôle. Spectrométrie de masse tandem est habituellement utilisé pour la spécificité ajouté. Les courbes d'étalonnage et des étalons internes sont utilisés pour la quantification d'un seul pharmaceutique habituellement dans les échantillons. Les échantillons représentent différents points de temps comme produit pharmaceutique est administrée et ensuite métabolisé ou éliminé de l'organisme. Blancs ou t = 0 échantillons prélevés avant l'administration sont importantes dans la détermination de fond et d'assurer l'intégrité des données avec ces matrices complexes. Une grande attention est accordée à la linéarité de la courbe standard; Cependant il est courant d'utiliser raccord avec des fonctions plus complexes telles que quadratiques courbe depuis la réponse de la plupart des spectromètres de masse est inférieure linéaire sur de grandes gammes de concentration.
Il ne existe actuellement un intérêt considérable pour l'utilisation de très haute sensibilité de spectrométrie de masse études de microdosage, qui sont considérées comme une alternative prometteuse à l'expérimentation animale.
La caractérisation des protéines
La spectrométrie de masse est une nouvelle méthode importante pour la caractérisation et le séquençage de protéines. Les deux méthodes principales pour l'ionisation des protéines entières sont ionisation par électropulvérisation (ESI) et laser assistée par matrice de désorption / ionisation (MALDI). Conformément à la performance et de la masse gamme de spectromètres de masse disponibles, deux approches sont utilisées pour caractériser les protéines. Dans la première, les protéines intactes sont ionisées par l'une des deux techniques décrites ci-dessus, puis introduit dans un analyseur de masse. Cette approche est appelée " top-down "stratégie de l'analyse des protéines. Dans la seconde, les protéines sont digestion enzymatique en plus petits peptides à l'aide des proteases telles que trypsine ou la pepsine, soit en solution ou en gel après séparation électrophorétique. D'autres agents protéolytiques sont également utilisés. La collection de produits peptidiques sont ensuite introduit dans l'analyseur de masse. Lorsque le motif caractéristique de peptides est utilisée pour l'identification de la protéine de la méthode est appelée masse peptidique empreintes digitales (PMF), si l'identification est effectuée en utilisant les données de la séquence déterminée dans l'analyse MS en tandem, il est appelé séquençage de novo. Ces procédures d'analyse des protéines sont aussi appelés le « bottom-up ».
Analyse Glycan
La spectrométrie de masse (MS), avec son exigence d'échantillon faible et une sensibilité élevée, a été principalement utilisé dans glycobiology pour la caractérisation et l'élucidation des structures glycanniques. La spectrométrie de masse fournit un procédé complémentaire à une HPLC pour l'analyse des glycanes. Glycanes intactes peuvent être détectés ions directement comme charge unique par assistée par matrice de désorption / ionisation laser spectrométrie de masse (MALDI-MS) ou, après perméthylation ou peracétylation, par bombardement atomique rapide spectrométrie de masse (FAB-MS). Electrospray spectrométrie de masse à ionisation (ESI -MS) donne aussi de bons signaux pour les petites glycanes. Divers logiciel libre et commercial sont maintenant disponibles qui interprètent des données MS et de l'aide dans la structure Glycan caractérisation.
L'exploration spatiale
Comme une méthode standard pour l'analyse, spectromètres de masse ont atteint d'autres planètes et lunes. Deux ont été prises pour Mars par le programme Viking. Au début de 2005, la mission Cassini-Huygens a prononcé un spécialisé instrument GC-MS à bord de la sonde Huygens dans l'atmosphère de Titan, la plus grande lune de la planète Saturne . Cet instrument a analysé des échantillons atmosphériques le long de sa trajectoire de descente et était capable de vaporiser et analyser des échantillons de surface gelée, recouverte d'hydrocarbures de Titan, une fois la sonde avait atterri. Ces mesures comparer l'abondance de l'isotope (s) de chaque particule relativement à l'abondance naturelle de la terre. Également à bord de la sonde Cassini-Huygens est un ion et neutre spectromètre de masse qui a été pris des mesures de la composition atmosphérique de Titan ainsi que la composition de les panaches d'Encelade. Un thermique et Analyseur de gaz Evolved spectromètre de masse a été réalisée par le Phoenix Mars Lander lancé en 2007.
Spectromètres de masse sont aussi largement utilisés dans les missions spatiales pour mesurer la composition des plasmas. Par exemple, la sonde Cassini porte le Spectromètre Plasma Cassini (CAPS), qui mesure la masse des ions dans Saturne magnétosphère.
Moniteur de gaz respiré
Spectromètres de masse ont été utilisés dans les hôpitaux pour l'analyse des gaz respiratoires commençant dans les années 1975 jusqu'à la fin du siècle. Certains sont probablement encore en usage mais aucun sont actuellement en cours de fabrication.
Trouvé principalement dans la salle d'opération, ils faisaient partie d'un système complexe, dans lequel les échantillons de gaz respirés de patients subissant une anesthésie ont été entraînés dans l'instrument à travers un mécanisme de soupape conçu pour connecter séquentiellement jusqu'à 32 chambres au spectromètre de masse. Un ordinateur a dirigé toutes les opérations du système. Les données recueillies par le spectromètre de masse a été livré aux chambres individuelles pour l'anesthésiste à utiliser.
L'originalité de ce spectromètre de masse à secteur magnétique peut avoir été le fait qu'un plan de détecteurs, chacun positionné délibérément de recueillir toutes les espèces d'ions qui devraient être dans les échantillons, a permis à l'instrument de rendre compte simultanément tous les gaz respirés par le patient . Bien que la gamme de masse a été limitée à un peu plus de 120 u, la fragmentation d'une partie des molécules plus lourdes nié la nécessité d'une limite de détection plus élevé.