cinétique d'enzymes
Renseignements généraux
SOS Enfants, qui se déroule près de 200 sos écoles dans le monde en développement, a organisé cette sélection. parrainage SOS enfant est cool!

Cinétique enzymatique est l'étude des réactions chimiques qui sont catalysées par enzymes, avec un accent sur leurs taux de réaction . L'étude d'une enzyme de cinétique révèle le mécanisme catalytique de cette enzyme, son rôle dans le métabolisme, la façon dont l'activité est contrôlée, et la façon dont un médicament ou un poison puissance inhiber l'enzyme.
Les enzymes sont habituellement protéines molécules qui manipulent d'autres molécules - les enzymes ' substrats. Ces molécules cibles se lient à une enzyme de site actif et sont transformés en produits à travers une série d'étapes connu sous le nom mécanisme enzymatique. Ces mécanismes peuvent être divisés en mécanismes à substrat unique et multiple-substrat. Des études cinétiques sur les enzymes qui se lient à un seul substrat, tels que triosephosphate, visent à mesurer le affinité avec laquelle l'enzyme se lie ce substrat et le taux de chiffre d'affaires.
Lorsque plusieurs enzymes se lient substrats, tels que la dihydrofolate reductase (à droite), la cinétique enzymatique peut également représenter l'ordre dans lequel ces substrats se lient et la séquence dans laquelle les produits sont libérés. Un exemple d'enzymes qui lient un seul substrat et libèrent plusieurs produits sont les proteases, qui clivent une protéine substrat en deux produits polypeptidiques. D'autres se joignent ensemble deux substrats, tels que Une ADN-polymérase de liaison nucléotide à l'ADN . Bien que ces mécanismes sont souvent une série complexe d'étapes, il existe généralement une étape de détermination de vitesse qui détermine la cinétique globale. Cette étape de détermination de vitesse peut être une réaction chimique ou une changement de conformation de l'enzyme ou des substrats, tels que ceux impliqués dans la libération de produit (s) à partir de l'enzyme.
La connaissance de la la structure de l'enzyme est utile dans l'interprétation des données cinétiques. Par exemple, la structure peut indiquer comment les substrats et les produits se lient au cours de la catalyse; quels changements se produire au cours de la réaction; et même le rôle de certains acides aminés des résidus dans le mécanisme. Certaines enzymes changent de forme de manière significative pendant le mécanisme; dans de tels cas, il est utile de déterminer la structure de l'enzyme, avec ou sans analogues de substrats liés qui ne subissent pas la réaction enzymatique.
Tous les catalyseurs biologiques ne sont pas des enzymes protéiques; Les catalyseurs à base d'ARN, tels que ribozymes et ribosomes sont essentiels pour de nombreuses fonctions cellulaires, telles que Et épissage de l'ARN traduction. La principale différence entre les ribozymes et les enzymes, ce est que les catalyseurs d'ARN exercent un ensemble plus limité de réactions, bien que leur les mécanismes et la cinétique de la réaction peuvent être analysées et classées selon les mêmes méthodes.
Principes généraux

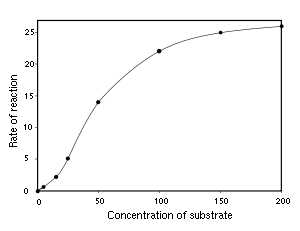
La réaction catalysée par une enzyme utilise exactement les mêmes réactifs et produit les mêmes produits que la réaction non catalysée. Comme d'autres catalyseurs , les enzymes ne modifient pas la position de l'équilibre entre les substrats et produits. Cependant, contrairement à des réactions chimiques non catalysée, les réactions catalysées par les enzymes présentent une cinétique de saturation. Pour une concentration d'enzyme donnée et pour des concentrations relativement faibles de substrat, les hausses de taux de réaction linéairement avec la concentration du substrat; les molécules d'enzyme sont en grande partie libre pour catalyser la réaction, et l'augmentation de la concentration du substrat signifie une vitesse croissante au cours de laquelle les molécules d'enzyme et de substrat se heurtent les uns les autres. Cependant, à des concentrations relativement élevées de substrat, la vitesse de réaction approche asymptotiquement du maximum théorique; les sites d'enzyme active sont presque tous occupés et la vitesse de réaction est déterminé par le taux de rotation intrinsèque de l'enzyme. Le milieu de la concentration en substrat entre ces deux cas limites est désigné par K M.
Les deux propriétés cinétiques plus importants d'une enzyme sont la vitesse à laquelle l'enzyme est saturé avec un substrat particulier, et la vitesse maximale qu'il peut atteindre. La connaissance de ces propriétés suggère ce que pourrait faire une enzyme dans la cellule et peut montrer comment l'enzyme répondra aux changements dans ces conditions.
Des essais enzymatiques

Des essais enzymatiques sont des procédures de laboratoire permettant de mesurer la vitesse des réactions enzymatiques. Étant donné que les enzymes ne sont pas consommées par les réactions qu'elles catalysent, des dosages enzymatiques suivent habituellement les changements dans la concentration des substrats ou des produits, soit de mesurer la vitesse de réaction. Il existe de nombreuses méthodes de mesure. Dosages spectrophotométriques observer le changement dans la absorbance de la lumière entre les produits et réactifs; dosages radiométriques impliquent l'incorporation ou la libération de la radioactivité pour mesurer la quantité de produit fabriqué au fil du temps. Dosages spectrophotométriques sont le plus commode étant donné qu'ils permettent la vitesse de la réaction à mesurer en continu. Bien que les dosages radiométriques nécessitent le retrait et le comptage des échantillons (autrement dit, ils sont des essais discontinus) ils sont généralement extrêmement sensibles et peuvent mesurer de très faibles niveaux d'activité de l'enzyme. Une approche analogue est d'utiliser la spectrométrie de masse pour contrôler l'incorporation ou la libération d' isotopes stables comme substrat est converti en produit.
Les dosages enzymatiques plus sensibles utilisent des lasers ont porté à travers un microscope pour observer les changements dans les molécules enzymatiques simples comme ils catalysent leurs réactions. Ces mesures, soit les changements d'utilisation de la fluorescence de cofacteurs pendant le mécanisme, ou de réaction d'une enzyme colorants ajoutés sur des sites spécifiques de la fluorescents protéines de rapporter les mouvements qui se produisent pendant la catalyse. Ces études fournissent une nouvelle vision de la cinétique et la dynamique des enzymes simples, par opposition à la cinétique enzymatique traditionnels, qui observe le comportement moyen des populations de millions de molécules d'enzyme.
Sur la gauche est représentée une courbe typique de progression pour un dosage enzymatique. L'enzyme produit un produit à linéaire vitesse initiale au début de la réaction. Plus tard dans cette courbe de progression, le taux ralentit comme substrat est utilisé ou produits se accumulent. La longueur de la période initiale du taux dépend des conditions de dosage et peut aller de quelques millisecondes à quelques heures. dosages enzymatiques sont généralement mis en place pour produire un taux initial a duré plus d'une minute, pour effectuer des mesures plus facile. Toutefois, les équipements pour les liquides de mélange rapide permet des mesures cinétiques rapides sur les taux initiaux de moins d'une seconde. Ces dosages très rapides sont essentiels pour mesurer la cinétique étatiques pré-stable, qui sont discutés ci-dessous.
La plupart des études cinétiques de l'enzyme de se concentrer sur cette partie initiale, linéaire de réactions enzymatiques. Cependant, il est également possible de mesurer la courbe de réaction complète et adapter ces données à un non-linéaire équation de vitesse. Cette façon de mesurer les réactions enzymatiques se appelle l'analyse des progrès courbe. Cette approche est utile en tant qu'alternative à cinétique rapide lorsque le taux initial est trop rapide pour mesurer avec précision.
Réactions à substrat unique
Enzymes avec mécanismes unique substrat comprennent isomérases telles que triosephosphateisomerase ou bisphosphoglycérate mutase, intramoléculaire tels que les lyases l'adénylate cyclase et la ribozyme en tête de marteau, une lyase d'ARN. Cependant, certaines enzymes qui ne ont qu'un seul substrat ne tombent pas dans cette catégorie de mécanismes. La catalase est un exemple de cela, comme l'enzyme réagit avec une première molécule de peroxyde d'hydrogène substrat, se oxyde et l'on réduit ensuite par une deuxième molécule de substrat. Bien qu'un seul substrat est impliquée, l'existence d'une enzyme modifiée moyen intermédiaire que le mécanisme de catalase est en fait un mécanisme de ping-pong, un type de mécanisme qui est discuté dans la section des réactions multi-substrat au-dessous.
Cinétique de Michaelis-Menten
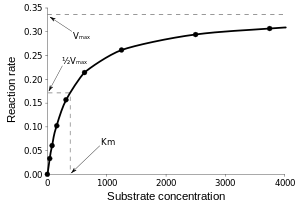

En raison de réactions catalysées par des enzymes sont saturable, leur taux de la catalyse ne montre pas une réponse linéaire à l'augmentation substrat. Si le taux initial de la réaction est mesurée sur une plage de concentrations de substrat (désignée par [S]), le taux (v) de réaction augmente à mesure que [S] augmente, comme représenté sur la droite. Cependant, comme [S] est grand, plus l'enzyme devient saturé avec le substrat et le taux atteint V max, taux maximum de l'enzyme.
Le Michaelis-Menten modèle cinétique d'une réaction à substrat unique se affiche sur la droite. Il ya une première réaction bimoléculaire entre l'enzyme E et le substrat S pour former les ES complexe enzyme-substrat. Bien que le mécanisme enzymatique pour la réaction unimoléculaire 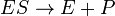 réaction peut être assez complexe, il est généralement une étape enzymatique de détermination de vitesse qui permet au mécanisme pour être modélisée comme une étape catalytique unique de constante de vitesse k 2.
réaction peut être assez complexe, il est généralement une étape enzymatique de détermination de vitesse qui permet au mécanisme pour être modélisée comme une étape catalytique unique de constante de vitesse k 2.
![\ Begin {matrix} v = k_2 [\ mbox {ES}] \ end {matrix}](../../images/557/55719.png) (Équation 1).
(Équation 1).
k 2 est également appelé k cat ou le nombre de rotation, le nombre maximal de réactions enzymatiques catalysées par seconde.
A de faibles concentrations de substrat [S], l'enzyme existe dans un équilibre entre la forme libre à la fois E et ES les complexes enzyme-substrat; augmentant [S] augmente également [ES] au détriment de [E], déplacer l'équilibre de liaison vers la droite. Étant donné que la vitesse de la réaction dépend de la concentration [ES], le taux est sensible à de petites variations de [S]. Cependant, à très haute [S], l'enzyme est entièrement saturé avec le substrat, et ne existe que sous la forme ES. Dans ces conditions, le taux (v ≈ k 2 [E] tot = V max) est insensible à de petits changements en [s]; ici, [E] tot est la concentration d'enzyme totale
qui est approximativement égale à la concentration [ES] dans des conditions de saturation.
Le Équation de Michaelis-Menten décrit comment la vitesse de réaction c dépend de la position de la liaison au substrat équilibre et la constante de vitesse k 2. Michaelis et Menten montré lorsque k 2 est bien inférieure à k-1 (appelé l'hypothèse d'équilibre) ils pourraient dériver l'équation suivante:
![v = \ frac {V_ \ max [\ mbox {S}]} {K_m + [\ mbox {S}]}](../../images/557/55721.png) (Equation 2)
(Equation 2)
Cette équation de Michaelis-Menten est la base pour la plupart des cinétiques enzymatiques à substrat unique.
La constante de Michaelis K m est défini comme la concentration à laquelle la vitesse de la réaction enzymatique est la moitié de V max. Ceci peut être vérifié par la substitution [S] = K m dans l'équation de Michaelis-Menten. Si l'étape enzymatique de détermination de vitesse est lente par rapport au substrat de dissociation (k 2 k << -1), le Michaelis constante K m est à peu près la la constante de dissociation du complexe ES, bien que cette situation est relativement rare.
La situation plus normale où k 2> k -1 est parfois appelé Briggs- Cinétique Haldane. L'équation de Michaelis-Menten détient encore dans ces conditions plus générales, qu'elle peut être dérivée à partir de la l'état d'équilibre rapprochement. Au cours de la période à taux initial, la vitesse de réaction est à peu près constante v, indiquant que [ES] est similaire constante (voir équation 1):
Par conséquent, la concentration [ES] est donnée par la formule
où le constante de Michaelis K m est défini
([E] est la concentration d'enzyme libre). Pris ensemble, la formule générale de la vitesse de réaction est de nouveau v l'équation de Michaelis-Menten:
La constante de spécificité 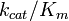 est une mesure de l'efficacité d'une enzyme convertit un substrat en produit. En utilisant la définition de la constante de Michaelis
est une mesure de l'efficacité d'une enzyme convertit un substrat en produit. En utilisant la définition de la constante de Michaelis 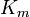 , L'équation de Michaelis-Menten peut être écrit sous la forme
, L'équation de Michaelis-Menten peut être écrit sous la forme
où [E] est la concentration d'enzyme libre. Ainsi, la constante de spécificité est un moyen efficace taux constant pendant enzyme libre-seconde pour réagir avec le substrat sans pour former un produit. La constante de spécificité est limitée par la fréquence à laquelle le substrat et l'enzyme rencontrer les uns les autres en solution, aussi élevée que 10 10 M -1 s -1. Fait étonnant, cette vitesse maximale est quasiment pas affectée par la taille de l'une ou l'autre substrat ou l'enzyme. Le rapport des constantes de spécificité pour les deux substrats est une comparaison quantitative de l'efficacité de l'enzyme est dans la conversion de ces substrats. La pente du graphique de Michaelis-Menten à faible concentration de substrat [S] (où [S] << K m), on obtient également la constante de spécificité.
Parcelles linéaires de l'équation de Michaelis-Menten
Utiliser un outil interactif de Michaelis-Menten cinétique tutoriel à l'Université de Virginie, les effets sur le comportement d'une enzyme de la variation des constantes cinétiques peuvent être explorées.
L'intrigue de v en fonction [S] ci-dessus ne est pas linéaire; bien linéaire initialement à faible [S], il se penche pour saturer à haute [S]. Avant l'ère moderne de ajustement de courbe non linéaire sur les ordinateurs, cette non-linéarité pourrait rendre difficile l'estimation de K m et V max avec précision. En conséquence, plusieurs chercheurs ont développé des linéarisations de l'équation de Michaelis-Menten, tels que la Lineweaver-Burk, le Diagramme Eadie-Hofstee et le Parcelle Hanes-Woolf. Toutes ces représentations linéaires peut être utile pour la visualisation des données, mais aucun ne devrait être utilisée pour déterminer les paramètres cinétiques, comme un logiciel informatique est facilement disponible qui permet une détermination plus précise par des méthodes de régression non linéaire.
Le Lineweaver-Burk ou double intrigue est réciproque manière commune d'illustrer données cinétiques. Ce est produit en prenant la réciproque des deux côtés de l'équation de Michaelis-Menten. Comme indiqué sur la droite, ce est une forme linéaire de l'équation de Michaelis-Menten et produit une ligne droite avec l'équation y = m x + c avec une ordonnée à l'origine y équivalente à 1 / V max et un x ordonnée à l'origine du graphique représentant -1 / K m.
Naturellement, pas de valeurs expérimentales peuvent être prises à négative 1 / [S]; la valeur limite inférieure de 1 / [S] = 0 (l'ordonnée à l'origine) correspond à une concentration de substrat infini, où 1 / v = 1 / V max en tant que montrée ci-dessous; Ainsi, l'ordonnée à l'origine x est un extrapolation des données expérimentales prises à des concentrations positives. Plus généralement, l'intrigue de Lineweaver-Burk biaise l'importance des mesures prises à de faibles concentrations de substrat et, par conséquent, peuvent donner des estimations inexactes de V max et K m. Une méthode de tracé linéaire plus précis est le Eadie-Hofstee parcelle. Dans ce cas, v est tracé par rapport v / [S]. Dans la troisième représentation linéaire commun, le Hanes-Woolf complot, [S] / v est tracé en fonction [S]. En général, la normalisation des données peut aider à diminuer la quantité de travail expérimental et peut augmenter la fiabilité de la sortie, et est adapté à la fois pour l'analyse graphique et numérique.
L'importance concrète de constantes cinétiques
L'étude de la cinétique enzymatique est important pour deux raisons essentielles. Tout d'abord, il permet d'expliquer le fonctionnement des enzymes, et d'autre part, il permet de prédire comment les enzymes se comportent dans les organismes vivants. Les constantes cinétiques définies ci-dessus, K m et V max, sont essentielles pour tenter de comprendre comment les enzymes travaillent ensemble pour contrôler métabolisme.
La réalisation de ces prévisions ne est pas anodin, même pour les systèmes simples. Par exemple, oxaloacétate est formé par malate déshydrogénase dans le mitochondrie . L'oxaloacétate peut alors être consommé par la citrate synthase, phosphoénolpyruvate carboxykinase ou aspartate aminotransférase, l'alimentation dans le cycle de l'acide citrique, néoglucogenèse ou aspartique biosynthèse de l'acide, respectivement. Le fait de pouvoir prédire combien oxaloacétate qui va dans la voie nécessite la connaissance de la concentration de l'oxaloacétate ainsi que la concentration et la cinétique de chacune de ces enzymes. Ce but de prévoir le comportement des voies métaboliques atteint son expression la plus complexe dans la synthèse de quantités énormes de cinétique et des données d'expression de gènes dans des organismes modèles mathématiques entières. Bien que cet objectif est loin dans le futur pour tout eucaryote , des tentatives sont actuellement déployés pour atteindre cet objectif dans les bactéries , avec des modèles du métabolisme Escherichia coli maintenant produites et testées.
Réactions multi-substrats
Réactions multi-substrats suivent équations de vitesse complexes qui décrivent comment les substrats lient et dans quel ordre. L'analyse de ces réactions est beaucoup plus simple si la concentration de substrat A est maintenu constant et le substrat B varié. Dans ces conditions, l'enzyme se comporte exactement comme une enzyme unique substrat et un terrain de v par [S] donne apparente K m et constantes V max pour substrat B. Si un ensemble de ces mesures est effectuée à différentes concentrations fixes de A, ces données peuvent être utilisées pour travailler sur ce que le mécanisme de la réaction est. Pour une enzyme qui prend deux substrats A et B et les transforme en deux produits P et Q, il existe deux types de mécanismes: complexe ternaire et de ping-pong.
Ternaire mécanismes complexes
Dans ces enzymes, les deux substrats se lient à l'enzyme à la fois pour produire un complexe ternaire EAB. L'ordre de la liaison peut être soit aléatoire (dans un mécanisme aléatoire) ou substrats avoir à lier dans un ordre particulier (dans un mécanisme commandé). Quand un ensemble de v par [S] courbes (Correction d'un variant, B) d'une enzyme avec un mécanisme complexe ternaire sont tracées dans un Lineweaver-Burk, l'ensemble des lignes produits coupera.
Enzymes avec des mécanismes complexes ternaires comprennent la glutathion S -transferase, dihydrofolate réductase et ADN polymérase. Les liens suivants montrent de courtes animations des mécanismes complexes ternaires du enzymes dihydrofolate réductase et l'ADN polymérase.
Mécanismes de ping-pong
Comme indiqué sur la droite, les enzymes avec un mécanisme de ping-pong peut exister dans deux états, E et une forme chimiquement modifiée de l'enzyme E *; cette enzyme modifiée est connu comme un intermédiaire. Dans de tels mécanismes, le substrat se lie A, modifie l'enzyme de E * par, par exemple, le transfert d'un groupe chimique au site actif, et est ensuite libéré. Ce ne est qu'après le premier substrat est libéré peut substrat B BIND et réagir avec l'enzyme modifiée, régénérer la forme de E non modifiée. Quand un ensemble de v par [S] courbes (A fixe, variant B) d'une enzyme avec un mécanisme de ping-pong sont tracées dans une parcelle de Lineweaver-Burk, un ensemble de lignes parallèles sera produite.
Enzymes avec des mécanismes de ping-pong comprennent certains oxydoréductases telles que thiorédoxine peroxydase, transferases tels que acylneuraminate cytydilyltransferase et serine proteases telles que la trypsine et chymotrypsine. sérine protéases sont une famille très commun et diversifié d'enzymes, y compris des enzymes digestives (trypsine, chymotrypsine, élastase), et plusieurs enzymes de la coagulation du sang cascade et beaucoup d'autres. Dans ces protéases à sérine, la E * est une espèce intermédiaire acyl-enzyme formées par l'attaque d'un site actif résidu de serine à une liaison peptidique dans un substrat protéique. Une courte animation montrant le mécanisme de la chymotrypsine est liée ici.
Cinétique non-Michaelis-Menten
Certaines enzymes produisent un sigmoïde v par [S] complot, qui indique souvent la liaison coopérative de substrat au site actif. Cela signifie que la liaison d'une molécule de substrat affecte la liaison de molécules de substrat suivantes. Ce comportement est plus fréquent chez les enzymes multimères avec plusieurs sites actifs en interaction. Ici, le mécanisme de coopération est similaire à celui de l'hémoglobine, avec une liaison de substrat à un site actif, modifiant l'affinité des autres sites actifs pour des molécules de substrat. Coopérativité positive est observée lors de la liaison de la première molécule de substrat augmente l'affinité des autres sites actifs pour substrat. Coopérativité négative se produit lors de la liaison du premier substrat diminue l'affinité de l'enzyme pour d'autres molécules de substrat.
Enzymes allostériques comprennent tyrosyl mammifère ARNt synthétase, qui montre coopérativité négative, et bactérienne aspartate et transcarbamoylase phosphofructokinase, qui montrent coopération positive.
Coopérativité est étonnamment commun et peut aider à réguler les réponses des enzymes à des changements dans les concentrations de leurs substrats. Coopérativité positive rend enzymes beaucoup plus sensible à [S] et de leurs activités peut montrer de grandes variations sur une gamme étroite de la concentration du substrat. Inversement, coopérativité négative rend enzymes insensibles à de petits changements dans [S].
Le Équation de Hill est souvent utilisé pour décrire le degré de coopérativité quantitativement la cinétique non-Michaelis-Menten. The Hill coefficient n mesures dérivées combien la liaison du substrat à un site actif affecte la liaison de substrat aux autres sites actifs. Un coefficient de Hill de <1 indique coopérativité négative et un coefficient de> 1 indique positif coopérativité.
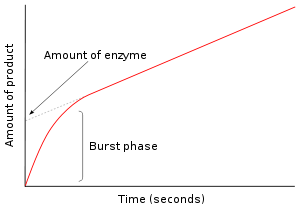
Cinétique étatiques pré-stationnaire
Dans le premier moment après une enzyme est mélangée avec le substrat, aucun produit n'a pas été formé et intermédiaires existent. L'étude des quelques prochaines millisecondes de la réaction est appelée cinétique étatiques pré-stable. Cinétique étatiques pré-stationnaire est donc concerné par la formation et la consommation d'intermédiaires enzyme-substrat (comme ES ou E *) jusqu'à ce que leur concentrations à l'état d'équilibre sont atteintes.
Cette première approche a été appliquée à la réaction d'hydrolyse catalysée par chymotrypsine. Souvent, la détection d'un intermédiaire est une pièce essentielle de preuves dans les enquêtes de ce mécanisme une enzyme suit. Par exemple, dans les mécanismes de ping-pong qui sont indiqués ci-dessus, des mesures cinétiques rapides peuvent suivre la libération de produit P et mesurer la formation de l'intermédiaire E enzyme modifiée *. Dans le cas de la chymotrypsine, cet intermédiaire est formée par l'attaque du substrat par la serine nucléophile dans le site actif et la formation de l'enzyme acyl-intermédiaire.
Dans la figure de droite, l'enzyme produit E * rapidement dans les premières secondes de la réaction. Le taux ralentit alors que l'état d'équilibre est atteint. Cette phase de salve rapide de la réaction de mesurer une rotation unique de l'enzyme. Par conséquent, la quantité de produit libéré dans cette rafale, représenté comme le point d'intersection sur l'axe des y du graphique, donne également la quantité d'enzyme fonctionnel qui est présent dans le dosage.
mécanisme chimique
Un objectif important de mesurer la cinétique enzymatique est de déterminer le mécanisme chimique d'une réaction enzymatique, à savoir, la séquence d'étapes chimiques qui transforment substrat en produit. Les approches décrites ci-dessus seront cinétiques montrer à quels taux intermédiaires sont formés et inter-convertis, mais ils ne peuvent pas identifier exactement ce que ces intermédiaires sont.
Les mesures cinétiques prises dans diverses conditions de solution ou d'enzymes ou de substrats légèrement modifiées jeter souvent la lumière sur ce mécanisme chimique, car ils révèlent l'étape de détermination de vitesse ou des intermédiaires dans la réaction. Par exemple, la rupture d'un liaison covalente à un hydrogène atome est une étape déterminant la vitesse courante. Lequel des transferts d'hydrogène possibles est déterminant la vitesse peut être montré en mesurant les effets cinétiques de la substitution de l'hydrogène par deutérium, son écurie isotopes . Le taux change lorsque l'hydrogène est remplacé critique, en raison d'un primaire effet cinétique des isotopes, qui se produit parce que les obligations à deutérium sont plus difficiles à briser puis obligations à l'hydrogène. Il est également possible de mesurer les effets similaires avec d'autres substitutions isotopiques, tels que 13 C / 12 C et 18 O / 16 O, mais ces effets sont plus subtils.
Les isotopes peuvent également être utilisés pour révéler le sort de différentes parties des molécules de substrat dans les produits finaux. Par exemple, il est parfois difficile de déterminer l'origine d'un oxygène atome dans le produit final; car il peut-être venu de l'eau ou d'une partie du substrat. Ceci peut être déterminé par le remplacement systématique des isotopes stables de l'oxygène 18 O dans les différentes molécules qui participent à la réaction et à la vérification de l'isotope dans le produit. Le mécanisme chimique peut également être élucidée en examinant la cinétique et les effets isotopiques dans différentes conditions de pH, en modifiant les ions métalliques ou autre borne des cofacteurs, par mutagenèse dirigée des résidus d'acides aminés conservés, ou en étudiant le comportement de l'enzyme en présence d'analogues de substrat (s).
Inhibition enzymatique
Les inhibiteurs d'enzymes sont des molécules qui réduisent ou suppriment l'activité enzymatique. Ce sont soit réversible (enlèvement de l'inhibiteur restaure l'activité enzymatique) ou irréversibles (c., l'inhibiteur de l'enzyme inactive de façon permanente).
Inhibiteurs réversibles
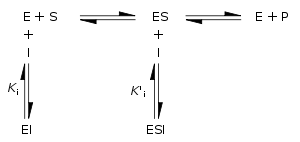
Inhibiteurs de l'enzyme réversibles peuvent être classés comme concurrentiel, non compétitif, non-compétitive ou mixte, en fonction de leurs effets sur K m et V max. Ces différents effets résultent de la liaison à l'enzyme E inhibiteur, les ES complexe enzyme-substrat, ou des deux, comme représenté sur la figure de droite et le tableau ci-dessous. Le type particulier d'un inhibiteur peut être discernée par l'étude de la cinétique de l'enzyme en fonction de la concentration en inhibiteur. Les quatre types d'inhibition produits Lineweaver-Burke et Eadie-Hofstee parcelles qui varient de manières distinctes avec concentration en inhibiteur. Par souci de concision, deux symboles sont utilisés:
![\ Alpha = 1 + \ frac {[\ mbox {I}]} {K_ {i}}](../../images/557/55760.png) et
et ![\ Alpha ^ {\ prime} = 1 + \ frac {[\ mbox {I}]} {K_ {i} ^ {\ prime}}](../../images/557/55761.png)
où K i et K 'i sont les les constantes de dissociation pour la liaison à l'enzyme et au complexe enzyme-substrat, respectivement. En présence de l'inhibiteur réversible, apparente K m et V max de l'enzyme devienne (α / α ') et K m (1 / α') V max, respectivement, comme indiqué ci-dessous dans les cas courants.
| Type d'inhibition | K m apparent | V max apparent | ||
| K i seulement | ( 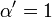 ) ) | compétitif |  | 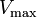 |
| K i 'seulement | ( 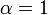 ) ) | non compétitive | 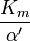 | 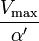 |
| K i = K i ' | ( 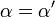 ) ) | non-concurrentiel | 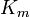 | 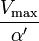 |
| K i ≠ K i ' | ( 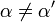 ) ) | mixte | 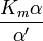 | 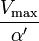 |
Crises de régression non linéaire des données cinétiques de l'enzyme aux équations de taux ci-dessus peuvent donner des estimations précises des constantes de dissociation K i et K 'i.
Inhibiteurs irréversibles
Les inhibiteurs d'enzymes peuvent également inactiver irréversiblement enzymes, généralement en modifiant de façon covalente résidus du site actif. Ces réactions, qui peuvent être appelés substrats de suicide, suivent fonctions de décroissance exponentielle et sont généralement saturable. Dessous de la saturation, ils suivent premiers ordre cinétique par rapport à l'inhibiteur.
Les mécanismes de catalyse
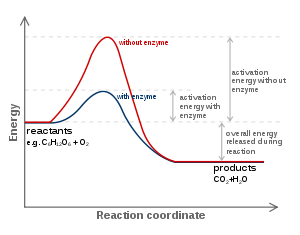
Le modèle privilégié pour l'interaction enzyme-substrat est le modèle ajustement induit. Ce modèle propose que l'interaction initiale entre l'enzyme et le substrat est relativement faible, mais que ces interactions faibles induisent rapidement des changements conformationnels dans l'enzyme que renforcer la liaison. Ces apporter des changements conformationnels également des résidus catalytiques dans le site actif à proximité des liaisons chimiques dans le substrat qui sera modifiée dans la réaction. Après la liaison a lieu, un ou plusieurs mécanismes de la catalyse réduire l'énergie de la réaction de la transition état en fournissant une voie chimique de remplacement pour la réaction. Mécanismes de la catalyse incluent la catalyse par la souche obligataire; par la proximité et l'orientation; par site actif donneurs de protons ou accepteurs; covalente catalyse et tunnel quantique.
Cinétique enzymatique qui ne peuvent pas prouver modes de catalyse sont utilisés par une enzyme. Toutefois, certaines données cinétiques peuvent suggérer des possibilités à examiner par d'autres techniques. Par exemple, un mécanisme de ping-pong avec une cinétique étatiques pré-stationnaire rafale phase suggérerait catalyse covalente pourrait être important dans le mécanisme de cette enzyme. Alternativement, l'observation d'un effet de pH fort sur V max mais pas K m pourraient indiquer qu'un résidu dans le site actif doit être en particulier état d'ionisation pour la catalyse de se produire.

![[\ Mbox {} E] _ \ mathrm {tot} \ \ stackrel {\ mathrm {def}} {} = \ [\ mbox {} E] + [\ mbox {ES}]](../../images/557/55720.png)
![\ Frac {d} {dt} [\ mbox {ES}] = K_ {1} [\ mbox {E}] [\ mbox {S}] - K_ {2} [\ mbox {ES}] - k _ {- 1} [\ mbox {ES}] \ environ 0.](../../images/557/55722.png)
![[\ Mbox {ES}] \ approx \ frac {[\ mbox {} E] _ \ mathrm {tot} [\ mbox {S}]} {[\ mbox {S}] + K_ {m}}](../../images/557/55723.png)
![K_ {m} \ \ stackrel {\ mathrm {def}} {=} \ \ frac {k_ {2} + k _ {- 1}} {k_ {1}} \ approx \ frac {[\ mbox {E}] [\ mbox {S}]} {[\ mbox {} ES]}](../../images/557/55724.png)
![v = K_ {2} [\ mathrm {} ES] = \ frac {k_ {2} [\ mbox {} E] _ \ mathrm {tot} [\ mbox {S}]} {[\ mbox {S}] + K_ {m}} = \ frac {V_ \ max [\ mbox {S}]} {[\ mbox {S}] + K_ {m}}.](../../images/557/55725.png)
![v = K_ {2} [\ mathrm {} ES] = \ frac {k_ {2}} {{K_ m}} [\ mbox {} E] [\ mbox {S}]](../../images/557/55728.png)

![\ Frac {1} {c} = \ frac {K_ {m}} {V_ \ max [\ mbox {S}]} + \ frac {1} {V_ \ max}](../../images/557/55736.png)